2. 汪添益现在苏州大学附属儿童医院泌尿外科,苏州 215000
2. Wang Tianyi is now in Department of Urology, Children's Hospital Affiliated to Soochow University, Suzhou 215000, China
芳香化酶缺乏症(aromatase deficiency, AD)是由位于染色体15q21.1上CYP19A1基因失功能突变导致的一种先天性雌激素合成障碍综合征[1]。1991年Shozu等[2]首次报道AD,截至目前全球共报道AD约40例,暂无中文文献报道。由于AD表型多样,容易误诊,为提高临床医师对AD的认识,本研究回顾性分析首都医科大学附属北京儿童医院收治的1例AD患儿临床资料,并结合文献复习,探讨AD的临床特征及诊治方法。
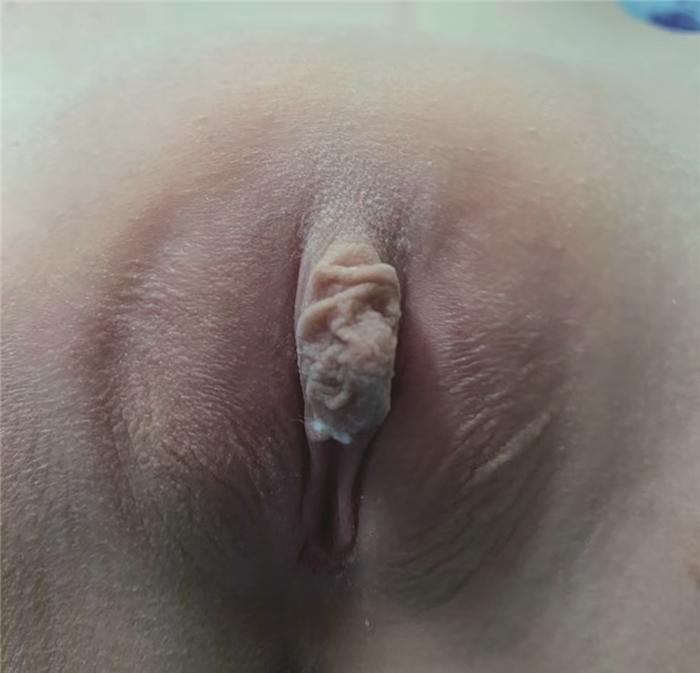
患儿女,9岁,因发现外生殖器异常9年就诊。患儿出生后即发现外生殖器异常,当地医院考虑为阴蒂肥大,未予进一步诊治,按女孩抚养,阴蒂肥大无明显进展。为明确诊断于2019年1月来本院就诊。患儿出生史无异常。母亲自孕3个月起出现声音低沉、痤疮等男性化表现,产后至今声音低沉无好转。父亲身高175 cm,母亲身高160 cm。否认近亲婚配史及家族中相关病史。查体:身高129 cm(生长曲线第25百分位),体重23.3 kg,乳房Tanner Ⅰ期,阴毛Tanner Ⅰ期。外生殖器呈男童外观,尿道开口于会阴部,阴蒂3.2 cm×1.3 cm,Prader分级Ⅰ级,外生殖器雄性化评分(external masculinization score, EMS)4分(图 1)。
|
图 1 1例女性芳香化酶缺乏症患儿外生殖器照片 Fig.1 Clinical phenotype of a female AD child with ambiguous genitalia |
实验室检查:促黄体生成素1.31 IU/L,促卵泡刺激素(follicle stimulating hormone, FSH)23.5 IU/L,血清睾酮 < 20.0 ng/dL,雌二醇(estradiol, E2) < 5 pg/mL, 促肾上腺皮质激素(8AM)23.1 pg/mL,血清皮质醇(8AM)12.7 μg/dL,17-羟孕酮0.894 ng/mL,脱氢表雄酮1.96 μg/L;雄烯二酮0.34 μg/L,游离睾酮28.71 pg/mL,双氢睾酮63.6 pg/mL。染色体核型测定为46, XX,全外显子检测显示CYP19A1基因存在一处纯合突变,编码区外显子5第343号核苷酸由胞嘧啶突变为胸腺嘧啶(c.343 C>T),导致氨基酸改变p.R115X,致病基因来源于患儿父母。盆腔B超检查提示双侧附件区条形低回声模糊显示,左侧1.0 cm×0.6 cm,右侧1.1 cm×0.5 cm,似卵巢,未见卵泡。左侧腕关节正位X线片提示骨龄相当于7岁左右,骨密度值0.564 g/cm2(Z评分-2.5),临床诊断为46, XX DSD、芳香化酶缺乏症。予口服戊酸雌二醇每日0.5 mg治疗,3个月后复查雌二醇、血卵泡刺激素水平均在正常范围内。于2020年1月至本院行阴蒂成形术,术后继续原剂量口服戊酸雌二醇,定期复查性激素、血生化、骨龄及骨密度等检查。
检索PubMed与Cochrane Library数据库,检索词为“aromatase”、“aromatase deficiency”和“CYP19A1”,检索截止日期为2020年4月。由于男性AD患儿早期无明显症状,多于成年后就诊,故本文不展开讨论。剔除男性AD病例及信息不全病例[2-24]。
总计22篇文献报道女性AD患儿共30例。30例患儿确诊时年龄平均8.62岁,均于出生后发现外生殖器异常。共存在35个致病突变(29种不同突变),其中位于外显子3的致病突变2个(2/35,5.71%),位于外显子4的致病突变2个(2/35,5.71%),位于外显子5的致病突变13个(13/35,37.14%),位于外显子6的致病突变3个(3/35,8.57%),位于外显子8的致病突变1个(1/35,2.86%),位于外显子9的致病突变7个(7/35,20.00%),位于外显子10的致病突变3个(3/35,8.57%);位于非外显子区域的致病突变4个(4/35,11.43%)。
30例患儿中存在孕期母体男性化(包括声音低沉、痤疮、胡须以及阴蒂肥大等)20例(20/30,66.67%),患儿母亲孕期无任何男性化表现10例(10/30,33.33%)。除14例信息不详外,16例存在骨龄延迟,平均延迟2.35年。在卵巢表型上,除4例病史不详外,9例(9/26,34.62%)存在双侧多发卵巢囊肿,8例(8/26,30.77%)存在双侧卵巢发育不良,9例(9/26,34.62%)卵巢发育正常。22例检测血清FSH,其中21例不同程度升高,仅1例在正常范围内;23例检测血清E2,其中22例降低,1例正常。9例予雌二醇替代治疗,其中8例治疗剂量为每日20 ug至1.25 mg,2例未报道具体剂量,1例未予雌二醇替代治疗。
讨论 芳香化酶缺乏症是由于CYP19A1基因失功能突变、芳香化酶合成障碍导致的一种常染色体隐性遗传病。芳香化酶是细胞色素P450酶的一种,在多种组织的细胞内质网膜上表达,如睾丸的Leydig细胞和Sertoli细胞、卵巢的颗粒细胞和黄体细胞、胎盘的合胞体滋养层、乳房、肝脏、神经元、脑(包括下丘脑)、血管平滑肌细胞、软骨细胞和成骨细胞等。芳香化酶具有特定的分子结构,可与雄激素特异性结合,将雄烯二酮、睾酮、16α-羟雄烯二酮分别转化为雌酮、雌二醇和雌三醇[3]。人类芳香化酶是位于染色体15q21.1上的单个基因CYP19A1 (OMIM 109710,GeneID 1588)的产物,该蛋白质编码序列由9个外显子组成,全长约35 kb,共编码503个氨基酸。自1991年Shozu等[2]首次报道芳香化酶缺乏症至今,已报道的CYP19A1基因编码区致突变超过35种,包括点突变、缺失、插入和数个剪接位点突变[2-24]。本研究总结30例女性患儿35处基因突变,共24处(24/35,68.57%)发生于芳香化酶功能的重要区域,包括外显子5(13/35,37.14%)编码酶催化活性必需的氨基酸,外显子9(7/35,20.00%)编码底物结合位点,外显子10(3/35,8.57%)编码关键的血红素结合结构域。本例患儿为CYP19A1基因外显子5存在纯合子突变(c.343 C>T,p.R115X),与既往报道相符。
妊娠期间,胎儿肾上腺和母体肾上腺产生大量硫酸脱氢表雄酮,最终在胎盘由芳香化酶转化为雌激素(主要是雌三醇)。AD患儿由于胎儿芳香化酶缺乏,雌激素合成受阻,硫酸脱氢表雄酮最终转化为睾酮,使母体与胎儿暴露于大量雄激素,进而导致母体和胎儿男性化,以及AD患儿在不同发育时期表现出的生殖、骨骼及代谢等系统的一系列临床表现[24-26]。
本病特征之一是孕有AD胎儿的母亲在孕3个月后出现母体男性化表现,包括声音低沉、痤疮、多毛症、胡须以及阴蒂肥大等[24-26]。母体男性化表现多数在分娩后逐渐消退,但声音低沉可能长期存在[1]。有学者认为胎盘芳香化酶活性超过正常水平1%即可避免母体发生严重的男性化,但本研究30例女性AD患儿中,仅有10例患儿母亲妊娠期间未出现母体男性化[27]。本例患儿母亲自孕3个月开始出现声音低沉、痤疮等男性化表现,产后至今声音低沉仍无好转。此外有文献报道1例AD患儿母亲在妊娠期间出现卵巢囊肿,考虑诊断为分泌雄激素的卵巢肿瘤,术后病理结果为良性卵巢囊肿,提示孕妇男性化应考虑胎儿是否患有芳香化酶缺乏症,妊娠干预应慎重[3]。
性别、年龄、酶活性水平等因素可影响芳香化酶缺乏症患儿的临床特征。由于AD患儿胎儿时期在子宫内暴露于大量雄激素环境,从而导致女性患儿出生后外生殖器存在不同程度男性化[25-26]。既往学者认为女性AD患儿在婴儿期和儿童期由于雌激素合成障碍导致长期血FSH升高,进而导致部分患儿多囊卵巢[13-14]。复习既往文献,共26例报道卵巢发育情况,其中双侧多发卵巢囊肿9例,双侧卵巢发育不良8例,9例卵巢发育正常,说明女性AD患儿没有一致卵巢表型。关于女性AD患儿卵巢表型多样的原因,目前尚无文献报道其明确机制。本例患儿染色体核型为46, XX,生后即存在外生殖器男童外观,与既往部分病例类似,初次就诊时B超发现双侧卵巢发育不良[11, 15, 19-21]。此外,芳香化酶缺乏可导致青春期女性AD患儿性腺功能亢进、青春期延迟、原发性闭经、骨骺延迟闭合、骨量减少、骨密度降低和骨质疏松等[22-26]。由于芳香化酶缺乏,雄雌素及其前体在体内蓄积,导致女性AD患儿青春期男性化加重、第二性征不出现,本例患儿青春期已启动,但睾酮、双氢睾酮指标均正常,考虑可能与青春期刚启动有关[14]。本例初诊时年龄9岁,左手腕关节正位片提示骨龄相当于7岁左右,骨密度值检查Z评分-2.5,证实骨密度降低。
芳香化酶缺乏症作为46, XX性发育异常(disorder of sex development, DSD)罕见病因之一,需与先天性肾上腺皮质增生症(congenital adrenal hyperplasia, CAH)相鉴别[28]。对于46, XX DSD患儿,若血孕酮、睾酮、雄烯二酮、17-羟孕酮增高,皮质醇降低,伴或不伴促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)增高,则提示CAH可能[25];若雌二醇明显降低或检测不到,血睾酮降低或正常,LH正常或升高,FSH明显升高,则应怀疑AD的可能,可追问是否存在患儿母亲孕期男性化病史,再行CYP19A1基因分析以明确诊断。Dursun等[22]报道1例孕23周早产女性AD患儿,因生后30 d查血17-羟孕酮显著升高,皮质醇水平低而误诊为CAH,并予氢化可的松治疗至1岁,提示极早早产儿相关激素正常参考区间数据缺乏,46, XX DSD的病因诊断应更加慎重。
目前关于口服雌激素预防女性AD患儿相关临床症状尚无定论,治疗经验主要源自9.6~14.0岁青春期发育不能启动的女性患儿[3]。综合近年来文献,多数学者认为确诊AD的女性患儿在儿童早期予低剂量雌激素治疗(50~100 μg/d)保证正常线性生长及骨龄成熟;而青春期前及青春期儿童予较高剂量雌激素(1.4~2 mg/d)治疗可使卵巢囊肿消退,有效抑制垂体-卵巢轴促性腺激素的分泌、乳房发育,诱导生长加速和骨骺闭合,并在青春期诱导月经初潮并维持月经周期[1, 3, 25]。由于AD患儿产前环境高水平雄激素干扰与男性性别认定无关,但与男性化相关行为密切相关,因此对于AD患儿建议按女孩抚养,择期行手术治疗。既往有关AD的研究多为病例报道,部分提及手术方式,但未对AD患儿的手术方式进行总结。Prader分级Ⅰ级、Ⅱ级的AD患儿主要表现为阴蒂肥大,阴道和尿道各自开口,可行阴蒂成形术;Prader Ⅲ级以上者存在尿生殖窦畸形,应根据尿生殖窦共同管长度决定手术方式。尿道和阴道共同管长度<2.5 cm者可一期行阴蒂成形术+尿生殖窦部分游离术(partial urogenital mobilization, PUM);尿道和阴道共同管长度≥2.5 cm者建议一期行阴蒂成形术,青春期后行二期尿生殖窦游离术或肠代阴道完成阴道成形术,亦可根据情况行一期阴蒂成形术+尿生殖窦整体游离术。本例患儿Prader分级Ⅰ级,行一期阴蒂成形术,术后半年对患儿随访完成儿童性角色CSRI量表,结果提示患儿女性倾向大。目前文献报道仅有2例女性AD患儿因生后外生殖器严重男性化被作为男性抚养长大,并表现出男性的性别特征和取向,于青春期后行乳房切除术+输卵管卵巢切除术+子宫切除术+外生殖器成形术+双侧睾丸假体植入术[11, 23]。
综上,芳香化酶缺乏症作为46, XX DSD罕见病因之一,可导致AD患儿母亲孕期男性化、女性患儿生后外生殖器模糊或男性化、青春期延迟、原发性闭经、卵巢囊肿/卵巢发育不良、骨骺闭合延迟、骨密度降低以及一系列代谢异常等问题。临床应提高对芳香化酶缺乏症的认识,在排除46, XX DSD常见病因后应考虑到该病的可能,必要时行CYP19A1基因分析,力争早期诊断并给予早期雌激素替代治疗,以减轻或改善本病的临床症状。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 汪添益、宋宏程、张潍平负责研究的设计、实施和起草文章;汪添益、杨洋进行文献检索、病例数据收集及分析;汪添益、宋宏程负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
于宝生. 芳香化酶缺乏症研究进展[J]. 中华实用儿科临床杂志, 2017, 32(20): 1533-1539. Yu BS. Research advances of aromatase deficiency[J]. Chin J Appl Clin Pediatr, 2017, 32(20): 1533-1539. DOI:10.3760/cma.j.issn.2095-428X.2017.20.004 |
| [2] |
Shozu M, Akasofu K, Harada T, et al. A new cause of female pseudohermaphroditism: placental aromatase deficiency[J]. J Clin Endocrinol Metab, 1991, 72(3): 560-566. DOI:10.1210/jcem-72-3-560 |
| [3] |
Zhu WJ, Cheng T, Zhu H, et al. Aromatase deficiency: a novel compound heterozygous mutation identified in a Chinese girl with severe phenotype and obvious maternal virilization[J]. Mol Cell Endocrinol, 2016, 433: 66-74. DOI:10.1016/j.mce.2016.05.025 |
| [4] |
Harada N, Ogawa H, Shozu M, et al. Genetic studies to characterize the origin of the mutation in placental aromatase deficiency[J]. Am J Hum Genet, 1992, 51(3): 666-672. |
| [5] |
Ito Y, Fisher CR, Conte FA, et al. Molecular basis of aromatase deficiency in an adult female with sexual infantilism and polycystic ovaries[J]. Proc Natl Acad Sci U S A, 1993, 90(24): 11673-11677. DOI:10.1073/pnas.90.24.11673 |
| [6] |
Conte FA, Grumbach MM, Ito Y, et al. A syndrome of female pseudohermaphrodism, hypergonadotropic hypogonadism, and multicystic ovaries associated with missense mutations in the gene encoding aromatase (P450arom)[J]. J Clin Endocrinol Metab, 1994, 78(6): 1287-1292. DOI:10.1210/jcem.78.6.8200927 |
| [7] |
Mullis PE, Yoshimura N, Kuhlmann B, et al. Aromatase deficiency in a female who is compound heterozygote for two new point mutations in the P450arom gene: impact of estrogens on hypergonadotropic hypogonadism, multicystic ovaries, and bone densitometry in childhood[J]. J Clin Endocrinol Metab, 1997, 82(6): 1739-1745. DOI:10.1210/jcem.82.6.3994 |
| [8] |
Morishima A, Grumbach MM, Simpson ER, et al. Aromatase deficiency in male and female siblings caused by a novel mutation and the physiological role of estrogens[J]. J Clin Endocrinol Metab, 1995, 80(12): 3689-3698. DOI:10.1210/jcem.80.12.8530621 |
| [9] |
Ludwig M, Beck A, Wickert L, et al. Female pseudohermaphroditism associated with a novel homozygous G-to-A (V370-to-M) substitution in the P-450 aromatase gene[J]. J Pediatr Endocrinol Metab, 1998, 11(5): 657-664. DOI:10.1515/jpem.1998.11.5.657 |
| [10] |
Belgorosky A, Pepe C, Marino R, et al. Hypothalamic-pituitary-ovarian axis during infancy, early and late prepuberty in an aromatase-deficient girl who is a compound heterocygote for two new point mutations of the CYP19 gene[J]. J Clin Endocrinol Metab, 2003, 88(11): 5127-5131. DOI:10.1210/jc.2003-030433 |
| [11] |
Lin L, Ercan O, Raza J, et al. Variable phenotypes associated with aromatase (CYP19) insufficiency in humans[J]. J Clin Endocrinol Metab, 2007, 92(3): 982-990. DOI:10.1210/jc.2006-1181 |
| [12] |
Pepe CM, Saraco NI, Baquedano MS, et al. The cytochrome P450 aromatase lacking exon 5 is associated with a phenotype of nonclassic aromatase deficiency and is also present in normal human steroidogenic tissues[J]. Clin Endocrinol (Oxf), 2007, 67(5): 698-705. DOI:10.1111/j.1365-2265.2007.02948.x |
| [13] |
Hauri-Hohl A, Meyer-Böni M, Lang-Muritano M, et al. Aromatase deficiency owing to a functional variant in the placenta promoter and a novel missense mutation in the CYP19A1 gene[J]. Clin Endocrinol (Oxf), 2011, 75(1): 39-43. DOI:10.1111/j.1365-2265.2011.04012.x |
| [14] |
Bouchoucha N, Samara-Boustani D, Pandey AV, et al. Characterization of a novel CYP19A1 (aromatase) R192H mutation causing virilization of a 46, XX newborn, undervirilization of the 46, XY brother, but no virilization of the mother during pregnancies[J]. Mol Cell Endocrinol, 2014, 390(1/2): 8-17. DOI:10.1016/j.mce.2014.03.008 |
| [15] |
Gagliardi L, Scott HS, Feng JH, et al. A case of Aromatase deficiency due to a novel CYP19A1 mutation[J]. BMC Endocr Disord, 2014, 14: 16. DOI:10.1186/1472-6823-14-16 |
| [16] |
Marino R, Perez Garrido N, Costanzo M, et al. Five new cases of 46, XX aromatase deficiency: clinical follow-up from birth to puberty, a novel mutation, and a founder effect[J]. J Clin Endocrinol Metab, 2015, 100(2): E301-E307. DOI:10.1210/jc.2014-2967 |
| [17] |
Ludwikowski B, Heger S, Datz N, et al. Aromatase deficiency: rare cause of virilization[J]. Eur J Pediatr Surg, 2013, 23(5): 418-422. DOI:10.1055/s-0032-1324798 |
| [18] |
Saraco N, Nesi-Franca S, Sainz R, et al. An intron 9 CYP19 gene variant (IVS9+5G>A), present in an aromatase-deficient girl, affects normal splicing and is also present in normal human steroidogenic tissues[J]. Horm Res Paediatr, 2015, 84(4): 275-282. DOI:10.1159/000437142 |
| [19] |
Akçurin S, Türkkahraman D, Kim WY, et al. A novel null mutation in P450 aromatase gene (CYP19A1) associated with development of hypoplastic ovaries in humans[J]. J Clin Res Pediatr Endocrinol, 2016, 8(2): 205-210. DOI:10.4274/jcrpe.2761 |
| [20] |
Mazen I, McElreavey K, Elaidy A, et al. Aromatase deficiency due to a homozygous CYP19A1 mutation in a 46, XX Egyptian patient with ambiguous genitalia[J]. Sex Dev, 2017, 11(5/6): 275-279. DOI:10.1159/000485278 |
| [21] |
Unal E, Yıldırım R, Taȿ FF, et al. Aromatase deficiency due to a novel mutation in CYP19A1 gene[J]. J Clin Res Pediatr Endocrinol, 2018, 10(4): 377-381. DOI:10.4274/jcrpe.0011 |
| [22] |
Dursun F, Ceylaner S. A novel homozygous CYP19A1 gene mutation: aromatase deficiency mimicking congenital adrenal hyperplasia in an infant without obvious maternal virilisation[J]. J Clin Res Pediatr Endocrinol, 2019, 11(2): 196-201. DOI:10.4274/jcrpe.galenos.2018.2018.0140 |
| [23] |
Özen S, Atik T, Korkmaz Ö, et al. Aromatase deficiency in two siblings with 46, XX karyotype raised as different genders: a novel mutation (p.R115X) in the CYP19A1 gene[J]. J Clin Res Pediatr Endocrinol, 2020, 12(1): 109-112. DOI:10.4274/jcrpe.galenos.2019.2018.0198 |
| [24] |
Verma N, Jain V, Birla S, et al. Growth and hormonal profile from birth to adolescence of a girl with aromatase deficiency[J]. J Pediatr Endocrinol Metab, 2012, 25(11/12): 1185-1190. DOI:10.1515/jpem-2012-0152 |
| [25] |
Baronio F, Ortolano R, Menabò S, et al. 46, XX DSD due to androgen excess in monogenic disorders of steroidogenesis: genetic, biochemical, and clinical features[J]. Int J Mol Sci, 2019, 20(18): 4605. DOI:10.3390/ijms20184605 |
| [26] |
Jones MEE, Boon WC, McInnes K, et al. Recognizing rare disorders: aromatase deficiency[J]. Nat Clin Pract Endocrinol Metab, 2007, 3(5): 414-421. DOI:10.1038/ncpendmet0477 |
| [27] |
Grumbach MM, Auchus RJ. Estrogen: consequences and implications of human mutations in synthesis and action[J]. J Clin Endocrinol Metab, 1999, 84(12): 4677-4694. DOI:10.1210/jcem.84.12.6290 |
| [28] |
Alsaleem M, Miller DE, Saadeh L, et al. Aromatase deficiency: a rare cause of maternal virilisation and ambiguous genitalia in neonates[J]. BMJ Case Rep, 2019, 12(6): e231267. DOI:10.1136/bcr-2019-231267 |
 2023, Vol. 22
2023, Vol. 22


