成骨不全症(osteogenesis imperfecta, OI) 是一种罕见的遗传性结缔组织疾病,患者骨脆性和骨折风险增加,全球发病率为1/20 000~1/15 000[1]。患者由于骨强度降低常出现低创伤性骨折或非典型部位骨折(如鹰嘴和椎体压缩性骨折),骨外表现包括牙齿异常、蓝灰色巩膜、听力下降或丧失、呼吸功能下降、心脏瓣膜关闭不全等[2]。大多数OI患者存在COL1A1和COL1A2常染色体显性突变,迄今在OI患者中已发现超过1 500个COL1A1和COL1A2基因的显性突变,导致Ⅰ型胶原蛋白结构改变或数量缺乏[3]。临床常采用经典Silent分型方法,通过特定表型对OI进行分类,Ⅰ型OI与结构正常胶原蛋白数量缺乏有关,是OI中症状最轻的类型,其特征表现是蓝色巩膜,但没有骨骼畸形;Ⅱ型最为严重,常表现为胎儿围产期死亡;Ⅲ型表现为非致死性和进行性骨骼病变,包括严重进行性畸形和极矮身材;Ⅳ型介于Ⅰ型和Ⅲ型之间,常导致轻度至中度骨髂畸形与身材矮小[4]。由于OI临床不常见,且疾病严重程度不一,中度和轻度OI患者常被视为普通骨折而漏诊。中南大学湘雅医院骨科近年收治1例Ⅰ型OI患儿,本文介绍此例患儿诊治经过,并就OI的分型、诊断与治疗进展进行文献复习。
患儿男,14岁,因车祸致右肘疼痛1 d,当地医院诊断为右侧肱骨骨折,予石膏固定、制动处理。后转入本院,查体:身高160 cm,体重45 kg,体型消瘦,胸廓、心肺、脊柱、关节、四肢肌力及肌张力、生理反射均正常;巩膜呈蓝色(图 1A),牙齿发育欠佳(图 1B),耳廓无畸形;右肘关节明显肿胀、畸形,后方见一长约10 cm纵行手术切口,呈正常术后改变,少许增生,无红肿渗出;右肱骨远端周围明显压痛,可扪及骨擦感,右肘关节活动受限、皮温稍高,右前臂及右手掌皮肤感觉无异常;尺神经、桡神经及正中神经检查未见明显异常。考虑成骨不全症可能,进一步询问患儿既往史,诉4年前夜间睡觉时摔下床,致右侧锁骨骨折,于当地医院行切开复位钢板内固定术,后骨折愈合取出内固定;2年前与同伴嬉闹时,左前臂被击打致左前臂骨折,至当地医院行石膏固定,2个月后拆除石膏;同年从1.5米高处跌倒致左肘部骨折,至当地医院行石膏固定,2个月后拆除石膏;1年前不慎摔倒致右尺骨鹰嘴骨折,于当地医院行切开复位张力带内固定,术后3个月复查骨折未愈合,未予特殊处理。追问家族史,其母亲巩膜呈蓝色,既往有两次骨折史。追查患儿骨密度,腰椎T值-3.7、Z值-1.6,根据世界卫生组织标准分类为骨质疏松,骨折危险度高。X线诊断为右侧肱骨骨折、右尺骨鹰嘴骨折张力带内固定术后骨折不愈合,见图 1C、图 1D。
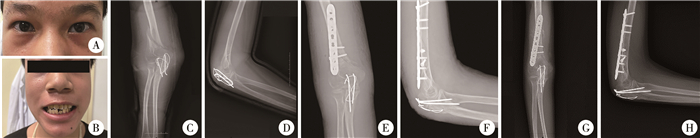
|
图 1 成骨不全症患儿典型照片及X线片 Fig.1 Representative photographs and radiographs of this case. 注 A:巩膜呈淡蓝色;B:牙齿发育不良;C:入院时右肘关节正位X线片;D:入院时右肘关节侧位X线片;E:术后即刻右肘关节正位X线片;F:术后即刻右肘关节侧位X线片;G:术后2个月右肘关节正位X线片;H:术后2个月右肘关节侧位X线片 |
患儿经完善术前准备后,于全身麻醉下行尺骨内固定取出术+尺骨植骨术+尺骨钢针内固定术+肱骨骨折闭合复位钢板内固定术,术后即刻及术后2个月复查X线片,均显示骨折对位良好(图 1E至图 1H)。出院诊断为Ⅰ型成骨不全症,右侧肱骨骨折、右侧尺骨鹰嘴骨折术后。建议后续予双膦酸盐+钙剂治疗,预防摔倒和承重,定期复查骨密度。
讨论 OI被收录在我国2018年公布的第一批罕见病目录中,临床少见,诊断主要依赖典型的疾病特征,即骨脆性增加和骨量减少导致的复发性骨折、非典型部位骨折及低创伤性骨折。骨折多发生在儿童时期,发生率随年龄增长而降低。此外,脊柱、长骨和胸腔的畸形会降低患儿活动能力,并导致呼吸系统并发症;由于骨骼结构和功能的异常,患儿常诉骨痛。身材矮小是本病又一特征,特别是在严重OI中,而病情较轻的Ⅰ型OI矮小程度常较轻。约37%的患者出现颅颈交界异常,并可能导致严重并发症[5]。由于OI发病率低,非典型和轻型OI常被漏诊。本例Ⅰ型OI无明显身材矮小和身体畸形,且骨折均伴明确外伤史,因此患儿自10岁第1次发生骨折起至入住本院前的4次骨折均被外院诊断为普通骨折。
OI是一种全身性结缔组织疾病,其骨骼外表现可发生在表达I型胶原的组织中,或继发于骨骼病变,包括蓝灰色巩膜、牙齿异常、关节过度活动、听力丧失、肌肉无力、心血管并发症及肺部发育不全等[6]。颅面结构的异常发育在所有类型OI中均可发生,最近一项基于锥形束CT扫描结果分析的研究发现,中度至重度OI患者面部发育不全,上颌后缩和下颌前突,少数病例出现鼻中隔偏移和颅底角改变;这些特征可能会影响气道,导致睡眠呼吸暂停等[7]。牙齿异常如牙本质发育不全(牙齿变脆或变色)、缺牙、异位牙和牙齿咬合不正在OI患者中十分常见,在严重OI中更为普遍[8]。本例患儿身高正常,无明显骨骼畸形,门诊以普通四肢骨折收入院,后经详细体格检查发现患儿巩膜呈淡蓝色,追问病史发现患儿在10~14岁共发生5次骨折,考虑为迟发性Ⅰ型OI,最终获确诊。
近年来,随着基因诊断技术的提高,对OI的分子机制的认知也在不断加深。自2006年Morello等[9]发现第一个OI的致病基因(CRTAP)以来,在过去数十年间,至少有17个基因缺陷被确定与成骨不全表型相关。OI的分型随着新基因的发现而发展,遗传分类为每个缺陷基因纳入了一种新的类型。为了使这些信息对临床医生和患者有益,Forlino等[4]建议根据OI患者细胞内或细胞外代谢途径的改变将遗传类型分为五个功能组:A组为胶原蛋白结构或加工中的原发性缺陷;B组为胶原蛋白修饰缺陷;C组为胶原折叠和交联缺陷;D组为骨化或矿化缺陷;E组为成骨细胞发育缺陷伴胶原不足,详见表 1。虽然目前OI的治疗以对症治疗为主,但随着基因诊断和治疗研究的不断拓新,基于患者年龄、基因分型及严重程度的个性化治疗将成为现实。轻型Ⅰ型OI通常只需监测并发症,而严重的Ⅰ型和Ⅲ/Ⅳ型OI需要多学科干预,包括药物治疗、物理治疗、职业治疗、骨科干预及其他亚专科随访[10]。
| 表 1 成骨不全症的最新基因分型 Table 1 The latest genotyping of osteogenesis imperfecta |
|
|
OI的治疗目标是提高骨强度、降低骨折风险、减轻疼痛、增强运动能力和功能独立性以及预防远期并发症。骨折是OI患者最常见的骨科干预指征,患者通常比一般人群更容易发生骨折,且骨折愈合受固有骨质量差的影响,可能因骨不连和反复骨折而使得治疗的复杂程度和难度增加。对于幼儿骨折,可考虑采取闭合复位治疗,但这可能导致肌肉无力、关节僵硬和废用性骨质减少。当不适合采取闭合复位时,需要对骨折进行手术治疗,一般手术原则是坚强固定,通常选用髓内植入物(髓内钉)而非钢板和螺钉进行固定,以避免在植入物上方或下方发生骨折。中度至重度OI患者在选择干预策略时还应慎重考虑麻醉风险。
除对于骨折本身的治疗外,为了改善OI患者的骨量和骨脆性,可以选择相应药物进行干预。在目前的临床工作中,双膦酸盐是儿科针对OI患者的首选药物,可通过抑制破骨细胞活性而减少骨吸收[11]。双膦酸盐可持续改善OI患者的骨密度,并降低骨折发生率。最近一项研究表明,双膦酸盐干预可以降低Ⅰ型OI青春期前患者的骨折发生率和脊柱侧凸发生风险,对增强运动能力有积极作用[12]。但与治疗骨质疏松症相比,双膦酸盐对OI的治疗作用较弱,特别是对于严重OI患者[13]。随着新一代骨代谢相关药物的开发和研究,新的OI治疗方案也在不断探索。地诺单抗是一种抑制破骨细胞分化及其功能的抗核因子kappa-B配体的受体激活剂抗体,已被批准用于治疗成人骨质疏松症;其在OI中的应用尚在进展中,与双膦酸盐相似,它主要作用于破骨细胞以抑制骨吸收[14]。在一些小规模研究中,地诺单抗已被证明可以改善OI患者的骨密度,但其使用与高血钙症和高尿钙症的发生相关,目前已开展相关临床试验以评估其治疗OI的安全性和有效性[15];特立帕肽是一种诱导骨合成代谢的甲状旁腺激素(parathyroid hormone, PTH)类似物(重组人甲状旁腺激素1-34),可显著增加Ⅰ型OI的骨矿物质密度,但对中度和重度OI效果不佳。由于小儿长期使用PTH有发生骨肉瘤的潜在风险,目前仅限于成人使用,且用药时间不得超过24个月;在停止治疗前,应考虑使用抗骨吸收剂,以降低加速骨丢失的风险(表 2)[16]。随着近年来对OI分子遗传学研究的不断深入,相信未来会发现更多新的治疗靶点。
| 表 2 成骨不全症的药物治疗 Table 2 Medication management of osteogenesis imperfecta |
|
|
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为王广、祝晟、李洪明,病例收集为王广、宋涯,论文讨论分析为祝晟、卢邦宝、林涨源
| [1] |
Botor M, Fus-Kujawa A, Uroczynska M, et al. Osteogenesis imperfecta: current and prospective therapies[J]. Biomolecules, 2021, 11(10): 1493. DOI:10.3390/biom11101493 |
| [2] |
Rossi V, Lee B, Marom R. Osteogenesis imperfecta: advancements in genetics and treatment[J]. Curr Opin Pediatr, 2019, 31(6): 708-715. DOI:10.1097/MOP.0000000000000813 |
| [3] |
Palomo T, Vilaça T, Lazaretti-Castro M. Osteogenesis imperfecta: diagnosis and treatment[J]. Curr Opin Endocrinol Diabetes Obes, 2017, 24(6): 381-388. DOI:10.1097/MED.0000000000000367 |
| [4] |
Forlino A, Marini JC. Osteogenesis imperfecta[J]. Lancet, 2016, 387(10028): 1657-1671. DOI:10.1016/S0140-6736(15)00728-X |
| [5] |
Ludwig K, Seiltgens C, Ibba A, et al. Craniocervical abnormalities in osteogenesis imperfecta type Ⅴ[J]. Osteoporos Int, 2022, 33(1): 177-183. DOI:10.1007/s00198-021-06088-x |
| [6] |
Tournis S, Dede AD. Osteogenesis imperfecta-a clinical update[J]. Metabolism, 2018, 80: 27-37. DOI:10.1016/j.metabol.2017.06.001 |
| [7] |
Reznikov N, Dagdeviren D, Tamimi F, et al. Cone-beam computed tomography of osteogenesis imperfecta types Ⅲ and Ⅳ: three-dimensional evaluation of craniofacial features and upper airways[J]. JBMR Plus, 2019, 3(6): e10124. DOI:10.1002/jbm4.10124 |
| [8] |
Messineo D, Luzzi V, Pepe F, et al. New 3D cone beam CT imaging parameters to assist the dentist in treating patients with osteogenesis imperfecta[J]. Healthcare (Basel), 2020, 8(4): 546. DOI:10.3390/healthcare8040546 |
| [9] |
Morello R, Bertin TK, Chen YQ, et al. CRTAP is required for prolyl 3-hydroxylation and mutations cause recessive osteogenesis imperfecta[J]. Cell, 2006, 127(2): 291-304. DOI:10.1016/j.cell.2006.08.039 |
| [10] |
Hidalgo Perea S, Green DW. Osteogenesis imperfecta: treatment and surgical management[J]. Curr Opin Pediatr, 2021, 33(1): 74-78. DOI:10.1097/MOP.0000000000000968 |
| [11] |
Dwan K, Phillipi CA, Steiner RD, et al. Bisphosphonate therapy for osteogenesis imperfecta[J]. Cochrane Database Syst Rev, 2016, 10(10): CD005088. DOI:10.1002/14651858.CD005088.pub4 |
| [12] |
Sithambaran S, Harrison R, Gopal-Kothandapandi S, et al. Bispho-sphonate treatment alters the skeletal response to mechanical stimulation in children with osteogenesis imperfecta: a pilot study[J]. JBMR Plus, 2022, 6(3): e10592. DOI:10.1002/jbm4.10592 |
| [13] |
Forlino A, Cabral WA, Barnes AM, et al. New perspectives on osteogenesis imperfecta[J]. Nat Rev Endocrinol, 2011, 7(9): 540-557. DOI:10.1038/nrendo.2011.81 |
| [14] |
Ralston SH, Gaston MS. Management of osteogenesis imperfecta[J]. Front Endocrinol (Lausanne), 2019, 10: 924. DOI:10.3389/fendo.2019.00924 |
| [15] |
Hoyer-Kuhn H, Rehberg M, Netzer C, et al. Individualized treatment with denosumab in children with osteogenesis imperfecta-follow up of a trial cohort[J]. Orphanet J Rare Dis, 2019, 14(1): 219. DOI:10.1186/s13023-019-1197-z |
| [16] |
Nicol L, Srikanth P, Henriksen K, et al. Widespread disturbance in extracellular matrix collagen biomarker responses to teriparatide therapy in osteogenesis imperfecta[J]. Bone, 2021, 142: 115703. DOI:10.1016/j.bone.2020.115703 |
| [17] |
Marom R, Rabenhorst BM, Morello R. Osteogenesis imperfecta: an update on clinical features and therapies[J]. Eur J Endocrinol, 2020, 183(4): R95-R106. DOI:10.1530/EJE-20-0299 |
| [18] |
Sinder BP, Eddy MM, Ominsky MS, et al. Sclerostin antibody improves skeletal parameters in a Brtl/+mouse model of osteogenesis imperfecta[J]. J Bone Miner Res, 2013, 28(1): 73-80. DOI:10.1002/jbmr.1717 |
| [19] |
Popovic D, Vucic D, Dikic I. Ubiquitination in disease pathogenesis and treatment[J]. Nat Med, 2014, 20(11): 1242-1253. DOI:10.1038/nm.3739 |
| [20] |
Marini JC, Hopkins E, Glorieux FH, et al. Positive linear growth and bone responses to growth hormone treatment in children with types Ⅲ and IV osteogenesis imperfecta: high predictive value of the carboxyterminal propeptide of type I procollagen[J]. J Bone Miner Res, 2003, 18(2): 237-243. DOI:10.1359/jbmr.2003.18.2.237 |
 2023, Vol. 22
2023, Vol. 22


