神经母细胞瘤(neuroblastoma,NB)是婴幼儿最常见颅外恶性实体肿瘤,发病率为0.3/100 000~1/100 000,占儿童恶性肿瘤的6% ~10%。NB原发肿瘤可发生于交感神经系统任何位置或肾上腺髓质。NB首次明确诊断困难,易误诊、漏诊,且恶性程度高,进展快,易早期发生远处转移。囊性神经母细胞瘤(cystic neuroblastoma,CNB)是NB的一种罕见变异,容易误诊[1]。本文对华中科技大学同济医学院附属湖北省妇幼保健院收治的6例囊性神经母细胞瘤患儿临床资料进行总结分析,以提高临床医生对CNB的认识。
资料与方法 一、临床资料回顾性分析2016年6月至2021年12月在华中科技大学同济医学院附属湖北省妇幼保健院外科就诊的6例CNB患儿临床资料。男4例,女2例;均于常规产前超声检查中发现腹腔囊性、囊实性低回声团块,其中囊性包块5例,囊实性包块1例(囊性为主)。出生后均无特殊临床表现,无腹胀、发热、高血压、贫血等,腹部CT和超声检查诊断为腹膜后包块。病变位于左侧肾上腺4例,右侧肾上腺2例。2例于生后超声随访1个月囊肿无明显变化收入院,4例出生后直接收入院。本研究通过湖北省妇幼保健院伦理委员会批准(2022年伦理审查078号),患儿监护人知情并签署知情同意书。
5例于新生儿期行切除手术,1例于出生1个月后行切除手术。术后均经病理学检查确诊为CNB,核分裂/核碎裂指数(mitotic karyorrhexis index,MKI)均为低度。术后随访6~71个月,6例患儿临床资料见表 1。
| 表 1 6例囊性神经母细胞瘤患儿临床及病理资料 Table 1 Clinicopathological data of 6 CNB children |
|
|
6例患儿中,3例完善24 h尿儿茶酚胺代谢物尿香草扁桃酸(vanillymandelic acid,VMA)及神经元特异性烯醇化酶(neuron-specific enolase,NSE)检查,结果均为正常。腹部超声均提示类圆形囊性或囊实性无回声、混合回声团块,囊性为主,实性较少,与肾上腺关系密切,边界尚清,2例可见光带分隔及絮状回声光团,肿块内及周边探及血流信号(图 1A)。CT成像显示肿物囊状低密度影或囊实性包块影,囊性成分为主,实性较少,边界清,增强后可见囊壁、内条索影及斑片实性部分轻度强化(图 1B)。MRI提示:囊状稍长T1长T2信号影,弥散加权像(diffusion weighted image,DWI)扫描无明显扩散受限,其内部分可见线样分隔影,增强扫描病灶内未见明显强化,分隔可见强化。6例病理学检查均确诊为CNB(图 1C、图 1D),Shimada病理分型均为预后良好型。
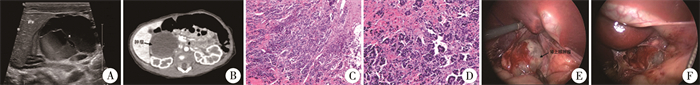
|
图 1 1例囊性神经母细胞瘤患儿影像学、病理学及腹腔镜下腹膜后囊性包块切除术图片 Fig.1 Imaging, surgical and postoperative pathological images of CNB children 注 A:超声显示右肾上腺囊实性混合回声,囊性为主,其内可见光带分隔及絮状回声团块;B:CT提示右肾上腺囊性包块;C:肿瘤细胞由纤细纤维分隔呈巢状(HE染色,×100);D:肿瘤细胞为大小不一、小圆形未分化细胞(HE染色,×200);E:离断结肠旁沟侧腹膜及肝结肠韧带,悬吊周边组织,显露包块;F:完整剥离包块,保留部分肾上腺组织 |
对于包块性质待定、产前超声或生后随访包块未见明显变化、高度怀疑CNB而无影像学定义危险因素(image defined risk factors,IDRFs)的患儿,予以积极手术切除。术前常规禁食,置胃管,仰卧位,气管插管下全身麻醉,脐部置入5 mm腹腔镜穿刺器Trocar,依据肿物位置分别于左、右中下腹置入1~2枚3 mm Trocar、1枚5 mm Trocar。建立CO2气腹,压力设为7 mmHg(1 mmHg=0.133 kPa),于无血管区打开结肠旁沟侧腹膜和肝结肠韧带,悬吊牵引肿物周边组织,充分暴露肿瘤(图 1E)。对部分囊肿于手术中穿刺抽吸囊液,减轻包块张力,抓钳夹闭穿刺孔电凝封闭,包块与周边组织界限清楚,沿包块包膜表面游离周边组织,超声刀离断滋养血管,较粗血管可予5 - 0可吸收线缝扎加固,完整剥离包块,切除部分包块相连淋巴结,保留部分正常肾上腺组织(图 1F)。检查创面无活动性出血,扩大脐部切口,取出包块。1例因术中不耐受,包块过大,腹腔镜操作空间有限,转开腹手术,取左侧腰部切口,完整切除包块。患儿均手术顺利,术中血压平稳。术后均未予化疗。随访监测患儿血NSE、尿VMA及影像学检查。
结果6例均成功切除肾上腺肿物,手术时间60~120 min,平均87 min;术中出血量1~10 mL,平均5.6 mL,无一例术中输血病例;术后住院时间7~11 d,平均9.5 d。术后病理检查均提示囊性神经母细胞瘤未分化型,依据国际神经母细胞瘤分期系统(International Neuroblastoma Staging System,INSS)分期均为Ⅰ期。3例行MYCN基因扩增阴性,危险度分组为极低危。随访6~71个月,患儿生长发育正常,NSE、VMA、B超、CT检查均未见复发或转移。
讨论NB是儿童最常见的外周神经系统恶性肿瘤,起源于神经外胚层原始神经嵴细胞,好发于交感神经节或肾上腺髓质,异质性强,预后个体差异大,发病隐匿,多数患儿就诊前已发生局部浸润,甚至发生肝脏、骨髓、皮肤、淋巴结、硬脑膜、眼眶等远处转移,多为散发病例,偶见家族性发病,多见于1~5岁儿童,男童较女童多见[2]。本组6例中4例男性,2例女性,发病位置均在肾上腺。文献报道显示,伴远处转移的NB患儿5年无事件生存率(event-free survival,EFS)<30%[3]。NB通常以实性为主,少见囊性。CNB是一种罕见变异类型,通常出现在较低年龄儿童中,且较少出现早期转移,远期预后通常较好[1]。
CNB多无特异性临床表现,常与肿瘤原发部位、转移情况及瘤体大小有关,多表现为腹部肿块、腹胀等,骶前CNB可表现为排尿、排便困难,纵隔CNB压迫可引起呼吸窘迫、上腔静脉综合征,部分患儿可出现发热、贫血、高血压等全身症状[4-6]。当肿瘤出现远处转移时,可表现为肝肿大、腹膜后淋巴结肿大,骨转移可表现为肢体疼痛、跛行或病理性骨折等[7]。
CNB通常含实性成分较少,影像学诊断困难,需与肾上腺出血、肾上腺囊肿、肾积水、肾上腺脓肿、肠源性囊肿、膈下型隔离肺、畸胎瘤等鉴别。CNB患儿尿液或血清中VMA和NSE大多正常,可能与尿液或血清中缺乏瘤体实性成分相关[1]。既往文献报道,大多数胎儿CNB于孕晚期被发现[8]。本研究中,CNB中位产前诊断胎龄为35周,但最早产前诊断胎龄为8周。胎儿晚期及新生儿期肾上腺髓质细胞分化成熟为嗜铬细胞及神经节细胞。CNB大多发现于胎儿晚期这一现象是否与肾上腺髓质及交感神经节细胞胎儿晚期异常生长、分化有关,尚需进一步研究。本研究中,CNB产前超声多表现为实质性中等回声、囊性或囊实性低回声团块,与同侧肾上腺分界不清,囊壁及内部可见血流信号。Eo等[9]报道超声检测可见CNB微小钙化。肾上腺血肿内部及周边无明显血流信号[10]。对CNB,CT成像显示不规则肿块边缘无明显强化,内含较多囊性成分,偶有肿块壁增厚或内部少量强化[11]。CNB术前诊断往往很困难,确诊通常需病理学检查,骨髓穿刺液或血清、尿液中VMA升高[5]。血肿常于6个月内逐渐吸收、消退,偶有部分残留钙化,如B超、CT动态随访2周至1个月,肿块无明显变化则应考虑CNB[11]。
CNB是一种较罕见的NB,可根据INSS分为1、2、3、4及4s期。手术切除是其主要治疗手段,1期、2期CNB术后可不化疗,3期、4期及4s期进展期CNB术后需予以辅助化疗[11]。本组6例均为INSS 1期,5例通过腹腔镜完整切除,1例因肿瘤较大而中转开腹手术完整切除,术后均未予化疗。Winters等[12]报道1例4s期双侧肾上腺CNB,行双侧肾上腺次全切除术,术后予以化疗,随访过程亦未发现复发。Kasaee等[1]报道1例眼眶CNB,未发现转移,仅行手术切除,术后未予化疗,随访未发现复发及转移证据。但也有报道一些双侧CNB伴转移者预后相对较差[5]。目前,CNB被认为是NB的一种特殊形式,是发育过程中肿瘤坏死或出血引起的原位母细胞瘤,通常具有良好的生物学特征及预后,且大多数囊性神经母细胞瘤多为1期或4s期[9, 13]。
CNB治疗方案及手术时机选择并不统一,大部分学者认为对围生期发现的肾上腺肿块(无IDRFs,INRG分期L1和部分M期)、长径<5.0 cm的囊性肿块可密切观察6个月,无需治疗,观察期间如出现肿瘤增大或肿瘤稳定4~6周甚至数月不变,应采取手术治疗[11, 13-14]。但刘俊娇等[15]报道1例新生儿CNB患者MYCN基因扩增阳性,提示预后不佳,新生儿期即予手术切除。Avanzini等[6]报道1例新生儿双侧肾上腺CNB伴远处肝转移4s期,生后行紧急减容手术后未予进一步治疗,后期随访肾上腺肿块及肝转移结节完全消失。Tanaka等[16]报道46例产前诊断CNB患儿,依据INSS分期,1期、2期共40例,4期1例,4s期5例;1例4期患儿生后即死亡,余45例予肿瘤原位切除,手术时中位年龄为20.6 d,术后均未行辅助治疗。Menon等[7]认为CNB虽然预后良好,但为防止恶化、转移风险,仍建议早期手术切除。对于CNB术前诊断困难、无法评估肿物良恶性、无IDRFs的患儿,早期手术不仅有利于完整、安全切除肿物,明确肿物性质,更有利于明确其分期、危险度分组及术后进一步治疗。本组6例均通过产前超声发现腹腔囊性包块,产前随访包块未见明显变化,生后进一步检查提示肾上腺囊性包块可能,无法评估肿物良恶性,无IDRFs;征得家属同意后,均予手术完整切除,术后恢复顺利;随访6~71个月,均未见复发或转移证据。
腹腔镜手术在NB中的应用仍存在争议,以往认为肿瘤长径大于6 cm,其潜在恶性程度高,瘤体组织血供丰富,与周边组织粘连紧密,腹腔镜操作空间有限,暴露困难,难以保证肿瘤完整切除及淋巴结清扫完全,但近年已有不少腹腔镜下成功切除巨大腹膜后肿物的报道[17-18]。腹腔镜下治疗各种肾上腺肿瘤均具有较高的安全性及有效性,大多数情况下可保留部分正常腺体组织[19]。CNB大多包膜完整,与周边组织边界尚清,无重要血管包裹,无IDRFs,可行腹腔镜手术。本组5例于腹腔镜下完整切除,术中发现其包膜完整,与周边组织分界清楚,出血较少;1例患儿因囊肿过大,腹腔镜下操作空间有限,且囊肿与周边重要血管关系密切,予中转开腹切除;6例术中均未见明显肿大的淋巴结,仅切除部分与包块粘连淋巴结,切除淋巴结均呈阴性,不足处未常规行区域淋巴结清扫,不利于CNB患儿INSS的精准分期。腹腔镜下CNB切除应注意以下几点:①术前明确肿瘤位置、大小、周边血管关系及IDRFs评估风险;②Trocar位置合适,必要时可增加Trocar数量,确保能充分暴露肿瘤;③对于较大的肿瘤,张力较高,可选择穿刺抽液的方式进行减瘤,为避免肿瘤细胞外溢,可使用腹腔镜抓钳夹闭穿刺孔电凝封闭或可吸收线缝合囊肿穿刺孔,瘤体周边合理悬吊,增加手术空间,利于肿瘤的游离和暴露;④可选用超声刀游离肿瘤与周边组织,血管结扎确切。
综上所述,CNB是一种少见的NB类型,生物学特性上有其自身特点,预后良好。目前我国CNB病例报道较少,临床上对于CNB的治疗方案和手术时机选择仍无统一意见。腹腔镜手术切除CNB安全、可靠、有效,而对于高度怀疑CNB,无法评估肿物良恶性者,为尽早进行分期及危险度分组,完整切除囊肿,避免其早期恶化转移等,倾向积极主动手术切除,至于术后是否需进一步化疗仍需进一步研究。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 梁星池负责研究的设计、实施和起草文章;毛晓雯、罗艳梅进行病例收集及分析;杨星海、程时刚负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Kasaee A, Rafizadeh SM, Ghadimi H, et al. A rare case of congenital orbital cystic neuroblastoma in an infant[J]. Ocul Oncol Pathol, 2019, 5(3): 167-170. DOI:10.1159/000490476 |
| [2] |
Shohet J, Foster J. Neuroblastoma[J]. BMJ, 2017, 357: j1863. DOI:10.1136/bmj.j1863 |
| [3] |
Park JR, Bagatell R, London WB, et al. Children's oncology group's 2013 blueprint for research: neuroblastoma[J]. Pediatr Blood Cancer, 2013, 60(6): 985-993. DOI:10.1002/pbc.24433 |
| [4] |
Carrillo VD, Ibarra GX, Cuevas PM, et al. Causa infrecuente de hipertensión arterial en lactantes: neuroblastoma congénito quístico suprarrenal.Caso clínico[J]. Rev Chil Pediatr, 2012, 83(3): 262-268. DOI:10.4067/S0370-41062012000300008 |
| [5] |
Pinarli FG, Danaci M, Tander B, et al. Bilateral adrenal cystic neuroblastoma with superior vena cava syndrome and massive intracystic haemorrhage[J]. Pediatr Radiol, 2004, 34(9): 746-749. DOI:10.1007/s00247-004-1209-5 |
| [6] |
Avanzini S, Conte M, Granata C, et al. Life-threatening bilateral adrenal cystic neuroblastoma in an infant[J]. J Pediatr Hematol Oncol, 2009, 31(12): 963-964. DOI:10.1097/MPH.0b013e3181b79641 |
| [7] |
Menon P, Bansal D, Lyngdoh S, et al. Bilateral hemorrhagic cystic adrenal neuroblastoma with liver and lymph nodal metastases in an infant[J]. J Indian Assoc Pediatr Surg, 2012, 17(4): 171-173. DOI:10.4103/0971-9261.102340 |
| [8] |
McPherson E, Cold C, Johnson P, et al. Neuroblastoma in a 17-week fetus: a stimulus for investigation of tumors in a series of 2786 stillbirth and late miscarriages[J]. Am J Med Genet A, 2015, 167(1): 246-249. DOI:10.1002/ajmg.a.36829 |
| [9] |
Eo H, Kim JH, Jang KM, et al. Comparison of clinico-radiological features between congenital cystic neuroblastoma and neonatal adrenal hemorrhagic pseudocyst[J]. Korean J Radiol, 2011, 12(1): 52-58. DOI:10.3348/kjr.2011.12.1.52 |
| [10] |
田蓉, 袁红霞, 夏仁鹏. 胎儿肾上腺区占位病变的产前超声诊断及转归[J]. 中国医师杂志, 2020, 22(9): 1360-1364. Tian R, Yuan HX, Xia RP. Prenatal ultrasound diagnosis and prognosis of fetal adrenal space occupying lesions[J]. J Chin Physician, 2020, 22(9): 1360-1364. DOI:10.3760/cma.j.cn431274-20190529-00635 |
| [11] |
姚伟, 李凯, 肖现民, 等. 新生儿肾上腺肿块的鉴别诊断及治疗[J]. 中华小儿外科杂志, 2012, 33(2): 100-104. Yao W, Li K, Xiao XM, et al. Differential diagnosis and treatment of neonatal suprarenal mass[J]. Chin J Pediatr Surg, 2012, 33(2): 100-104. DOI:10.3760/cma.j.issn.0253-3006.2012.02.006 |
| [12] |
Cassady C, Winters WD. Bilateral cystic neuroblastoma: imaging features and differential diagnoses[J]. Pediatr Radiol, 1997, 27(9): 758-759. DOI:10.1007/s002470050220 |
| [13] |
张梅慧, 姜大朋. 先天性神经母细胞瘤发病机制与临床特点的研究进展[J]. 临床小儿外科杂志, 2022, 21(2): 141-145. Zhang MH, Jiang DP. Pathogenesis and clinical characteristics of congenital neuroblastoma[J]. J Clin Ped Sur, 2022, 21(2): 141-145. DOI:10.3760/cma.j.cn.101785-202105045-008 |
| [14] |
Bansal D, Totadri S, Chinnaswamy G, et al. Management of neuroblastoma: ICMR consensus document[J]. Indian J Pediatr, 2017, 84(6): 446-455. DOI:10.1007/s12098-017-2298-0 |
| [15] |
刘俊娇, 张津浦, 高文慧, 等. 先天性腹膜后囊性神经母细胞瘤一例[J]. 新医学杂志, 2020, 51(3): 242-244. Liu JJ, Zhang JP, Gao WH, et al. Congenital retroperitoneal cystic neuroblastoma: a case report[J]. J New Med, 2020, 51(3): 242-244. DOI:10.3969/j.issn.0253-9802.2020.03.018 |
| [16] |
Tanaka S, Tajiri T, Noguchi SI, et al. Prenatally diagnosed cystic neuroblastoma: a report of two cases[J]. Asian J Surg, 2003, 26(4): 225-227. DOI:10.1016/s1015-9584(09)60309-2 |
| [17] |
李勇, 刘登辉, 黎明, 等. 儿童腹部神经母细胞瘤手术技术探讨[J]. 临床小儿外科杂志, 2022, 21(2): 104-107. Li Y, Liu DH, Li M, et al. Surgical treatment of neuroblastoma-problems and challenges[J]. J Clin Ped Sur, 2022, 21(2): 104-107. DOI:10.3760/cma.j.cn.101785-202201025-002 |
| [18] |
Ishibashi Y, Tsujimoto H, Kouzu K, et al. Laparoscopic resection of a huge retroperitoneal cystic lymphangioma after successful reduction of tumor size with a double balloon catheter[J]. Int J Surg Case Rep, 2015, 11: 8-10. DOI:10.1016/j.ijscr.2015.04.016 |
| [19] |
Carsote M, Ghemigian A, Terzea D, et al. Cystic adrenal lesions: focus on pediatric population (a review)[J]. Clujul Med, 2017, 90(1): 5-12. DOI:10.15386/cjmed-677 |
 2023, Vol. 22
2023, Vol. 22


