2. 上海交通大学医学院附属新华医院小儿外科, 上海 200092
2. Department of Pediatric Surgery, Affiliated Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China
生理条件下,结肠运动受中枢神经系统、肠神经系统的共同调控。在肠神经系统(enteric nervous system, ENS)调控消化道运动中,肠道间质细胞的功能成为近年来国内外研究的热点。在消化道壁存在两种间质细胞,包括Cajal间质细胞(interstitial cell of Cajal, ICC)、PDGFRα+细胞(platelet growth factor receptor positive cells, PDGFRα+cells),目前ICC的研究相对成熟,随着研究深入,PDGFRα+细胞成为结肠动力机制研究中人们关注的焦点之一,为结肠传输功能障碍性疾病的机制研究提供了新的思路。
一、肠神经系统胃肠道是一个复杂的器官系统,执行一系列重要功能,其众多功能受ENS肠内神经元支配,并受肠外交感神经、副交感神经(通过迷走神经和盆神经)及感觉神经元(在迷走神经和脊髓通路中)的调节[1]。
肠神经系统属于全身最大的自主神经系统,具有完全的自主功能,可独立于中枢神经系统(central nervous system, CNS)单独调控复杂的肠道活动。肠神经系统对于胃肠道节律性运动的调控比中枢神经系统更为重要,肠道神经元的调节范围更加广泛和精细[1-2]。研究表明,在离体情况下,完整的小鼠结肠节律性收缩运动仍然可以产生,结肠平滑肌的运动可在脱离中枢神经系统的调控下产生[3]。ENS由神经元、胶质细胞及无数神经纤维组成的神经丛构成。肠神经丛可分为两种,一种为位于环肌和纵肌之间的肌间神经丛,又称Auerbach神经丛,由肠神经嵴干细胞(enteric neural crest stem cells, ENCCs)从外向内进入肠肌丛发育而成;另一种为黏膜下神经丛,由肌间移行的神经母细胞发育,在环肌内缘的黏膜下层形成深神经丛,又称Henley神经丛;神经母细胞再向浅表黏膜下层移行,在黏膜肌层下方又形成一个浅神经丛,又称Meissner神经丛[4]。肠神经元需与肠道所有细胞包括肠间质细胞相互作用,并通过后者调节肠运动神经元与平滑肌细胞之间的信号传递,调节肠道平滑肌的运动。肠神经系统主要通过释放一系列神经递质,通过中间神经元作用于结肠平滑肌细胞和肠间质细胞,调节平滑肌的节律性收缩,进而调控结肠动力。根据肠神经所释放神经递质的功能差异,主要分为兴奋性胆碱能神经、抑制性嘌呤能神经和氮能神经[5]。
关于肠神经系统的起源,1954年有研究者证实肠神经起源于肠神经嵴干细胞[6]。随着对肠神经嵴干细胞研究的逐步深入,发现大多数ENS起源于迷走神经鞘[7]。关于肠神经嵴干细胞向结肠的迁徙过程已有大量报道,ENCCs沿着从头部到尾部的方向移行,并依次进入前肠(食管、胃和十二指肠)、中肠(小肠、盲肠、升结肠、横结肠和阑尾)以及后肠(横结肠、降结肠、乙状结肠和直肠)。其中斑马鱼在受精后32 h肠神经嵴干细胞开始迁徙到结肠,禽类的鸡和鹌鹑为胚胎期2.5 d迁徙,小鼠约在胚胎期9.5 d迁徙[8-10]。人类迷走神经嵴干细胞从神经管向前肠迁徙这一过程约出现在胚胎发育第4周左右[11]。在正常胚胎发育6周左右,迷走神经节细胞迁徙到盲肠位置;在胚胎发育7周左右,肠神经嵴细胞迁徙到远端结肠。如果由于某些因素导致胚胎发育过程中,神经嵴迁徙过程受阻,神经嵴细胞无法定植在全部肠道,可能导致无神经节细胞症。
2019年国际知名胃肠病学杂志Gastroenterology发表文章探讨了肠神经系统在人类胚胎期的发育过程。胚胎发育到12周时,在肌间神经丛/肠肌丛出现了大量密集的肠神经网络,其中有兴奋性神经递质和突触的表达;然而,直到胚胎发育14周时才出现抑制性神经递质表达。在胎龄12、14周时,肠神经系统均不能诱发电刺激活动。胎龄16周时,电刺激可以激活钙电流活动,该神经电活动可被河豚毒素(Tetrodotoxin, TTX)阻断[10]。关于肠神经发育的动物学实验研究表明,小鼠在胚胎发育第12天可出现表达一氧化氮合酶(nitric oxide synthase, NOS)的一氧化氮阳性神经元(neuronal nitric oxide synthase, nNOS),随后在胚胎发育第14天出现表达乙酰胆碱转移酶(choline acetyltransferase, ChAT)的胆碱能神经元。小鼠结肠的生理学研究发现,在胚胎发育到大约第12天时,ENCCs出现自发性钙瞬变的电流活动;在胚胎发育到第15天时,结肠神经网络出现诱发性电流活动[12-13]。以上研究结果说明在胚胎发育早期(4周左右)肠道组织出现神经嵴细胞迁徙,胚胎16周时肠神经网络形成,并出现电活性发育不成熟的神经元。文献指出只有在出生后排便刺激下,肠道的完整运动模式才能逐渐建立。然而,具体幼龄期肠道动力的完整发育过程鲜有研究。研究小鼠幼龄期肠道动力以及肠神经系统的发育过程,对了解肠道运动功能障碍性疾病的内在机制具有重要意义。
二、肠神经- 间质细胞网络系统对结肠动力调控的机制生理条件下,结肠运动受中枢神经系统、肠神经系统的共同调控。肠神经系统对消化道的节律性收缩有着重要的调控作用,而ENS是调节胃肠道运动的重要中枢[14]。在ENS调控消化道运动中,肠道间质细胞的功能成为近年来国内外研究的热点。肠道间质细胞是起源于间胚层、非神经非胶质细胞的一类特殊细胞,分布于消化道管壁的各层。其类似于心肌细胞,是一种非神经起搏器细胞,可以在平滑肌细胞中产生电节律。在消化道壁存在两种间质细胞,包括Cajal间质细胞和PDGFRα+细胞。ICC是一类具有独立功能的起搏细胞,即使没有发育出ENS的小鼠,神经节平滑肌区仍可发育ICC,但是因为无神经调控,小鼠肠道SMCs无法产生足够的脉冲或极化收缩,因而出生后很快死亡,目前暂时无研究证明ICC的发育与ENS存在必然关系[13]。根据目前的形态功能学资料,ICC主要有四个亚群:肌间ICC (myenteric ICC, ICC-MY),位于胃肠道的圆形和纵向层之间的肌间平面内,可产生慢波电位;肌内ICC (intramuscular ICC, ICC-IM),位于环形肌和纵形肌的肌束内,是胃和结肠ICC的主要亚群;深肌丛ICC(deep muscular plexus ICC, ICC-DMP),是位于小肠特殊的深层肌丛区域内的一群ICC;黏膜下ICC(submucosal ICC, ICC-SM),位于黏膜与肌层之间,在胃窦和结肠中分布较多[15]。ICCs通过c-Kit(CD117)荧光染色在冷冻切片中显色,所有类别的ICC(包括ICC-IM)都表达钙敏感氯通道(anoctamin-1, ANO1)。最新研究证实在小鼠近端结肠ICC-IM表现出自发的、与电压无关的随机Ca2+瞬变,并依赖这一电导来实现其生理功能[16]。ICC是胃肠道起搏细胞,具有产生、传播慢波的功能。慢波引起肠道SMCs收缩,而不需要肠道神经元的任何活动。另外ICC能传导肠神经系统信号,进而调控平滑肌运动。乙酰胆碱(acetylcholine, ACh)是主要的兴奋性神经递质,在增加胃肠运动中的收缩力方面起着主要作用。胆碱能兴奋性反应是由2种类型的MUSCarinic受体(M2和M3)介导。ICC主要表达M3受体,肠神经释放ACh引起ICC-IM中的Ca2+释放激活ANO1,导致SMCs去极化和平滑肌的兴奋性增加[24]。研究表明,在巨结肠(Hirschsprung's disease, HSCR)无神经节病变肠段也发现ICC的异常,目前普遍接受的观点是HSCR不仅有神经节细胞缺如,还有ICC数量减少和结构受损[17]。胃肠动力障碍(gastrointestinal motility disorders, GMDs)是由于ICCs的丢失所致,其生存和功能对KIT/SCF信号的激活有着深远的影响。ICCs的生存和功能在很大程度上依赖于KIT/SCF信号的激活。基于胃肠扩张在GMDs患者中普遍存在,而平滑肌细胞(smooth muscle cell, SMC)产生的SCF通常在ICC丧失之前减少,认为结肠平滑肌细胞持续扩张/拉伸可能通过Ca-ERK-AP-1-miR-34c的失控,进而抑制SCF的产生,造成ICC丢失或受损,导致GMD进展[15]。
另外一种肠道间质细胞PDGFRα+细胞早期被称为成纤维细胞样细胞(fibroblast-like cell, FLC)。血小板衍生生长因子(platelet-derived growth factor,PDGF)是一个半胱氨酸结型生长因子家族,PDGF可同时作用于自分泌,并在胚胎发育过程中发挥积极作用。PDGF家族成员有5个,包括A-、B-、C-和D-多肽链的二硫键同族或异质二聚体,即PDGF-AA、PDGF-AB、PDGF-BB、PDGF-CC和PDGF-DD。PDGFs/PDGFRs轴在胚胎发育中起着至关重要的作用,其参与心脏、血管、脑膜、肾脏或胃肠道等多个器官的发育[18-19]。PDGFRα+受体与c-Kit受体同属于酪氨酸激酶,属于同一激酶组。Iino等通过ICC基因缺陷的W(v)/W(v)小鼠,发现消化道平滑肌有大量表达PDGFRα蛋白的细胞,该细胞对SK3蛋白也有强烈的免疫反应,参与消化道功能的调控[20]。后来,Kurahashi等[21]采用PDGFRα基因标记的荧光小鼠发现,荧光细胞表面有SK3通道及嘌呤能神经P2y1受体的表达,加入嘌呤能受体激动剂后,平滑肌上记录到的钾外向电流增加,证实嘌呤能神经对平滑肌收缩的抑制作用通过PDGFRα+细胞实现,首次描述了PDGFRα+细胞的生理特征以及嘌呤能神经受体对平滑肌细胞收缩的抑制作用。
Mitsui等[22]于2002年首次在电镜下观察到大鼠胃窦ICC与平滑肌细胞(smooth muscle cells, SMCs)形成缝隙连接,神经末梢与ICC密切接触。Koh等[23]在2010年同样于电镜下观察到大鼠胃窦与SMCs形成缝隙连接的除ICC之外,还有一种间质细胞即PDGFRα+细胞。证实了SMCs、ICC、PDGFRα+细胞与三种细胞通过其形成的缝隙连接调控平滑肌收缩,并在2012年将这一功能单位正式命名为SIP合胞体,其主要功能包括肌膜电位的设定、SMCs基础兴奋性的调节,以及负责电慢波、节段性和胃蠕动的起搏活动的产生。肠神经系统通过SIP合胞体对平滑肌运动进行调控[23]。研究表明,组成SIP合胞体的3种细胞在小鼠结肠显示不同的嘌呤受体信号表达谱,每种细胞类型在介导和终止嘌呤能信号传导中可能具有特定的作用。
PDGFRα+细胞强表达Ca2+激活的K通道SK3,嘌呤能递质是通过结合P2Y1受体和激活SK3而抑制SMCs收缩[24]。随后Sung等[25]证实在PDGFRα+细胞ICC和SMC中PAR蛋白酶激活受体(protease-activated receptors, PARs)的表达量是递减的; 对炎症介质(如PAR激动剂)的反应会导致细胞特异性反应,并证实非神经PAR激活的抑制作用是通过激活PDGFRα+细胞中的SK3通道介导的,而PAR反应的兴奋期主要由ICC介导。SIP合胞体中不同细胞类型的反应通过间质细胞与SMC之间的电耦合进行整合。SIP细胞中任何一个电导率变化都可以调节平滑肌兴奋性[25]。近期为了完成SIP合胞体转录组计划,Se Eun Ha获得了空肠和结肠PDGFRα+细胞的转录组数据; PDGFRα+细胞膜表面特异性表达PDGFRA、CD34以及SK3(KCNN3),在ICC膜表面特异性表达KIT、PDGFRA; 并得出PDGFRα+细胞转录组数据显示SMC标记基因在肠道PDGFRα+细胞也表达。提示这两个细胞处于同一细胞发育谱系中,证实了胚胎SMCs确实衍生于PDGFRα+细胞。小肠内膜SMCs胚胎SMC在13周时的环形肌层中表达PDGFRA/B和ACTA2。在胚胎15周时失去PDGFRA/B成为成熟的SMC; 而PDGFRα+细胞的特异性标志物为CACNA1G,是一种T型Ca2+通道[26]。
近年来有关ENS和SIP合胞体的研究发现,肠神经通过曲张体释放神经递质后,首先直接作用于ICC和PDGFRα+细胞,然后通过缝隙连接间接作用于SMCs,少量递质直接扩散到SMCs[23, 27]。ENS中胆碱能神经递质Ach主要作用于ICC表面的毒蕈碱受体(主要是M3),激活PLC/IP3信号通路,引起Ca2+释放增加并激活ANO1,ANO1的激活诱发ICC去极化,通过缝隙连接使得SMCs去极化,引发平滑肌产生收缩活动[25]。氮能神经递质NO激活鸟苷酸环化酶(guanylate cyclase, sGC),使得cGMP合成增加,进而激活蛋白激酶G(protein kinase G, PKG)并减少ICC中Ca2+释放,使平滑肌舒张。嘌呤能神经递质主要作用于PDGFRα+细胞表面的P2Y1受体,激活PLC/IP3信号通路,激活小电导钙激活的钾通道SK3、PDGFRα+细胞超极化,通过缝隙连接引起SMC超极化并平滑肌舒张。ENS通过调控兴奋性和抑制性神经递质的释放,再通过SIP合胞体控制平滑肌运动[27]。见图 1。
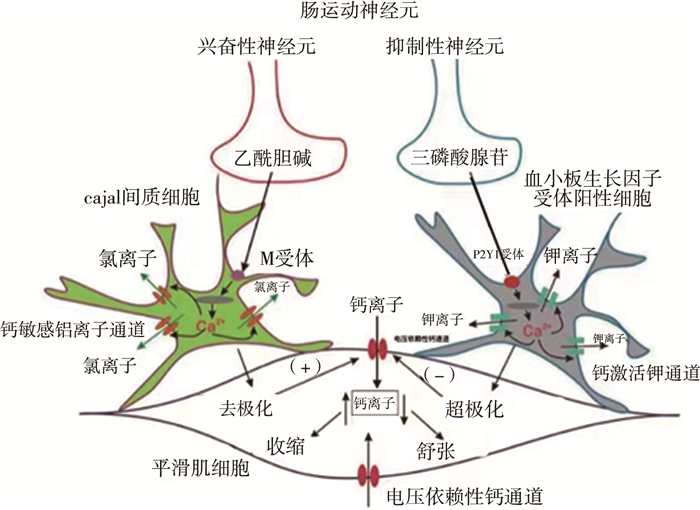
|
图 1 SIP合胞体示意图 Fig.1 Schematic diagram of SIP syncytium |
近年来,PDGFRα+细胞与结肠动力调控以及胃肠道疾病的相关研究逐渐成为一个新的热点。研究表明,胃肠道浆膜层的PDGFRα+细胞表面特异性的电压依赖性T型钙通道Cacna1g基因会诱导小鼠胃肠道PDGFRα+细胞大量增生,这与小鼠肠梗阻有关;且Cacna1g基因在人类结直肠癌、克罗恩病、憩室炎等疾病中均有过表达。浆膜层PDGFRα+细胞表达的Cacna1g基因可能是胃肠道疾病的病理标志物[28]。关于小鼠结肠传输功能的实验研究表明,结肠平滑肌内PDGFRα+细胞表达α1肾上腺素受体(α1 AR),去甲肾上腺素通过α1AR激活PDGFRα+细胞表面的SK通路,引起细胞超极化,进而抑制远端结肠以及CMMCs的传输运动,说明交感神经可通过PDGFRα+细胞表面的α1 AR-SK信号通路对结肠动力进行抑制性调控[29]。我们的研究也表明,正常小鼠结肠的ENS-ICC-ANO1和ENS-PDGFRα+细胞-SK3通路共同调控结肠传输功能,由于ICC的分布在近端和远端有差异,近端ICC分布相对较多, 而远端PDGFRα+细胞分布较多,共同形成一个动力梯度,由近端往远端蠕动,保证粪便顺利排出[30]。我们的研究还发现,慢性结肠不全梗阻小鼠结肠ICC和PDGFRα+细胞上的Kit和Ano1蛋白的表达明显降低,而SK3和PDGFRα蛋白的表达明显增加,说明ANO1通道功能降低,SK3通道功能增强[31]。上述结果提示,慢性结肠不全梗阻小鼠结肠ICC-ANO1和PDGFRα-SK3通道的失衡可能是结肠动力异常的一个重要因素。
三、ENS-SIP在先天性巨结肠病因研究中的进展众所周知,婴幼儿由于肠道功能发育尚不成熟,其发育是个动态过程。婴幼儿期常见排便不规律、便秘等症状,原因主要分为器质性和功能性两种。由功能性原因引起的便秘,患儿无肠道结构异常和功能代谢障碍,称为“功能性便秘”[32-35]。在器质性原因引起的婴幼儿排便异常中,研究数量最多的是先天性巨结肠(Hirschsprung disease, HSCR)。HSCR也是婴幼儿期常见疾病,发病率为1/5 000~1/2 000[36]。HSCR主要是结肠远端及直肠缺乏神经节细胞,导致远端肠管呈痉挛性狭窄状态,近端结肠出现继发性扩张与肥厚。临床表现为不全性或完全性结肠梗阻,多数病变局限于乙状结肠及直肠,少数累及全结肠或全消化道。最新研究表明,HSCR患儿结肠除神经节细胞缺失的主要病理改变外,肠道间质细胞的表达以及运动神经元通路的反应也受影响,包括兴奋性胆碱能反应,以及抑制性氮能反应和嘌呤能受体反应[37-41]。
(一) 兴奋性胆碱能反应胆碱能神经元通过释放乙酰胆碱(acetylchonline, ACh)刺激肠道运动神经元引发兴奋性胆碱能反应,释放的ACh与ICC中的毒蕈碱受体(主要是M3)结合。M3受体与Gq/11偶联,引起Ca2+释放增加并激活Ca2+释放激活的Cl-通道(anoctamin 1, ANO1)。ANO1的激活诱发兴奋性结电位(excitatory junctional potential, EJP)的产生[25]。近来研究表明HSCR患者在无神经节细胞肠段,ICC出现数量减少和质量受损、分布类型有异常,表明这些患者的遗传损害不仅发生在神经细胞及其前体,还有间质细胞受损[42]。
(二) 抑制性氮能神经反应nNOS神经元激活后释放NO激活鸟苷酸环化酶(soluble guanylate cyclase, sGC),cGMP产生增加,激活蛋白激酶G(protein kinase G, PKG)并减少ICC中Ca2+释放。然而最近研究表明,在HSCR患者近端神经节发育接近正常肠段的nNOS表达增多,影响患儿的结肠传输运动,可能是患儿术后仍然存在便秘的原因之一[37]。
(三) 抑制性嘌呤能神经反应在结肠中,嘌呤能递质释放后与P2Y1受体结合。P2Y1受体与Gq/11偶联,增加Ca2+的释放,激活小电导Ca2+激活的K+通道(SK),进而诱导PDGFRα+细胞的超极化。分子候选物是Kcnn3(SK3),其在PDGFRα+细胞中高度表达[43]。有研究通过观察巨结肠患儿有神经节段和无神经节段及正常对照组幼儿的肠道SK3的表达情况,发现术后肠道功能恢复不良患儿移行段SK3表达仍然较正常段少[44-45]。随后,O'Donnell等[46]又发现PDGFRα+细胞的数量在无神经节段也明显减少。即便在HSCR的近端神经节发育接近正常的肠段,SK3的表达也出现减少[47-48]。推测SK3通道及PDGFRα+细胞与巨结肠患儿结肠传输功能的关系密切,然而其具体作用机制尚不明确。Peri等[32]最新研究发现蛋白激酶PAR-1和PAR-2在HD患者结肠正常段与非正常段的SMCs、ICCs、PDGFRα+细胞均有较强表达,提示局部PAR激活的蛋白酶过度释放可能触发炎症反应,导致HD的发生。
HSCR患者无神经节肠段结肠动力障碍与ICC和PDGFRα+细胞有关,但相关研究主要停留在分子生物学层面,并没有进一步的结肠动力学实验证据说明两种细胞的减少与巨结肠患者的结肠传输功能障碍有关[41]。近年来国内外关于巨结肠的研究发现,HSCR患者近端神经节分布正常的肠段中,肠神经系统与肠道间质细胞网络发生改变,包括氮能神经元分布增多、PDGFRα+细胞及其嘌呤能神经SK3通道分布异常等,HSCR术后患者仍存在结肠传输功能障碍问题,6% ~25%的患者术后仍然承受便秘的困扰[44, 49]。手术切除病变肠段、近端神经节分布正常肠段中ENS-SIP肠神经间质细胞网络系统的改变是由无神经节细胞引起的继发改变,还是胚胎发育过程的同步发育异常,近端神经节分布正常肠段能否与正常的结肠功能相匹配,还有待进一步研究。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 王建峰负责文献检索和文章撰写;朱慧、陈杰负责对文章知识性内容进行审阅
| [1] |
Furness JB. The enteric nervous system and neurogastroenterology[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(5): 286-294. DOI:10.1038/nrgastro.2012.32 |
| [2] |
Furness JB. Integrated neural and endocrine control of gastrointestinal function[J]. Adv Exp Med Biol, 2016, 891: 159-173. DOI:10.1007/978-3-319-27592-5_16 |
| [3] |
Fida R, Lyster DJ, Bywater RA, et al. Colonic migrating motor complexes (CMMCs) in the isolated mouse colon[J]. Neurogastroenterol Motil, 1997, 9(2): 99-107. DOI:10.1046/j.1365-2982.1997.d01-25.x |
| [4] |
Costa M, Brookes SJ, Hennig GW. Anatomy and physiology of the enteric nervous system[J]. Gut, 2000, 47(Suppl 4): iv15-iv19. DOI:10.1136/gut.47.suppl_4.iv15 |
| [5] |
Brehmer A. Structure of enteric neurons[J]. Adv Anat Embryol Cell Biol, 2006, 186: 1-91. |
| [6] |
Yntema CL, Hammond WS. The origin of intrinsic ganglia of trunk viscera from vagal neural crest in the chick embryo[J]. J Comp Neurol, 1954, 101(2): 515-541. DOI:10.1002/cne.901010212 |
| [7] |
Burns AJ, Le Douarin NM. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras[J]. Anat Rec, 2001, 262(1): 16-28. DOI:10.1002/1097-0185(20010101)262:1<16::AID-AR1007>3.0.CO;2-O |
| [8] |
Anderson RB, Stewart AL, Young HM. Phenotypes of neural-crest-derived cells in vagal and sacral pathways[J]. Cell Tissue Res, 2006, 323(1): 11-25. DOI:10.1007/s00441-005-0047-6 |
| [9] |
Nagy N, Burns AJ, Goldstein AM. Immunophenotypic characterization of enteric neural crest cells in the developing avian colorectum[J]. Dev Dyn, 2012, 241(5): 842-851. DOI:10.1002/dvdy.23767 |
| [10] |
McCann CJ, Alves MM, Brosens E, et al. Neuronal development and onset of electrical activity in the human enteric nervous system[J]. Gastroenterology, 2019, 156(5): 1483-1495. DOI:10.1053/j.gastro.2018.12.020 |
| [11] |
Fu M, Lui VC, Sham MH, et al. HOXB5 expression is spatially and temporarily regulated in human embryonic gut during neural crest cell colonization and differentiation of enteric neuroblasts[J]. Dev Dyn, 2003, 228(1): 1-10. DOI:10.1002/dvdy.10350 |
| [12] |
Young HM, Jones BR, McKeown SJ. The projections of early enteric neurons are influenced by the direction of neural crest cell migration[J]. J Neurosci, 2002, 22(14): 6005-6018. DOI:10.1523/JNEUROSCI.22-14-06005.2002 |
| [13] |
Hao MM, Boesmans W, Van den Abbeel V, et al. Early emergence of neural activity in the developing mouse enteric nervous system[J]. J Neurosci, 2011, 31(43): 15352-15361. DOI:10.1523/JNEUROSCI.3053-11.2011 |
| [14] |
Spencer NJ, Hu H. Enteric nervous system: sensory transduction, neural circuits and gastrointestinal motility[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(6): 338-351. DOI:10.1038/s41575-020-0271-2 |
| [15] |
Blair PJ, Rhee PL, Sanders KM, et al. The significance of interstitial cells in neurogastroenterology[J]. J Neurogastroenterol Motil, 2014, 20(3): 294-317. DOI:10.5056/jnm14060 |
| [16] |
Drumm BT, Hwang SJ, Baker SA, et al. Ca(2+) signaling behaviours of intramuscular interstitial cells of Cajal in the murine colon[J]. J Physiol, 2019, 597(14): 3587-3617. DOI:10.1113/JP278036 |
| [17] |
Yang S, Dong F, Li D, et al. Persistent distention of colon damages interstitial cells of Cajal through Ca(2+) -ERK-AP-1-miR-34c-SCF deregulation[J]. J Cell Mol Med, 2017, 21(9): 1881-1892. DOI:10.1111/jcmm.13108 |
| [18] |
Jitariu AA, Cimpean AM, Kundnani NR, et al. Platelet-derived growth factors induced lymphangiogenesis: evidence, unanswered questions and upcoming challenges[J]. Arch Med Sci, 2015, 11(1): 57-66. DOI:10.5114/aoms.2015.49217 |
| [19] |
Gouveia L, Betsholtz C, Andrae J. Expression analysis of platelet-derived growth factor receptor alpha and its ligands in the developing mouse lung[J]. Physiol Rep, 2017, 5(6): e13092. DOI:10.14814/phy2.13092 |
| [20] |
Iino S, Horiguchi K, Horiguchi S, et al. c-Kit-negative fibroblast-like cells express platelet-derived growth factor receptor alpha in the murine gastrointestinal musculature[J]. Histochem Cell Biol, 2009, 131(6): 691-702. DOI:10.1007/s00418-009-0580-6 |
| [21] |
Kurahashi M, Zheng H, Dwyer L, et al. A functional role for the 'fibroblast-like cells' in gastrointestinal smooth muscles[J]. J Physiol, 2011, 589(Pt 3): 697-710. DOI:10.1113/jphysiol.2010.201129 |
| [22] |
Mitsui R, Komuro T. Direct and indirect innervation of smooth muscle cells of rat stomach, with special reference to the interstitial cells of Cajal[J]. Cell Tissue Res, 2002, 309(2): 219-227. DOI:10.1007/s00441-002-0592-1 |
| [23] |
Koh SD, Ward SM, Sanders KM. Ionic conductances regulating the excitability of colonic smooth muscles[J]. Neurogastroenterol Motil, 2012, 24(8): 705-718. DOI:10.1111/j.1365-2982.2012.01956.x |
| [24] |
Sanders KM, Ward SM, Koh SD. Interstitial cells: regulators of smooth muscle function[J]. Physiol Rev, 2014, 94(3): 859-907. DOI:10.1152/physrev.00037.2013 |
| [25] |
Sung TS, Kim HU, Kim JH, et al. Protease-activated receptors modulate excitability of murine colonic smooth muscles by differential effects on interstitial cells[J]. J Physiol, 2015, 593(5): 1169-1181. DOI:10.1113/jphysiol.2014.285148 |
| [26] |
Ha SE, Lee MY, Kurahashi M, et al. Transcriptome analysis of PDGFR α+ cells identifies T-type Ca2+ channel CACNA1G as a new pathological marker for PDGFRα+ cell hyperplasia[J]. PLoS One, 2017, 12(8): e0182265. DOI:10.1371/journal.pone.0182265 |
| [27] |
Durnin L, Lees A, Manzoor S, et al. Loss of nitric oxide-mediated inhibition of purine neurotransmitter release in the colon in the absence of interstitial cells of Cajal[J]. Am J Physiol Gastrointest Liver Physiol, 2017, 313(5): G419-G433. DOI:10.1152/ajpgi.00045.2017 |
| [28] |
宋妮娜, 许文燮. 胃肠平滑肌运动单位SIP合胞体的生理与病理生理学意义[J]. 生理学报, 2016, 68(5): 621-627. Song NN, Xu WX. Physiological and pathophysiological significance of gastrointestinal smooth muscle motor unit SIP syncytium[J]. Acta Physiologica Sinica, 2016, 68(5): 621-627. DOI:10.13294/j.aps.2016.0073 |
| [29] |
Kurahashi M, Kito Y, Baker SA, et al. A novel postsynaptic signal pathway of sympathetic neural regulation of murine colonic motility[J]. FASEB J, 2020, 34(4): 5563-5577. DOI:10.1096/fj.201903134R |
| [30] |
Lu C, Huang X, Lu HL, et al. Different distributions of interstitial cells of Cajal and platelet-derived growth factor receptor-α positive cells in colonic smooth muscle cell/interstitial cell of Cajal/platelet-derived growth factor receptor-α positive cell syncytium in mice[J]. World J Gastroenterol, 2018, 24(44): 4989-5004. DOI:10.3748/wjg.v24.i44.4989 |
| [31] |
Wang Q, Zang J, Huang X, et al. Colonic dysmotility in murine partial colonic obstruction due to functional changes in interstitial cells[J]. J Neurogastroenterol Motil, 2019, 25(4): 589-601. DOI:10.5056/jnm19136 |
| [32] |
Peri LE, Sanders KM, Mutafova-Yambolieva VN. Differential expression of genes related to purinergic signaling in smooth muscle cells, PDGFRα-positive cells, and interstitial cells of Cajal in the murine colon[J]. Neurogastroenterol Motil, 2013, 25(9): e609-e620. DOI:10.1111/nmo.12174 |
| [33] |
Benninga MA, Faure C, Hyman PE, et al. Childhood functional gastrointestinal disorders: neonate/toddler[J]. Gastroenterology, 2016, S0016-5085(16): 00182-7. DOI:10.1053/j.gastro.2016.02.016 |
| [34] |
Ranasinghe N, Devanarayana NM, Benninga MA, et al. Psychological maladjustment and quality of life in adolescents with constipation[J]. Arch Dis Child, 2017, 102(3): 268-273. DOI:10.1136/archdischild-2016-310694 |
| [35] |
Jeffrey HS, Cario DL, Miguel S, et al. Functional disorders: children and adolescents[J]. Gastroenterology, 2016, 150: 1456-1468. DOI:10.1053/j.gastro.2016.02.015 |
| [36] |
Tam P, Chung P, St Peter SD, et al. Advances in paediatric gastroenterology[J]. Lancet, 2017, 390(10099): 1072-1082. DOI:10.1016/S0140-6736(17)32284-5 |
| [37] |
Coyle D, O'Donnell AM, Gillick J, et al. Altered neurotransmitter expression profile in the ganglionic bowel in Hirschsprung's disease[J]. J Pediatr Surg, 2016, 51(5): 762-769. DOI:10.1016/j.jpedsurg.2016.02.018 |
| [38] |
Kobayashi H, O'Briain DS, Puri P. Lack of expression of NADPH-diaphorase and neural cell adhesion molecule (NCAM) in colonic muscle of patients with Hirschsprung's disease[J]. J Pediatr Surg, 1994, 29(2): 301-304. DOI:10.1016/0022-3468(94)90336-0 |
| [39] |
Larsson LT, Shen Z, Ekblad E, et al. Lack of neuronal nitric oxide synthase in nerve fibers of aganglionic intestine: a clue to Hirschsprung's disease[J]. J Pediatr Gastroenterol Nutr, 1995, 20(1): 49-53. DOI:10.1097/00005176-199501000-00009 |
| [40] |
Hanani M, Louzon V, Udassin R, et al. Nitric oxide-containing nerves in bowel segments of patients with Hirschsprung's disease[J]. J Pediatr Surg, 1995, 30(6): 818-822. DOI:10.1016/0022-3468(95)90756-4 |
| [41] |
O'Donnell AM, Puri P. Deficiency of purinergic P2Y receptors in aganglionic intestine in Hirschsprung's disease[J]. Pediatr Surg Int, 2008, 24(1): 77-80. DOI:10.1007/s00383-007-2044-1 |
| [42] |
Coyle D, Danielle AMK, O'Donnell AM, et al. Use of anoctamin 1 (ANO1) to evaluate interstitial cells of Cajal in Hirschsprung's disease[J]. Pediatr Surg Int, 2016, 32(2): 125-133. DOI:10.1007/s00383-015-3822-9 |
| [43] |
Cheng LS, Schwartz DM, Hotta R, et al. Bowel dysfunction following pullthrough surgery is associated with an overabundance of nitrergic neurons in Hirschsprung disease[J]. J Pediatr Surg, 2016, 51(11): 1834-1838. DOI:10.1016/j.jpedsurg.2016.08.001 |
| [44] |
Piotrowska AP, Solari V, Puri P. Distribution of Ca2+-activated K channels, SK2 and SK3, in the normal and Hirschsprung's disease bowel[J]. J Pediatr Surg, 2003, 38(6): 978-983. DOI:10.1016/s0022-3468(03)00138-6 |
| [45] |
Coyle D, O'Donnell AM, Puri P. Altered distribution of small-conductance calcium-activated potassium channel SK3 in Hirsch-sprung's disease[J]. J Pediatr Surg, 2015, 50(10): 1659-1664. DOI:10.1016/j.jpedsurg.2015.01.013 |
| [46] |
O'Donnell AM, Coyle D, Puri P. Deficiency of platelet-derived growth factor receptor-α-positive cells in Hirschsprung's disease colon[J]. World J Gastroenterol, 2016, 22(12): 3335-3340. DOI:10.3748/wjg.v22.i12.3335 |
| [47] |
Jarvi K, Laitakari EM, Koivusalo A, et al. Bowel function and gastrointestinal quality of life among adults operated for Hirschsprung disease during childhood: a population-based study[J]. Ann Surg, 2010, 252(6): 977-981. DOI:10.1097/SLA.0b013e3182018542 |
| [48] |
Neuvonen MI, Kyrklund K, Rintala RJ, et al. Bowel function and quality of life after transanal endorectal pull-through for Hirschsprung disease: controlled outcomes up to adulthood[J]. Ann Surg, 2017, 265(3): 622-629. DOI:10.1097/SLA.0000000000001695 |
| [49] |
Bjørnland K, Pakarinen MP, Stenstrøm P, et al. A Nordic multicenter survey of long-term bowel function after transanal endorectal pull-through in 200 patients with rectosigmoid Hirschsprung disease[J]. J Pediatr Surg, 2017, 52(9): 1458-1464. DOI:10.1016/j.jpedsurg.2017.01.001 |
 2022, Vol. 21
2022, Vol. 21


