2. 上海交通大学医学院附属新华医院超声科, 上海 200092;
3. 上海交通大学医学院附属新华医院小儿消化营养科, 上海 200092
2. Department of Ultrasonography, Affiliated Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China;
3. Department of Pediatric Digestive Nutrition, Affiliated Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China
先天性肛门直肠畸形(anorectal malformations, ARMs)在新生儿中发病率为2/10 000~6/10 000,女性发病率为男性的1.2~1.6倍[1]。不同性别ARMs临床表现差异较大,且畸形种类繁多,包括直肠会阴瘘、直肠舟状窝瘘、直肠阴道瘘、直肠尿道瘘、膀胱瘘、一穴肛等。随着手术方式的改进,特别是20世纪80年代早期后矢状入路肛门成形术开展后,临床对这种复杂畸形的处理有了显著改进[2-4]。腹腔镜辅助肛门成形术(laparoscopic assisted anorectoplasty, LAARP)于1998年由Willital[5]首次报道,后不断改进和推广。临床对于中高位肛门闭锁多采取出生后行结肠造瘘、择期行肛门成形术及造瘘关闭手术的分期手术方法。也有文献报道对新生儿无肛行一期肛门成形术,术后排便功能恢复较好[6]。本研究拟对比分析上海交通大学医学院附属新华医院小儿外科采取新生儿期一期肛门成形术以及分期肛门成形术治疗的中位无肛患儿远期肛门排便功能及肛门直肠测压结果,探讨新生儿期一期肛门成形术治疗中位肛门直肠畸形的疗效与预后。
资料与方法 一、临床资料回顾性分析上海交通大学医学院附属新华医院小儿外科2006年1月至2019年8月行新生儿期一期肛门成形术以及行分期肛门成形术的132例中位肛门直肠畸形患儿临床资料,根据Wingspread分类,中位肛门直肠畸形为盲端位于PC线(耻骨中点与骶尾关节之间的连线称耻尾线,即PC线)与I线(过坐骨嵴与耻尾线的平行线称I线)之间者。根据手术方式不同分为新生儿期一期肛门成形术组(A组)和分期肛门成形术组(B组)。手术均由同一位具有丰富手术经验的高年资医师完成,均行改良后矢状入路肛门成形术(modified posterior sagittal anorectoplasty, mini-Peña)。
A组共22例,其中男18例,女4例;直肠尿道瘘18例,舟状窝瘘3例,阴道瘘1例;平均出生体重为3 056.9 g(2 155~3 850 g),4例为早产。B组共110例,其中男98例,女12例;尿道瘘98例,舟状窝瘘8例,阴道瘘3例,无瘘1例;平均出生体重3 278.4 g(1 710~4 500 g)。A、B两组患儿性别分布、出生体重差异均无统计学意义[81.8%比89.1%,(3 056.9±505.1)比(3 278.4±502.4),P>0.05];两组合并畸形情况见表 1。本研究通过上海交通大学医学院附属新华医院伦理委员会批准(XHEC - D - 2022 - 143),患儿家属均签署知情同意书。
| 表 1 两组新生儿中位肛门直肠畸形患儿合并畸形情况比较(例) Table 1 Comparison of concomitant malformations between primary anoplasty (group 1) and traditional three-stage anoplasty (group 2) in infants with intermediate anorectal malformation(n) |
|
|
选择新生儿期一期肛门成形术的指征:出生后生命体征平稳,出生体重2 kg及以上,心、肺等重要脏器功能无异常,无危及生命的严重合并畸形,无明显腹胀,手术中俯卧位能够达到麻醉安全的要求,24 h倒立位X线片显示盲端位于PC线与I线之间,并经骶尾部MRI检查证实未合并Currarino综合征者。与上述情况不符的新生儿中位肛门直肠畸形选择分期手术。
三、手术方法改良后矢状入路肛门成形术(mini-Peña):患儿俯卧位,在电刺激仪定位外括约肌收缩中心点后,自尾骨尖向会阴部取正中切口,长1~1.5 cm,使切口下缘与肛门定位点之间有正常皮肤间隔,以隔开两处切口。拉钩轻柔牵开两边组织,游离直肠盲端或瘘管,予丝线结扎瘘管并切断,拖出肠管无张力;切口内电刺激定位肌肉复合体的中心点,自会阴部定位肛门开口处,切开皮肤适当大小,辨别肛门外括约肌中心点,并自此中心点逐步进入,与切口内肌肉复合体中心点相贯通,扩肛器初步扩大此通道,至与拖出肠管直径相当,将肠管从此隧道拖出。常规缝合肛门,依次缝合后矢状入路切口,固定并拖出肠管(图 1)。
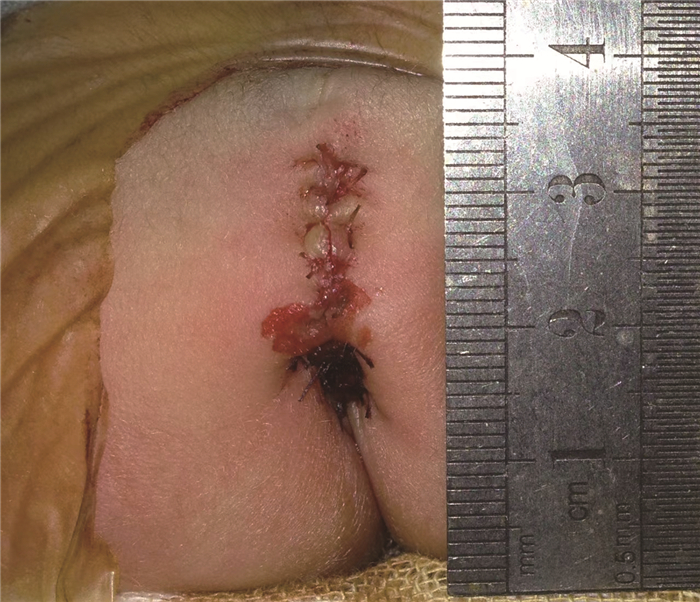
|
图 1 新生儿中位肛门直肠畸形改良后矢状入路手术(mini-Peña)皮肤切口 Fig.1 Modified sagittal approach (mini-Peña) skin incision in a neonate with intermediate anorectal malformation |
采取Rintala评分评估患儿术后排便功能,包括7个维度:控便能力、便意、排便频率、污粪、大便失禁、便秘、社会问题;评分6~8分为差,9~11分为中,12~17分为良,18~20分为优[7]。行肛门直肠测压并记录术后肛管长度及静息压,肛门内、外括约肌长度及静息压,直肠肛门抑制反射(rectoanal inhibitory reflex, RAIR)等。术后每6个月行肛门直肠测压1次,年龄4岁以下者行肛门直肠测压时可服用水合氯醛,每次0.5 mL/kg。两组检查方法一致,镇静剂对检查结果的影响可以忽略[8]。
五、统计学处理采用SPSS 21.0进行数据分析,符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以频数(百分比)表示,组间比较采用χ2检验或Fisher确切概率法。P < 0.05为差异有统计学意义。
结果A组获随访12例(12/22),平均随访时间10年9个月。Rintala评分优7例(7/12),良3例(3/12),中2例(2/12);出现便秘3例(3/12),污粪2例(2/12),黏膜脱垂3例(3/12),切口裂开1例(1/12),切口裂开患儿同时存在污粪。术后平均住院时间为17 d(12~28 d)。收集肛门直肠测压数据6例,其中4例直肠抑制反射可引出。
B组获随访75例(75/110, 68.2%),平均随访时间6年10个月。Rintala评分为优37例(37/75,49.3%),良29例(29/75,38.7%),中7例(7/75,9.3%),差2例(2/75,2.7%);出现便秘21例(21/75,28.0%),污粪12例(12/75,16.00%),直肠黏膜脱垂35例(35/75,46.7%),伤口感染1例(1/75,1.3%),切口裂开1例(1/75,1.3%),肛门狭窄1例(1/75,1.3%)。肛门成形术后住院时间平均为10.4 d(4~24 d),3次手术总住院时间及总手术时间平均为37.5 d和287.9 min。收集肛门直肠测压数据52例(52/110,47.2%),直肠抑制反射均未引出。1例切口裂开患儿术后肛门功能恢复无明显影响。
两组均无死亡病例,患儿术后均无大小便失禁表现。A组住院时间长于B组[(17.1±3.9)d比(10.4±3.4)d,P < 0.05],手术时间亦长于B组[(128.9±29.0) min比(119.3±38.9)min,P>0.05], 总住院时间和手术时间短于B组[(19.6±5.5)d比(37.5±10.7)d,(128.9±29.0)min比(287.9±61.2)min,P < 0.05],见表 2。
| 表 2 新生儿中位肛门直肠畸形一期肛门成形术与传统三期肛门成形术患儿基本临床资料及结果比较 Table 2 Comparison of basic clinical data and outcomes between primary anoplasty (group 1) and traditional three-stage anoplasty (group 2) in infants with intermediate anorectal malformation |
|
|
肛门直肠测压检查显示,A组与B组相比,肛门长度及内、外括约肌长度差异均无统计学意义[(1.53±0.62)cm比(1.68±0.45)cm,(1.20±0.57)cm比(1.38±0.38)cm,(0.52±0.10)cm比(0.46±0.17)cm,P>0.05];A组肛门静息压、内括约肌静息压及外括约肌静息压高于B组[(53.8±15.5)mmHg(1 mmHg=0.133 kPa)比(36.7±10.4)mmHg,(53.5±15.1)mmHg比(34.6±8.7)mmHg,(45.7±16.9)mmHg比(33.9±11.8)mmHg,P < 0.05],直肠抑制反射引出率高于B组(66.7%比0%,P < 0.05)。其他数据如收缩最大肛门压、收缩高压带长度等差异无统计学意义,见表 3。
| 表 3 新生儿中位肛门直肠畸形一期肛门成形术与传统三期肛门成形术患儿术后肛门直肠测压比较 Table 3 Comparison of anorectal manometry between primary anoplasty (group 1) and traditional three-stage anoplasty (group 2) in infants with intermediate anorectal malformation |
|
|
两组Rintala评分优良率差异无统计学意义(83.3%比88.0%,P>0.05);术后便秘及污粪的发生率差异无统计学意义(25%比28.0%,16.7%比16.0%,P>0.05),术后并发症的发生率差异亦无统计学意义(33.3%比50.7%,P>0.05),见表 4。
| 表 4 新生儿中位肛门直肠畸形一期肛门成形术与传统三期肛门成形术患儿术后排便功能及并发症比较[例(%)] Table 4 Comparison of postoperative defecation function and complications between primary anoplasty (group 1) and traditional three-stage anoplasty (group 2) in infants with intermediate anorectal malformation[n(%)] |
|
|
随着对先天性肛门直肠畸形认识的深入及治疗水平的提高,其治疗的重点已从保障患儿基本生存转向改善患儿术后排便功能,提高患儿生活质量。尽管治疗中高位肛门直肠畸形的手术方式如Peña后矢状入路肛门成形术(posterior sagittal anorectoplasty, PSARP)、腹腔镜辅助肛门成形术(laparoscopic assisted anorectoplasty, LAARP)等得到不断改良,但术后仍可能出现不同程度的排便功能障碍(如便秘、污粪等),尽可能缩短治疗周期并达到良好的治疗效果成为患儿家庭的迫切诉求。
一期肛门成形术可使患儿及家庭在医疗、心理和经济上获益,避免重复麻醉、手术以及造瘘相关并发症,如造口黏膜脱垂、粘连、狭窄、切口疝等;同时缩短住院时间,减少医疗费用,减轻患儿家庭经济压力[9-12]。一些研究支持对肛门直肠畸形于新生儿期一期修复,认为其术后功能恢复更好,且短期并发症少、病死率较低[13-14]。传统分期手术包括肠造口、肛门成形和肠造口的关闭,该方式对生后早期出现腹胀等不适者有较好的帮助,围手术期禁食时间缩短,减少了静脉营养的时间及可能产生的并发症;因存在结肠造瘘,可减少切口感染的发生,但经腹造瘘手术有导致肠粘连、肠梗阻的风险。虽然三期手术造口并发症发生率达39.6%,但为了第一时间建立排便通道,小儿外科医师更倾向采用保护性结肠造口术[15-18]。
本研究发现一期肛门成形术手术时间及单次住院时间较分期肛门成形术稍长。考虑到新生儿期一期肛门成形术步骤复杂,新生儿组织脆嫩,术中解剖操作需非常精细准确,动作轻柔;同时一期手术因未行结肠造瘘,故术中要尽可能使结肠内胎粪排净,以减轻术后对成形肛门愈合可能产生的影响。术后对后矢状入路切口和成形肛门的护理非常重要,应严格避免切口感染、裂开,促进切口和肛门自然愈合,因此住院时间更长。一期肛门成形总体手术时间和住院时间明显短于分期手术,可见早期成形手术可显著缩短总住院时间及麻醉时间,有助于减少麻醉和手术过程对患儿可能造成的影响。
既往文献报道行一期肛门成形术的患儿可能手术日龄超过了新生儿期,或主要分析术后近期并发症,未行肛门直肠测压数据分析,本研究随访了本院既往于新生儿期行一期肛门成形术的患儿,对其排便功能进行评分及肛门直肠测压进行分析,以明确患儿远期排便功能,从而对新生儿期施行一期肛门成形的整体效果做出客观评价。有研究报道肠道连续性的早期恢复可以训练会阴部肌肉组织,并改善长期排便习惯[9, 19]。在Karakus等[20]的研究中,一期肛门成形和分期肛门成形患儿便秘的发生率分别为23.5%和35.7%。Upadhyaya等[6]对27例新生儿期行肛门成形术的前庭瘘患儿进行回顾性总结,发现3例术后出现伤口感染,4例出现便秘,16例(16/27,59.3%)Kelly评分等级为优。Menon等[21]报道72例接受一期肛门成形术的患儿中5例出现伤口感染,无一例伤口裂开和瘘管复发。本研究结果显示,一期肛门成形和分期肛门成形的患儿术后并发症发生率分别为33.3%和50.7%,与相关文献比较无显著差异[1]。一期肛门成形患儿便秘发生率约25%,术后污粪发生率约16.7%,而分期手术者便秘发生率约28%,术后污粪发生率约16%;与其他文献相比处于较低水平,而便秘发生率差异较小[13, 20]。两组之间Rintala评分优良率未见较大差异,一期手术也可得到较好的排便功能。文献报道无肛患儿分期手术死亡率为15% ~20%,一期手术的死亡率为4.5%[14]。本研究中无一例术后死亡病例。
对肛门直肠畸形于新生儿期行一期手术治疗有以下优势:患儿年龄小, 有利于新神经突触早期在直肠周围形成,同时记忆能力发育不完善,更易于术后扩肛以及患儿控制排便,如果手术延迟,减少了神经元网络和突触发育过程,可能会错过正常肛门直肠功能形成的关键时间[9, 22]。有研究显示,与新生儿期行一期手术与分期手术相比,肛门静息压及最大收缩压在两组之间比较,差异无统计学意义[15]。而本研究发现新生儿期一期肛门成形患儿肛门静息压、内括约肌静息压及外括约肌静息压明显高于非一期手术者,直肠抑制反射引出率也远远高于后者,新生儿期一期肛门成形术对于患儿括约肌的训练有明显益处,可早期建立肛门直肠连续性,最大限度激发排便反应潜力,长久来看可以显著改善肛门括约肌的功能。
由于新生儿期行肛门手术较为困难,对于术者操作有较高的要求,需要其具有丰富的手术经验。对于一期肛门成形术我们总结了几点:①术前完善相关检查(如磁共振检查),评估是否存在骶尾部畸形或骶前肿物,判断外括约肌中心点,帮助进行术中切口的定位(尾骨尖至外括约肌中心点的连线上)。②因新生儿组织稚嫩,含水量高,组织间层次难以清晰辨别,手术路径中应动态使用电刺激仪帮助定位和分辨。③手术中要轻柔牵拉两边组织,避免切口遭到撕拉,损伤肌肉复合体或伤及保留间隔切口的皮肤,增加切口感染的机会;应仔细辨别清楚组织结构,避免损伤尿道和前列腺体。④仔细辨别肛门外括约肌中心点,并自此中心点逐步进入,严格保护肌肉复合体和间隔皮桥完整无损。
本研究也存在一些局限,因本研究为回顾性研究,结果可能存在偏倚,同时肠功能可能会受到其他相关畸形的影响,需进一步比较研究以系统评估其术后疗效。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 陈思颖和王俊负责研究的设计、实施和起草文章;陈思颖、邬文杰、李安娜、沈志云进行病例数据收集及分析;陈思颖和王俊负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Divarci E, Ergun O. General complications after surgery for anorectal malformations[J]. Pediatr Surg Int, 2020, 36(4): 431-445. DOI:10.1007/s00383-020-04629-9 |
| [2] |
Levitt MA, Peña A. Anorectal malformations[J]. Orphanet J Rare Dis, 2007, 2: 33. DOI:10.1186/1750-1172-2-33 |
| [3] |
Wood RJ, Halleran DR, Ahmad H, et al. Assessing the benefit of reoperations in patients who suffer from fecal incontinence after repair of their anorectal malformation[J]. J Pediatr Surg, 2020, 55(10): 2159-2165. DOI:10.1016/j.jpedsurg.2020.06.011 |
| [4] |
Peña A, Devries PA. Posterior sagittal anorectoplasty: important technical considerations and new applications[J]. J Pediatr Surg, 1982, 17(6): 796-811. DOI:10.1016/s0022-3468(82)80448-x |
| [5] |
Willital GH. Endosurgical intrapuborectal reconstruction of high anorectal anomalies[J]. Pediatric Endosurgery & Innovative Techniques, 1998, 2(1): 5-11. DOI:10.1089/pei.1998.2.5 |
| [6] |
Upadhyaya VD, Gopal SC, Gupta DK, et al. Single stage repair of anovestibular fistula in neonate[J]. Pediatr Surg Int, 2007, 23(8): 737-740. DOI:10.1007/s00383-007-1965-z |
| [7] |
Rintala RJ, Lindahl H. Is normal bowel function possible after repair of intermediate and high anorectal malformations?[J]. J Pediatr Surg, 1995, 30(3): 491-494. DOI:10.1016/0022-3468(95)90064-0 |
| [8] |
Chung P, Wong C, Wong K, et al. Assessing the long term manometric outcomes in patients with previous laparoscopic anorectoplasty (LARP) and posterior sagittal anorectoplasty (PSARP)[J]. J Pediatr Surg, 2018, 53(10): 1933-1936. DOI:10.1016/j.jpedsurg.2017.10.058 |
| [9] |
Albanese CT, Jennings RW, Lopoo JB, et al. One-stage correction of high imperforate anus in the male neonate[J]. J Pediatr Surg, 1999, 34(5): 834-836. DOI:10.1016/s0022-3468(99)90382-2 |
| [10] |
Bischoff A, Levitt MA, Lawal TA, et al. Colostomy closure: how to avoid complications[J]. Pediatr Surg Int, 2010, 26(11): 1087-1092. DOI:10.1007/s00383-010-2690-6 |
| [11] |
Chandramouli B, Srinivasan K, Jagdish S, et al. Morbidity and mortality of colostomy and its closure in children[J]. J Pediatr Surg, 2004, 39(4): 596-599. DOI:10.1016/j.jpedsurg.2003.12.016 |
| [12] |
Macmahon RA, Cohen SJ, Eckstein HB. Colostomies in Infancy and Childhood[J]. Arch Dis Child, 1963, 38(198): 114-117. DOI:10.1136/adc.38.198.114 |
| [13] |
Gangopadhyay AN, Shilpa S, Mohan TV, et al. Single-stage management of all pouch colon (anorectal malformation) in newborns[J]. J Pediatr Surg, 2005, 40(7): 1151-1155. DOI:10.1016/j.jpedsurg.2005.03.050 |
| [14] |
Gangopadhyay AN, Gopal SC, Sharma S, et al. Management of anorectal malformations in Varanasi, India: a long-term review of single and three stage procedures[J]. Pediatr Surg Int, 2006, 22(2): 169-172. DOI:10.1007/s00383-005-1567-6 |
| [15] |
Liu G, Yuan J, Geng J, et al. The treatment of high and intermediate anorectal malformations: one stage or three procedures?[J]. J Pediatr Surg, 2004, 39(10): 1466-1471. DOI:10.1016/j.jpedsurg.2004.06.021 |
| [16] |
Adeniran JO. One-stage correction of imperforate anus and rectovestibular fistula in girls: Preliminary results[J]. J Pediatr Surg, 2002, 37(6): E16. DOI:10.1053/jpsu.2002.32927 |
| [17] |
Pena A, Migotto-Krieger M, Levitt MA. Colostomy in anorectal malformations: a procedure with serious but preventable complications[J]. J Pediatr Surg, 2006, 41(4): 748-756. DOI:10.1016/j.jpedsurg.2005.12.021 |
| [18] |
Patwardhan N, Kiely EM, Drake DP, et al. Colostomy for anorectal anomalies: high incidence of complications[J]. J Pediatr Surg, 2001, 36(5): 795-798. DOI:10.1053/jpsu.2001.22963 |
| [19] |
Xiao H, Chen L, Ren XH, et al. One-stage laparoscopic-assisted anorectoplasty for neonates with anorectal malformation and recto-prostatic or recto-bulbar fistula according to the Krickenbeck Classification[J]. J Laparoendosc Adv Surg Tech A, 2018, 28(8): 1029-1034. DOI:10.1089/lap.2017.0690 |
| [20] |
Karakus SC, User IR, Akcaer V, et al. Posterior sagittal anorectoplasty in vestibular fistula: with or without colostomy[J]. Pediatr Surg Int, 2017, 33(7): 755-759. DOI:10.1007/s00383-017-4102-7 |
| [21] |
Menon P, Rao KL. Primary anorectoplasty in females with common anorectal malformations without colostomy[J]. J Pediatr Surg, 2007, 42(6): 1103-1106. DOI:10.1016/j.jpedsurg.2007.01.056 |
| [22] |
Moore TC. Advantages of performing the sagittal anoplasty operation for imperforate anus at birth[J]. J Pediatr Surg, 1990, 25(2): 276-277. DOI:10.1016/0022-3468(90)90440-k |
 2022, Vol. 21
2022, Vol. 21


