先天性食管闭锁是新生儿常见严重消化道畸形,常合并食管气管瘘,其中Ⅲ型最为常见[1]。随着腔镜手术技术的发展,越来越多的单位采用胸腔镜下手术治疗食管闭锁,并取得了良好的治疗效果[2]。食管闭锁术后最常见的并发症是吻合口瘘和食管狭窄[1-2]。据文献报道,约87%的食管闭锁患儿合并气管软化,其中16% ~33%的食道闭锁患儿术后会出现因气管软化导致的呼吸系统明显症状[3-4]。此外,在临床工作中我们也发现,有部分食管闭锁患儿术后难以撤离呼吸机辅助通气治疗,而长期依赖呼吸机治疗容易导致多种并发症。
气管软化是指由于呼气时气管不能够维持正常的形态而发生塌陷,从而导致一系列并发症[3]。此外,气管塌陷可能导致通气功能和分泌物清除功能受损,增加呼吸道感染的风险。但目前食管闭锁合并气管软化在国内尚未引起足够的重视,而手术治疗气管软化尚未见报道。湖南省儿童医院从2018年开始,针对Ⅲ型食管闭锁合并中度或重度气管软化的患儿采用胸腔镜下气管后壁悬吊术加食管端端吻合术进行治疗,现将研究结果报道如下:
资料与方法 一、研究对象本研究为回顾性研究。以2018年1月至2020年1月湖南省儿童医院新生儿外科收治的11例食管闭锁合并中度或重度气管软化患儿为研究对象。男5例,女6例,患儿均为Ⅲ型食管闭锁,胎龄39(36~40)周,出生体重为2.8(1.9~4.6)kg;2例合并心脏畸形,1例合并环状胰腺,1例合并肛门狭窄,1例合并脊柱畸形;临床资料见表 1。本研究经湖南省儿童医院伦理委员会审核同意(2021-152)。
| 表 1 11例同期行食管闭锁和气管软化手术患儿的术前资料 Table 1 Preoperative data characteristics of children undergoing esophageal atresia and tracheomalacia surgery at the same time |
|
|
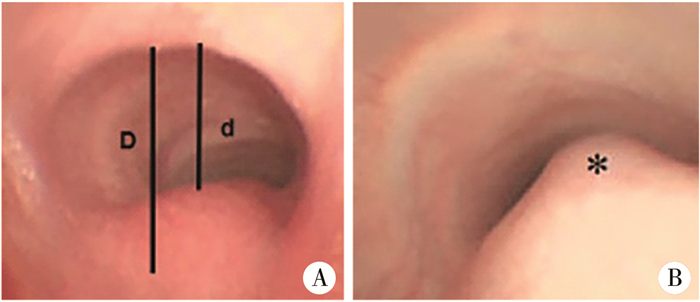
收集所有患儿术前支气管镜气管软化评分、气管悬吊手术时间、术后气管插管辅助通气时间、有无食管瘘及气管损伤、呼吸道感染情况、抗生素使用情况。①支气管镜气管软化评分:支气管镜塌陷程度评分=(1-d/D)×100%(图 1A);轻度塌陷为70% ~80%,中度塌陷为81% ~90%,严重塌陷为91% ~100%(图 1B)。②气管悬吊时间:从术者第一针悬吊开始,至最后悬吊打结完成为止的时间。③术后气管插管辅助通气时间:从完成手术返回病房开始至顺利拔管时间。④有无食管瘘及气管损伤:术后1周行食管造影明确有无造影剂进入胸腔并观察有无气胸。呼吸道感染情况:患儿随访期间内有无呼吸道感染,包括是否使用抗生素治疗及住院治疗次数。
|
图 1 食管闭锁合并食管气管瘘患儿术前支气管镜检查图片 Fig.1 Preoperative bronchoscopic images of children with esophageal atresia and esophagotracheal fistula 注 A:正常呼气相状态下的气管形态,D表示气管无塌陷时前后气管直径,d为气管塌陷时前后气管直径;B:气管后壁存在明显塌陷,几乎和气管前壁贴合,呈逗号形态,*表示气管后壁 |
电子纤维支气管镜(Olympus XP260F)检查在新生儿重症监护室进行,检查前对患儿进行利多卡因雾化处理,在减轻患儿操作中不适的同时,完全保留患儿自主呼吸。在心电监测及血氧饱和度监测下,待患儿呼吸平稳后,由专业的内镜医师用柔软性电子支气管镜对患儿进行检查。首先评估声门以上是否存在结构畸形和声带功能,通过声门进入气管,评估是否存在气管软化,以及整个呼吸循环中气管和支气管的动态呼吸运动情况;检查者在观察患儿气管在呼吸过程中动态变化时,评估是否合并气管软化,并观察气管软化的部位及气管塌陷的程度(塌陷部位空腔面积占总气管腔的百分比)[5]。如果发现气管前壁有塌陷,需告知手术医生并进一步完善影像学检查,检查完毕后退出支气管镜。
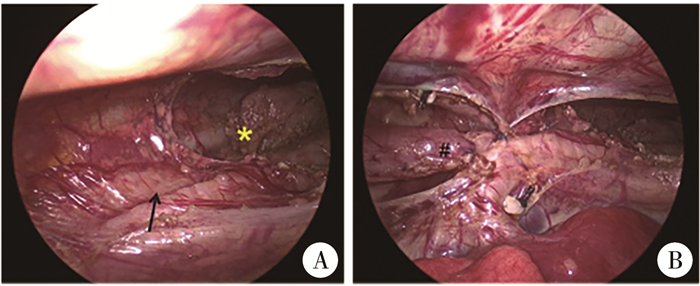
四、手术治疗方式患儿全身麻醉后,取左侧前倾位,于右侧腋后线水平靠近肩胛下角处取长度5 mm的皮肤切口,并插入5 mm腹腔镜穿刺器Trocar作为观察孔,通过该孔注入二氧化碳气体建立人工气胸,压力维持在6~8 mmHg(1 mmHg=0.133 kPa),流量1~2 mL/min。操作者在腔镜孔监视下分别于右腋中线第3、7肋间做切口放置3 mmTrocar。手术首先离断奇静脉,电凝钩游离食管远近端,确认食管气管瘘,于距离结扎处远端0.3 cm处切断瘘管,镜下见呼气时气管后壁明显塌陷(图 2A),将气管后壁塌陷部位用5 - 0可吸收线缝合悬吊固定于椎前筋膜,悬吊固定后可见气管壁塌陷即刻缓解(图 2B)。于食管近端切除盲袋,用5 - 0可吸收线间断行食管端端吻合,检查吻合口满意,胸腔内注入生理盐水,检查气管处未见气泡则排除气管损伤。检查无活动性出血后,拔除Trocar,排出气体消除气胸,留置胸腔引流管,用可吸收线缝合伤口肌层,用生命胶粘合皮肤切口。
|
图 2 气管软化患儿胸腔镜下气管后壁悬吊术中图片 Fig.2 Images of tracheal posterior wall suspension in children with tracheomalacia under thoracoscope 注 A:食管气管瘘上方可见气管后壁呼气相有明显塌陷,箭头处代表塌陷的气管后壁,*表示食管近端;B:胸腔镜下将气管塌陷部分缝合悬吊固定于椎前筋膜处,间断缝合2~3针,可见经悬吊固定后立即解除气管后壁塌陷,#表示食管气管瘘近端 |
患儿于术后1、3、6、12个月定期于本院门诊随访,复查食管造影明确有无食管狭窄。术后6个月行支气管镜检查评估气道塌陷情况。复诊时记录患儿呼吸道感染及抗生素使用情况。
六、统计学处理采用SPSS 22.0对数据进行整理,计量资料采用中位数(最小值,最大值)进行描述。
结果 一、围手术期情况11例均在胸腔镜下完成气管后壁悬吊+食管端端吻合术,无一例中转开胸手术。患儿手术年龄3(1~9)d。11例术前均有气促表现,其中2例需要呼吸机辅助支持。患儿术前均行支气管镜检查评估气道塌陷情况,术前支气管镜评估气管后壁塌陷程度为90%(85% ~95%),均为中度或重度气管软化。术中完成气管后壁悬吊的手术时间(即从第一针进针开始至最后打结完成结束时间)为7(5~8)min,在行气管后壁悬吊手术过程中,无气管撕裂及气管破裂发生。所有患儿完成手术后转入新生儿重症监护病房行呼吸机辅助支持治疗。患儿从气管插管呼吸机辅助通气到拔管时间为65(15~189)h。所有患儿在术后1周完成食管造影,X线片均未见气胸。其中2例在行食管造影时发现有造影剂进入胸腔,诊断为食管瘘,经保守治疗1~2周后食管瘘均自行愈合。患儿均顺利恢复全量口服喂养出院。
二、随访结果11例均获得随访,随访时长12(10~15)个月。随访过程中1例有反复呛奶表现,食管造影显示食管狭窄,经食道扩张治疗后缓解。10例随访过程中无明显呼吸道感染症状出现,因支气管镜检查属于有创操作,家属在随诊过程中拒绝行支气管镜检查。1例出现反复喘息、咳嗽、呼吸道感染,术后1年于本院呼吸内科住院治疗4次,住院期间行支气管镜检查提示气管后壁塌陷复发,家属拒绝再次手术治疗,经反复氧疗及抗感染治疗后,随着患儿年龄增长,末次随访时其呼吸道症状逐渐好转。
讨论食管和气管在胚胎发育过程中具有共同的起源,在正常情况下,气管的后纵壁约占气管周径的1/3,而在食管闭锁患儿中,气管后纵壁比可达1/2甚至更多,所以气管软化在先天性食管闭锁伴或不伴有气管食管瘘的患者中更常见[6-7]。呼气时,胸廓内与气管内压力差使气管后壁发生过度塌陷,从而引起患儿通气功能和呼吸道清除功能受损。研究报道16% ~33%的食道闭锁患儿术后会出现因气管软化而导致的呼吸系统症状[3-4]。气管软化症常表现为慢性呼吸系统症状(如咳嗽、反复呼吸道感染)以及气流限制引起喘息、发绀和窒息等表现。由于儿科医生对气管软化认识不足,患儿经常被当做哮喘、反应性气道疾病进行治疗,反复抗感染治疗或因误诊后长期使用激素治疗,严重影响患儿的生活质量和成长[5-7]。对于食管闭锁患儿,如果出现食管因素不能解释的并发症时,应考虑到气管软化,早期做出诊断并进行积极治疗。
气管塌陷程度与临床症状并没有明确的关联性。在用力呼气时,气管前后径可产生(50±20)%的生理性塌陷[8-10]。一些研究发现气管塌陷达70%是气管病理性塌陷的门槛,塌陷程度大于90%的患儿需要积极治疗和干预[11-13]。根据支气管镜下动态观察气管塌陷的比例,气管软化可分为三度,轻度塌陷为70% ~80%,中度塌陷为81% ~90%,重度塌陷为91% ~100%[12]。婴幼儿作为一个特殊群体,一般生后2~3个月才会出现气管软化相关症状。本研究选取对象均为中度或重度气管塌陷患儿,通过气管后壁悬吊来改善气管塌陷。
目前报道的气管软化症治疗方式包括药物治疗、主动脉固定、气管支架植入、气管外固定以及目前最新的气管前壁及后壁固定,目前还没有研究证明气管软化症的最佳治疗方式[8, 14-15]。轻度气管软化可以予保守治疗,病情随着患儿年龄增长而得到缓解,通常在2岁时缓解[7]。对于重度气管软化需要手术治疗的患儿,目前采用的主流治疗方式为主动脉固定术,研究报道该治疗方式有效率达80%[14]。但该手术方式主要针对支气管前壁压迫所致的塌陷,不能解决因气管后壁发育问题所造成的气管塌陷。Bairdain在2015年报道了一种新的治疗方式,弥补了主动脉固定术的不足,将塌陷气管后壁固定于脊柱前纵韧带上,手术局限于后纵膈,相对于主动脉固定术更加安全,疗效满意[16]。虽然两种手术方式都能够治疗气管软化,但研究对象主要为食管闭锁术后患儿,且均为开放性手术。Tytgat等[17]首先采用胸腔镜下气管后壁悬吊术联合食管端端吻合术治疗食管闭锁合并中度或重度气管软化患儿,术中行食管闭锁端端吻合前,先行气管后壁悬吊术,气管悬吊手术时间平均6 min。术后随访无一例出现气管软化症表现。但该研究仅纳入4例气管软化患儿,其中3例气管塌陷程度小于70%,一定程度上影响了结论的外推能力。我们的治疗理念与Tytgat相同,考虑到气管软化的危害及二期手术治疗气管软化存在困难,本研究中患儿术前均常规行支气管镜检查,对合并有中度或重度气管软化患儿,在胸腔镜下同期行气管后壁悬吊术联合食管端端吻合术治疗。气管后壁悬吊手术时间平均约7 min,同前期研究结果相似。术中无气管损伤发生,术后早期呼吸机使用时间最长为7 d,最短为15 h,术后无一例需要长期气管插管辅助通气。随访过程中2例出现食管瘘,其中1例出现食管狭窄,经保守治疗好转;1例出现气管软化症表现,经保守治疗好转,无需再次手术治疗。但对于远期呼吸系统症状的评估,还需要进一步随诊和前瞻性研究来证实。在进行气管后壁悬吊术时,应注意避免损伤气管。在钳夹气管的过程中,应动作轻柔,避免过度牵拉造成气管撕裂。于气管塌陷最明显处进针,进针过程中注意不要穿透气管后壁,并将其固定于气管后壁的前纵韧带筋膜上,纵向排列约3针左右。缝合过程中打结的力度以刚好维持气管管径为宜,避免打结用力过度造成气管损伤。
综上所述,对于食管闭锁合并重度气管软化的患儿,在治疗食管闭锁的同时,一期行气管后壁悬吊手术,在早期可以避免术后长时间气管插管辅助呼吸,并可能对气管软化症有预防作用,避免二次手术,作为一项食管闭锁合并气管软化的全新治疗方式,值得推广。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 周崇高、李碧香负责研究的设计、实施和起草文章;邹婵娟、肖咏、李明、李波进行病例数据收集及分析;夏仁鹏,许光,李碧香负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Van der zee DC, Van Herwaarden MYA, Hulsker CCC, et al. Esophageal atresia and upper airway pathology[J]. Clin Perinatol, 2017, 44(4): 753-762. DOI:10.1016/j.clp.2017.08.002 |
| [2] |
Van Hoorn CE, Ten Kate CA, Rietman AB, et al. Long-term neurodevelopment in children born with esophageal atresia: a systematic review[J]. Dis Esophagus, 2021, 34(11): doab054. DOI:10.1093/dote/doab054 |
| [3] |
Boogaard R, Huijsmans SH, Pijnenburg MWH, et al. Tracheomalacia and bronchomalacia in children: incidence and patient characteristics[J]. Chest, 2005, 128(5): 3391-3397. DOI:10.1378/chest.128.5.3391 |
| [4] |
Kamran A, Zendejas B, Jennings RW. Current concepts in tracheobronchomalacia: diagnosis and treatment[J]. Semin Pediatr Surg, 2021, 30(3): 151062. DOI:10.1016/j.sempedsurg.2021.151062 |
| [5] |
Shieh HF, Smithers CJ, Hamilton TE, et al. Posterior tracheopexy for severe tracheomalacia[J]. J Pediatr Surg, 2017, 52(6): 951-955. DOI:10.1016/j.jpedsurg.2017.03.018 |
| [6] |
Kamran A, Baird CW, Jennings RW. Tracheobronchomalacia, tracheobronchial compression, and tracheobronchial malformations: diagnostic and treatment strategies[J]. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu, 2020, 23: 53-61. DOI:10.1053/j.pcsu.2020.02.006 |
| [7] |
Hysinger EB, Panitch HB. Paediatric tracheomalacia[J]. Paediatr Respir Rev, 2016, 17: 9-15. DOI:10.1016/j.prrv.2015.03.002 |
| [8] |
Parikh M, Wilson J, Majid A, et al. Airway stenting in excessive central airway collapse[J]. J Vis Surg, 2017, 3: 172. |
| [9] |
Diaz Milian R, Foley E, Bauer M, et al. Expiratory central airway collapse in adults: anesthetic implications (part 1)[J]. J Cardiothorac Vasc Anesth, 2019, 33(9): 2546-2554. DOI:10.1053/j.jvca.2018.08.205 |
| [10] |
O'Donnell CR, Litmanovich D, Loring SH, et al. Age and sex dependence of forced expiratory central airway collapse in healthy volunteers[J]. Chest, 2012, 142(1): 168-174. DOI:10.1378/chest.11-2361 |
| [11] |
Kheir F, Majid A. Tracheobronchomalacia and excessive dynamic airway collapse: medical and surgical treatment[J]. Semin Respir Crit Care Med, 2018, 39(6): 667-673. DOI:10.1055/s-0038-1676571 |
| [12] |
Fayoux P, Morisse M, Sfeir R, et al. Laryngotracheal anomalies associated with esophageal atresia: importance of early diagnosis[J]. Eur Arch Otorhinolaryngol, 2018, 275(2): 477-481. DOI:10.1007/s00405-017-4856-5 |
| [13] |
Torre M, Carlucci M, Speggiorin S, et al. Aortopexy for the treatment of tracheomalacia in children: review of the literature[J]. Ital J Pediatr, 2012, 38: 62. DOI:10.1186/1824-7288-38-62 |
| [14] |
Dewberry L, Wine T, Prager J, et al. Thoracoscopic posterior tracheopexy is a feasible and effective treatment for tracheomalacia[J]. J Laparoendosc Adv Surg Tech A, 2019, 29(10): 1228-1231. DOI:10.1089/lap.2019.0156 |
| [15] |
Goyal V, Masters IB, Chang AB. Interventions for primary (intrinsic) tracheomalacia in children[J]. Cochrane Database Syst Rev, 2012, 10: CD005304. DOI:10.1002/14651858.CD005304.pub3 |
| [16] |
Bairdain S, Smithers CJ, Hamilton TE, et al. Direct tracheobronchopexy to correct airway collapse due to severe tracheobronchomalacia: short-term outcomes in a series of 20 patients[J]. J Pediatr Surg, 2015, 50(6): 972-977. DOI:10.1016/j.jpedsurg.2015.03.016 |
| [17] |
Tytgat SHAJ, Van Herwaarden-Lindeboom MYA, Van Tuyll Van Serooskerken ES, et al. Thoracoscopic posterior tracheopexy during primary esophageal atresia repair: a new approach to prevent tracheomalacia complications[J]. J Pediatr Surg, 2018, 53(7): 1420-1423. DOI:10.1016/j.jpedsurg.2018.04.024 |
 2022, Vol. 21
2022, Vol. 21


