肛门直肠畸形(anorectal malformation, ARM)是常见的小儿先天性缺陷之一。后矢状入路肛门直肠成形术(posterior sagittal anorectopasty, PSARP)被认为是ARM的标准术式。2000年后,腹腔镜辅助肛门直肠成形术(laparoscopy-assisted anorectoplasty, LAARP)逐渐成为治疗ARM合并直肠膀胱瘘、直肠尿道瘘的首选方法。传统观点认为,无论是PSARP还是LAARP,如果在结扎瘘管时处理不恰当,可能导致两种后果:第一,结扎处距尿道壁太近,导致尿道损伤、尿道狭窄;第二,结扎处距尿道壁太远,导致瘘管残留,出现原始瘘管残余(remnant of original fistula, ROOF)或后尿道憩室(posterior urethral diverticulum, PUD)。本研究旨在初步总结PUD诊治经验,并结合文献探讨PUD预防方法。
资料与方法 一、临床资料收集2013年8月至2018年12月郑州大学附属儿童医院新生儿外科6例行LAARP,且术后出现PUD的ARM患儿作为研究对象。6例患儿年龄(2.4±1.5)岁,体重(11.8±2.9)kg,临床表现以尿路感染和(或)排尿、排便困难为主。对6例患儿的辅助检查、手术情况及术后随访资料进行总结。病例纳入标准:①接受腹腔镜手术;②非二次手术。本研究经郑州大学附属儿童医院医学伦理委员会批准(2022-K-061)。
二、文献检索检索PubMed、SpringerLink、Google Scholar、中国生物医学文献数据库、中国知网、万方和维普数据库。由于国际上对PUD的命名尚不统一,主要有两种命名方式:remnant of original fistula和posterior urethral diverticulum,因此本研究确定检索关键词为:直肠肛门畸形(anorectal malformation)、原始瘘管残余(remnant of original fistula)、后尿道憩室(posterior urethral diverticulum)。本文检索了2000—2021年所有公开发表的ARM术后发生PUD的文献,排除重复报道以及对患儿临床资料无具体描述的文献,收集PUD患儿的确诊年龄、原始手术方式、PUD大小、ARM类型、PUD治疗方式、病理结果等资料,并进行整理、分析。
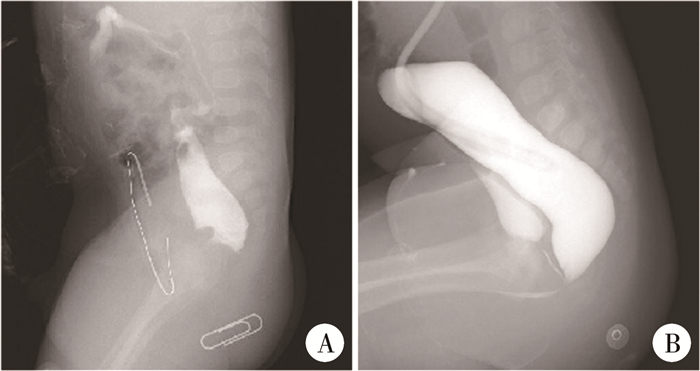
结果 一、6例PUD的治疗结局6例PUD中,3例表现为排黏液尿,尿液中黏液丝多,此3例中有2例尿液检查显示白细胞增多,合并尿路感染;2例表现为排尿困难,伴肛门、会阴部疼痛,排尿、排便时疼痛加重,肛门指检时于直肠前壁触及包块,CT、逆行尿道造影显示直肠前囊肿(图 1);1例表现为排尿不适感,尿液检查显示白细胞增多,彩超提示直肠前小囊肿,经口服抗菌药物后症状缓解。6例PUD确诊时间为接受LAARP后的17个月至5年。直肠尿道瘘患儿高压远端结肠造影结果见图 2。

|
图 1 1例后尿道憩室患儿的影像学表现 Fig.1 Imaging findings of PUD 注 A: 后尿道憩室的CT图像; B: 后尿道憩室的逆行尿道造影图像 |
|
图 2 1例直肠尿道瘘患儿高压远端结肠造影图像 Fig.2 High-pressure distal colonography in children with rectourethral fistula 注 A:造影结果显示压力不足、有粪块残留;B:造影结果显示压力充足、无粪块残留 |
共检索出13篇相关ARM术后出现PUD的文献(表 1),共102例患儿,确诊年龄1~44岁,PUD最小直径仅3 mm,最大直径达70 mm[1-13]。其中对ARM类型记录明确者45例,分别为:尿道球部瘘19例,前列腺部瘘22例,膀胱颈部瘘3例,无瘘1例。ARM手术方式记录明确者101例,其中LAARP 36例,PSARP 15例,经腹会阴拖出肛门直肠成形术(abdominoperineal pull-through anorectopasty, APP)50例。主要临床症状为尿频、排尿困难、反复泌尿系感染、尿路结石、血尿、尿失禁等,部分病例无任何临床症状及体征,仅在随访检查时偶然发现。对PUD直径较大、且有泌尿道症状者予以手术,其中超过50%的患儿手术时PUD直径已超过3 cm;手术方式包括PSARP、经腹会阴手术、经腹手术、经腹机器人手术等;切除组织经病理学检查提示多为结直肠黏膜或尿路上皮,2例有尿路结石形成,2例存在癌变组织。对PUD直径较小、无明显临床症状、不影响生活质量者选择动态观察的个体化治疗方案。
| 表 1 13篇相关ARM术后发生后尿道憩室的文献报道 Table 1 Summary of 13 cases of PUD reported in literature |
|
|
PUD是ARM术后一种较为隐蔽的并发症,发生率在2%左右[10]。Li等[14]报道单中心330例中高位ARM均采用LAARP,术后发现3例存在无症状PUD。而在Rentea等[15]的研究中,180例ARM患儿中有16例检出PUD,发生率为8.9%。我们认为出现这种差异的原因包括以下几点:一是对ARM患儿瘘管位置的诊断不确切;二是各中心通过LAARP处理直肠尿道瘘的技术方法不统一;三是PUD患儿的临床症状个体间差异较大,且PUD从发生到确诊的时间较长。结合本组病例手术经验及文献复习,我们认为,应当采取以下措施预防PUD的发生:第一,行直肠远端加压造影前应充分灌洗肠道,洗净残存粪块,以便准确识别瘘管位置;第二,手术开始前务必留置导尿管,作为术中辨认尿道的重要标志;第三,术中将瘘管尽可能贴尿道壁切除,不留残余。另外,术后应密切随访,及早发现可能存在的PUD,预防严重并发症的发生。
直肠远端加压造影是识别瘘管位置和直肠盲端定位的标准方法[16]。良好的直肠远端加压造影能够根据直肠与耻骨尾骨线的关系确定最佳手术入路。造影时压力不足、图像不佳或造影医师(技师)经验不足,可能导致瘘管位置的识别错误,进而错误引导外科医生做出不合适的手术决策。本组6例术前造影都存在一定程度的缺陷,导致对于畸形分类的判断出现偏差,客观上增加了PUD发生的可能。与横结肠造口相比,乙状结肠造口远端残存的胎便更容易洗净排出,造影时容易形成充足的压力。横结肠造口由于保留了更多的远端结肠,如果造口术后没有及时洗净和排出直肠末端遗留的胎便,则可能在瘘口附近形成粪块,导致造影时瘘口不显影或图片成像效果不佳。Uchida等[11]曾报道1例术前评估为无瘘的ARM患儿,该患儿行LAARP术后随访MRI时检出了PUD。对于横结肠造口,我们的经验是造影前3 d每日用生理盐水反复冲洗远端结肠,将残存的胎便洗净排出,造影时经远端造口置入带球囊的Foley导尿管,于降结肠处充起球囊,这样注入造影剂不容易反流,并形成较高的压力,清晰显示瘘管位置。
手术开始前留置导尿管对于ARM合并尿道瘘的手术及术后恢复很重要。首先,有助于排空膀胱内的尿液,在LAARP术中避免膀胱充盈导致手术视野受到影响;其次,可以作为手术中识别瘘管已经靠近尿道壁的标志;再次,如果意外损伤尿道壁,看到尿管暴露,可以及时发现并进行尿道修补。
关于LAARP中沿尿道壁平面精准切除并结扎瘘管这一操作,目前尚无相对客观、公认的方法,特别是存在直肠尿道球部瘘的情况下,这种操作更难。以往观点认为,在畸形位置较高的直肠膀胱颈/前列腺瘘中,由于直肠与膀胱/前列腺不共用一个壁,以“T”形方式连接,使用LAARP能有效进行瘘管结扎;而在畸形位置较低的直肠球部瘘中,直肠和尿道之间的共壁较长,试图在盆腔下方充分而精确地切断和(或)结扎瘘管,可能会损伤尿道或形成PUD[17]。我们处理尿道瘘的方法是:对于前列腺部/膀胱瘘采用LAARP,游离瘘管与尿道壁或膀胱壁接近垂直时进行结扎;对于尿道球部瘘采用改良PSARP,游离瘘管至球部尿道,以导尿管为标志贴近尿道壁结扎瘘管。但该方法受手术者主观感觉和技术经验的影响,无法作为客观标准。为避免上述并发症的发生,各医疗中心做了很多新的尝试,Srimurthy等[18]于2008年报道自直肠末端近端约1 cm处开始进行直肠浆膜下剥离,以形成远端直肠的黏膜管,持续牵引下向尿道解剖,然后将黏膜管结扎。Rollins等[19]则采用在直肠尿道瘘与尿道壁平齐的位置切开而不结扎的方法来预防PUD的发生,但强调沿尿道壁平齐切开,且保留导尿管直至无漏尿。Huang等[20]在PSARP中进行膀胱镜检查以确定尿道内瘘管的开口,并将带有校准的3Fr输尿管导管插入孔口以标记瘘管,在解剖过程中通过识别瘘管与尿道交界处的输尿管导管,就可以完整切除瘘管。Koga等[21]在LAARP中引入膀胱镜检查,将一根有刻度的细导管经直肠末端插入瘘管中,直到膀胱镜检查看到导管出现,然后测量从直肠末端解剖终点到尿道的距离,直到该距离小于5 mm时进行结扎;该团队应用此方法证实PUD的发生率明显降低[2]。Wang等[22]通过沿黏膜下层至尿道近端0.5 cm处进行远端瘘管剥离,黏膜剥离至远端最尖端与后尿道平齐后完全横切,剩余的0.5 cm肌袖用夹子或缝线结扎。
术后长期随访对于预防PUD的发生、发展有重要意义,很多患儿早期没有症状,或PUD直径仅几毫米,可行保守治疗。对于有症状的患儿,从ARM修复到PUD症状出现的时间为6个月至24年,在这期间可以使用排尿性膀胱尿道造影(voiding cystourethrography, VCUG)、MRI和(或)膀胱镜检查来确定PUD的存在,van der Zee等[7]更依赖VCUG而不是MRI,他们认为如果MRI检查期间尿道内压力不足,较小的PUD可能会被遗漏;而Rentea等[3]认为VCUG检测PUD不可靠,需要结合MRI和膀胱镜检查才能排除这种可能性。
需要注意的是,如果在尿道前列腺部囊肿,固然首先考虑为手术残留的瘘管引起,但仍要警惕前列腺囊的可能。另外,前列腺囊的临床症状与PUD近似,有些前列腺囊很小,早期没有症状;有些前列腺囊则很大,有反复感染、囊内结石、压迫尿道引起排尿困难的可能。但前列腺囊常伴发于尿道下裂,有文献报道小儿单纯前列腺囊发病率低,但在尿道下裂及性发育异常患儿中,发病率为10% ~14%;在重度尿道下裂患儿中,发病率可达50%以上,需要注意鉴别。
综上所述,PUD是ARM术后较为隐匿的并发症,通过加强围手术期管理、改进手术技术,可以降低发生PUD的潜在风险。术后应加强随访,对可疑病例进行仔细、全面的检查,以避免漏诊,错过治疗时机。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 潘登负责研究的设计、实施和起草文章;刘会锋、陈力、潘登进行病例数据收集及分析;王献良、邵雷朋负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
McShane EK, Gurland B, Sheth VR, et al. Adult residual rectourethral fistula and diverticulum presenting decades after imperforate anus repair: a case report[J]. J Med Case Rep, 2021, 15(1): 370. DOI:10.1186/s13256-021-02921-3 |
| [2] |
Fujiwara K, Ochi T, Koga H, et al. Lessons learned from lower urinary tract complications of anorectoplasty for imperforate anus with rectourethral/rectovesical fistula: laparoscopy-assisted versus posterior sagittal approaches[J]. J Pediatr Surg, 2021, 56(7): 1136-1140. DOI:10.1016/j.jpedsurg.2021.03.041 |
| [3] |
Rentea RM, Halleran DR, Vilanova-Sanchez A, et al. Diagnosis and management of a remnant of the original fistula (ROOF) in males following surgery for anorectal malformations[J]. J Pediatr Surg, 2019, 54(10): 1988-1992. DOI:10.1016/j.jpedsurg.2019.02.006 |
| [4] |
Yadav DK, Khanna K, Khanna V, et al. Enterolithiasis in posterior urethral diverticulum: an uncommon complication following surgery for anorectal malformation[J]. BMJ Case Rep, 2018, 2018: bcr2018226274. DOI:10.1136/bcr-2018-226274 |
| [5] |
Tainaka T, Uchida H, Tanaka Y, et al. Long-term outcomes and complications after laparoscopic-assisted anorectoplasty vs.posterior sagittal anorectoplasty for high- and intermediate-type anorectal malformation[J]. Pediatr Surg Int, 2018, 34(10): 1111-1115. DOI:10.1007/s00383-018-4323-4 |
| [6] |
Méndez-Gallart R, Rodríguez-Barca P, Estévez-Martínez E, et al. Urinary retention in an infant caused by a posterior urethral diverticulum lithiasis following surgery for anorectal malformation[J]. Urolithiasis, 2014, 42(2): 183-185. DOI:10.1007/s00240-014-0642-7 |
| [7] |
van der Zee DC, Dik P, Beek FJ. Laparoscopy-assisted anorectal pull-through in anorectal malformations: a reappraisal[J]. World J Surg, 2013, 37(8): 1934-1939. DOI:10.1007/s00268-013-2017-6 |
| [8] |
Podberesky DJ, Weaver NC, Anton CG, et al. MRI of acquired posterior urethral diverticulum following surgery for anorectal malformations[J]. Pediatr Radiol, 2011, 41(9): 1139-1145. DOI:10.1007/s00247-011-2072-9 |
| [9] |
Krickhahn A, Petersen C, Ure B. Transvesical resection of a mucocele after laparoscopically assisted anorectal pull-through for imperforate anus with rectobulbar urethral fistula[J]. J Pediatr Surg, 2011, 46(1): e29-e31. DOI:10.1016/j.jpedsurg.2010.09.048 |
| [10] |
Alam S, Lawal TA, Peña A, et al. Acquired posterior urethral diverticulum following surgery for anorectal malformations[J]. J Pediatr Surg, 2011, 46(6): 1231-1235. DOI:10.1016/j.jpedsurg.2011.03.061 |
| [11] |
Uchida H, Iwanaka T, Kitano Y, et al. Residual fistula after laparoscopically assisted anorectoplasty: is it a rare problem?[J]. J Pediatr Surg, 2009, 44(1): 278-281. DOI:10.1016/j.jpedsurg.2008.10.056 |
| [12] |
Koga H, Okazaki T, Yamataka A, et al. Posterior urethral diverticulum after laparoscopic-assisted repair of high-type anorectal malformation in a male patient: surgical treatment and prevention[J]. Pediatr Surg Int, 2005, 21(1): 58-60. DOI:10.1007/s00383-004-1265-9 |
| [13] |
Peña A, Hong AR, Midulla P, et al. Reoperative surgery for anorectal anomalies[J]. Semin Pediatr Surg, 2003, 12(2): 118-123. DOI:10.1016/s1055-8586(02)00022-7 |
| [14] |
Li L, Ren XH, Ming AX, et al. Laparoscopic surgical technique to enhance the management of anorectal malformations: 330 cases' experience in a single center[J]. Pediatr Surg Int, 2020, 36(3): 279-287. DOI:10.1007/s00383-019-04614-x |
| [15] |
Rentea RM, Halleran DR, Wood RJ, et al. The role of laparoscopy in anorectal malformations[J]. Eur J Pediatr Surg, 2020, 30(2): 156-163. DOI:10.1055/s-0040-1701700 |
| [16] |
Kraus SJ, Levitt MA, Peña A. Augmented-pressure distal colostogram: the most important diagnostic tool for planning definitive surgical repair of anorectal malformations in boys[J]. Pediatr Radiol, 2018, 48(2): 258-269. DOI:10.1007/s00247-017-3962-2 |
| [17] |
Bischoff A, Levitt MA, Peña A. Laparoscopy and its use in the repair of anorectal malformations[J]. J Pediatr Surg, 2011, 46(8): 1609-1617. DOI:10.1016/j.jpedsurg.2011.03.068 |
| [18] |
Srimurthy KR, Ramesh S, Shankar G, et al. Technical modifications of laparoscopically assisted anorectal pull-through for anorectal malformations[J]. J Laparoendosc Adv Surg Tech A, 2008, 18(2): 340-343. DOI:10.1089/lap.2006.0247 |
| [19] |
Rollins MD, Downey EC, Meyers RL, et al. Division of the fistula in laparoscopic-assisted repair of anorectal malformations-are clips or ties necessary?[J]. J Pediatr Surg, 2009, 44(1): 298-301. DOI:10.1016/j.jpedsurg.2008.10.032 |
| [20] |
Huang YC, Xu WJ, Xie H, et al. Cystoscopic-assisted excision of rectourethral fistulas in males with anorectal malformations[J]. J Pediatr Surg, 2015, 50(8): 1415-1417. DOI:10.1016/j.jpedsurg.2015.04.002 |
| [21] |
Koga H, Kato Y, Shimotakahara A, et al. Intraoperative measurement of rectourethral fistula: prevention of incomplete excision in male patients with high-/intermediate-type imperforate anus[J]. J Pediatr Surg, 2010, 45(2): 397-400. DOI:10.1016/j.jpedsurg.2009.10.085 |
| [22] |
Wang C, Diao M, Li L, et al. Laparoscopic dissection and division of distal fistula in boys with rectourethral fistula[J]. J Surg Res, 2017, 211: 147-153. DOI:10.1016/j.jss.2016.11.059 |
 2022, Vol. 21
2022, Vol. 21


