肝外门静脉梗阻(extra-hepatic portal venous obstruction, EHPVO)是引发小儿门静脉高压的重要原因之一,常因门静脉入肝血流受阻引发肝外门静脉高压,导致上消化道出血。动物实验研究发现,门静脉高压时门静脉系统处于低剪切力与高周向应力状态,与静脉曲张程度密切相关[1]。因Rex手术可重建门静脉入肝通道,在生理上恢复门静脉入肝血流,是当前治疗小儿EHPVO的有效手术方法。Rex手术能否逆转门静脉高压引发的门静脉系统低剪切力和高周向应力状态,进而实现防治门静脉高压并发症的目的,迄今未见研究报道。前期研究中,我们成功建立了可恢复性肝外门静脉梗阻动物模型模拟Rex手术治疗EHPVO[2]。本研究旨在利用该模型进一步探讨门静脉入肝血流通畅状态对门静脉血流动力学和血管病理的影响,明确Rex手术治疗EHPVO的血流动力学和病理学机制。
材料与方法 一、研究对象及分组于2018年1月至2021年1月选取18只4~5 kg雄性成年新西兰白兔作为研究对象,采用数字表随机分组的方法将其分为3组(每组6只):一组采用开腹后游离门静脉主干的方法,为对照(normal control, NC)组;一组采用套管将门静脉主干部分缩窄的方法,为肝外门静脉梗阻(extra-hepatic portal venous obstruction, EHPVO)组;一组采用在EHPVO模型制备14 d后将套管去除的方法,为可恢复性肝外门静脉梗阻(reversible extra-hepatic portal venous obstruction, r-EHPVO)组。该研究获得首都儿科研究所伦理委员会批准(伦理批号:KSDWLL2017004)。
二、模型的制作方法1. EHPVO组:术前禁食12 h,2%氯氨酮腹腔注射麻醉(200 mg/kg),取上腹正中切口2 cm进入腹腔,游离门静脉主干近左右支分支处。自制套管:剪一段输血器管,长约0.5 cm,剪裁至内径为门静脉主干直径的20%(使门静脉缩窄80%),用4-0外科缝线将套管两端固定。将套管置于游离好的门静脉主干外侧,收紧两端丝线,测量门静脉压力较缩窄前升高,并观察肠管10 min,无明显淤血后将收紧的丝线结扎。将肠道还入腹腔,逐层关闭腹腔。
2. r-EHPVO组:门静脉主干的缩窄方法与EHPVO组的操作过程一致;模型制作第14天时再次开腹暴露门静脉主干外侧的套管,将套管去除。
3. NC组:仅开腹后游离门静脉主干[2]。
三、数据收集 (一) 测量门静脉剪切力和周向应力NC组、EHPVO组及r-EHPVO组在模型制作第14天时(r-EHPVO组为去除套管前后)和模型制作第28天时,于门静脉主干处(EHPVO组和r-EHPVO组结扎部位的远肝门端)采用ALC-BFS多普勒血流测定系统(上海奥尔科特生物科技有限公司ALCBIO,ALC-BFS_TY7203)测量门静脉血流速度;采用游标卡尺测量血管直径;采用Mikro-Tip血压基础系统(AD Instruments,澳大利亚)测定门静脉压力。计算门静脉血管剪切力τ=4Q×η/π×r3[其中η为血黏度(Pa·s)、Q为血液流速(mL/s)、r为血管内半径(cm)]和门静脉血管周向应力T=ΔP×r/h[其中r为血管平均半径(cm),ΔP为管壁内外压强差(kPa),h为壁厚(cm)]。比较三组血管剪切力和周向应力的差异。
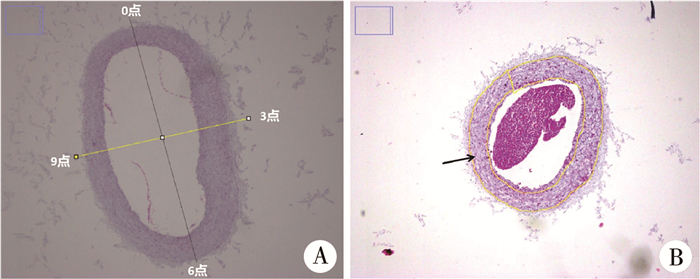
(二) 门静脉血管病理模型制作第28天时(r-EHPVO组为套管去除后第14天),取门静脉主干血管(EHPVO组和r-EHPVO组结扎部位的远肝门端)制作病理切片,行HE染色。通过显微镜拍照采集图像,采用图像分析软件Image J 1.53对血管壁的内膜和中膜厚度进行测量。测量方法如下(图 1A):在血管切片图像的0点、3点、6点和9点部位测量内膜和中膜的厚度,计算以上4个部位的平均值作为内膜和中膜的平均厚度,比较3组之间内膜和中膜厚度的差别。采用Image J 1.53测量血管壁内膜和中膜的面积。用自由选择工具(图 1B)将待测量区域选中,然后测量所选区域面积。计算内膜与中膜面积的比值(I/M)和内膜与内膜中膜面积之和的比值[I/(I+M)]。比较三组之间I/M、I/(I+M)的差异。
|
图 1 采用图像分析软件Image J 1.53对血管壁的内膜和中膜厚度及面积进行测量 Fig.1 Thickness and area of intima and media were measured by image analysis software Image J 1.53 注 A: 测量血管切片的0点、3点、6点和9点位置的内膜和中膜厚度,并计算其平均值作为内膜和中膜的厚度;B:采用自由选择工具选中待测区域,进行面积测量 |
采用SPSS13.0进行统计学分析。周向应力、剪切力等服从正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析(one-way ANOVA),同一组内不同时间段的数据比较采用配对t检验,剪切力与内膜厚度和周向应力与中膜厚度的相关性采用Pearson相关分析,以P < 0.05为差异有统计学意义。
结果 一、血管剪切力模型制作第14天时,EHPVO组和拆管前r-EHPVO组的血管剪切力显著低于NC组(P < 0.001);拆管后r-EHPVO组的血管剪切力与NC组差异无统计学意义(P=0.061);EHPVO组的剪切力与拆管前r-EHPVO组的差异无统计学意义(P=0.968),但显著低于拆管后的r-EHPVO组(P=0.016)。模型制作第28天时,EHPVO组血管剪切力显著低于NC组(P < 0.001);r-EHPVO组血管剪切力显著高于EHPVO组(P < 0.001);NC组的血管剪切力显著高于r-EHPVO组(P=0.009)。
模型制作第14天时,r-EHPVO组拆除套管后的血管剪切力显著高于拆除套管前(t=-7.068,P=0.001)。模型制作第28天时,r-EHPVO组血管剪切力显著高于第14天拆管前(t=-8.079,P < 0.001),与第14天拆管后差异无统计学意义(t=-1.112,P=0.317)。见表 1、图 2A。
| 表 1 3组实验新西兰白兔血管剪切力、周向应力的测定结果及差异(x±s) Table 1 Results of shear stress and circumferential stress in each group(x±s) |
|
|

|
图 2 3组实验新西兰白兔血管剪切力和周向应力 Fig.2 Results of shear and circumferential stresses in each group 注 A:3组在第14天和第28天时血管剪切力的变化及差异;B:3组在第14天和第28天时血管周向应力的变化及差异; NC组: 对照组;EHPVO组:肝外门静脉梗阻组;r-EHPVO组:可恢复性肝外门静脉梗阻组 |
模型制作第14天时,EHPVO组和拆管前后r-EHPVO组的周向应力显著高于NC组(P < 0.001);EHPVO组的周向应力与拆管前的r-EHPVO组差异无统计学意义(P=0.913),但显著高于拆管后的r-EHPVO组(P < 0.001)。模型制作第28天时,EHPVO组周向应力显著高于NC组(P < 0.001);r-EHPVO组周向应力显著低于EHPVO组(P < 0.001);NC组的周向应力显著低于r-EHPVO组(P=0.002)。
模型制作第14天时,r-EHPVO组拆除套管后的周向应力显著低于拆除套管前(t=7.746,P=0.001)。模型制作第28天时,r-EHPVO组周向应力显著低于模型制作第14天拆管前(t=7.373,P=0.001);与模型制作第14天拆管后差异无统计学意义(t=2.532,P=0.052)。见表 1、图 2B。
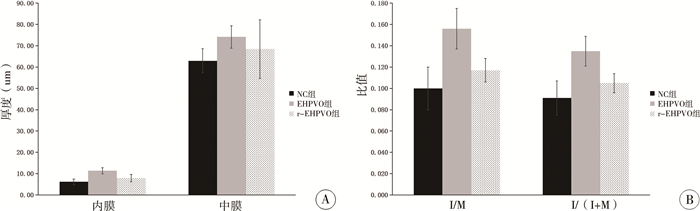
三、血管内膜和中膜EHPVO组的内膜厚度显著高于NC组和r-EHPVO组(P < 0.001)。NC组与r-EHPVO组的内膜厚度差异无统计学意义(P=0.071)。EHPVO组的中膜厚度与NC组差异无统计学意义(P=0.051)。NC组与r-EHPVO组的中膜厚度差异无统计学意义(P=0.313)。EHPVO组的中膜厚度与r-EHPVO组的差异无统计学意义(P=0.298)。EHPVO组的I/M显著高于NC组和r-EHPVO组(P < 0.001)。NC组与r-EHPVO组的I/M差异无统计学意义(P=0.104)。
EHPVO组的I/(I+M)显著高于NC组和r-EHPVO组(P < 0.001)。NC组与r-EHPVO组的I/(I+M)差异无统计学意义(P=0.089)。见表 2、图 3。
| 表 2 3组实验新西兰白兔血管内膜和中膜厚度、I/M及I/(I+M)比较(x±s) Table 2 Results of intima and media thickness, area of intima/area of media (I/M) and area of intima/sum area of intima and media [I/(I+M)] in each group(x±s) |
|
|
|
图 3 3组实验新西兰白兔血管内膜和中膜的变化 Fig.3 Differences of intima and media in each group 注 A:3组白兔内膜和中膜厚度对比;B:3组白兔的I/M(内膜与中膜面积比值)和I/(I+M)(内膜与内膜中膜面积之和的比值)对比;NC组: 对照组;EHPVO组:肝外门静脉梗阻组;r-EHPVO组:可恢复性肝外门静脉梗阻组 |
将血管内膜厚度与模型制作第28天时血管剪切力进行相关性分析,发现血管剪切力与血管内膜变化相关(r=-0.799,P < 0.001),见图 4A;将血管中膜厚度与模型制作第28天时血管周向应力进行相关性分析,发现血管周向应力与血管中膜变化相关(r=0.792,P < 0.001),见图 4B。

|
图 4 血流动力学变化与血管壁厚度的关系 Fig.4 Relationship between the changes of portal hemodynamics and portal venous thickness 注 A:血管剪切力与内膜厚度呈负相关(P < 0.001);B:血管周向应力与中膜厚度呈正相关(P < 0.001) |
在一定范围内,静脉有很强的扩张能力,并具有一定弹性,但当静脉扩张超过其生理范围时,其弹性和顺应性变差。自体静脉移植于动脉系统后,在动脉高压环境作用下,管腔将极度扩张,一方面造成高压下的机械损伤,另一方面由于扩张、顺应性下降使局部血流状态发生改变,激发管壁细胞功能的改变。在这些因素作用下血管壁将出现组织形态和功能上的变化,表现为移植血管新生内膜过度增厚、管壁僵硬、顺应性下降,且内膜增生随术后时间的延长而加重,最终导致移植血管管腔狭窄[3-4]。肝外门静脉高压时,门静脉系统静脉也处于高压环境的作用下,血管壁是否也发生上述组织形态和功能上的变化,迄今未见研究报道。动物实验研究发现,将Lewis大鼠下腔静脉移植到腹主动脉后,移植静脉的内膜/中膜面积随时间的延长而显著增加;再把静脉片断植入静脉系统中,8周内移植静脉的内膜/中膜面积显著下降[5]。本研究发现,EHPVO组的I/M显著高于NC组,可能是因为EHPVO组的门静脉压力明显高于NC组,此时门静脉血管处于较高的压力下。而r-EHPVO组的I/M显著低于EHPVO组,可能是因为r-EHPVO组的门静脉压力较EHPVO组降低,与上述将静脉片断植入静脉系统后内膜/中膜面积下降的情况相似。此外本研究发现,EHPVO组的内膜厚度和I/(I+M)显著高于NC组,由此表明EHPVO组的门静脉血管内膜明显增厚。
二、血流动力学对血管壁变化的影响血流动力学因素与移植静脉内膜增生关系密切,内膜增生及管壁的增厚可视为在血流动力学改变后移植静脉产生的动脉化适应过程[6-7]。剪切力和周向应力是两个评价血流动力学变化的重要指标。剪切力是指血流与血管内皮间的摩擦力,受血液特性、血流速度和血管形态影响。周向应力是沿管壁横断面切线方向的应力,受管壁内外压差的影响。一般认为,内膜增厚和低流速(剪切力的决定因素)相关。Caro等[8]研究大动脉弯曲部位的剪切力时,发现血管壁外侧的剪切力较高,而血管壁内侧的剪切力较低,动脉粥样硬化损伤则发生于剪切力较低的血管壁内侧,因此提出引发血管内壁粥样硬化的“低剪切力学说”。Ojha等[9]研究表明低剪切力及流动分离很可能引发内膜增生。Giddens等[10]认为, 剪切力小于5 dyne/cm2是诱导动脉搭桥术后远期内膜增生形成的一个重要原因。本研究发现,血管剪切力与内膜厚度呈负相关,表明门静脉高压的低剪切力可能引发EHPVO的门静脉血管内膜增厚。剪切力的改变可以诱导内皮细胞表达血小板衍生生长因子(platelet derived growth factor, PDGF)、成纤维细胞生长因子(fibroblast growth factor, FGF)和一氧化氮合酶(nitric oxide synthase, NOS)等多种细胞因子。血流剪切力突然减小,导致PDGF-mRNA和蛋白质的表达增加,而PDGF和FGF可引发血管内膜增生[11-13]。
除剪切力之外,周向应力是促进移植静脉管壁增生(主要是中膜增生)的一个因素,其变化引起血管内皮细胞纵向和横向排列的改变,调节离子通道和蛋白激酶的活性,与剪切力协同作用使张力纤维伸长、增粗。此外,周向应力调节内皮素Ⅰ、前列腺素Ⅱ、一氧化碳的合成与释放,促进血管平滑肌细胞的迁移与增殖。周向应力的变化还可引起细胞间黏附分子-1和血管细胞粘附因子-1浓度的变化,使白细胞在内皮上牢固黏附。纤维蛋白原与细胞间黏附分子-1结合,对血流动力学的改变作出反应,调控、介导血管松弛及平滑肌细胞增生。本研究发现,血管周向应力与中膜厚度呈正相关,表明周向应力可能是影响血管中膜厚度的重要因素。但EHPVO组与NC组的中膜厚度差异无统计学意义,EHPVO组的I/(I+M)显著高于NC组,表明EHPVO组的血管壁增厚以内膜增厚为主。
三、EHPVO下血流动力学的变化门静脉压力由门静脉系统血流、肝内血管阻力和肝静脉流出道阻力共同作用而产生。血流受阻会对门静脉血管产生反作用力,引发门静脉血管内压力升高。门静脉高压状态下,门静脉系统血管所受的各种应力出现变化,将不可避免地引发血流动力学改变。门静脉高压时门静脉系统处于低剪切力与高周向应力状态,这可能是门静脉高压症并发症发生的力学基础。本研究发现,EHPVO组血管剪切力显著低于NC组,周向应力显著高于NC组。剪切力与流量呈正相关,与半径呈负相关。实际剪切力是增加还是降低,取决于管径和流量增加的比例。EHPVO组的门静脉主干被部分结扎,门静脉入肝血流受阻可导致血流量降低以及门静脉管径增粗,因此EHPVO组白兔血管剪切力显著低于NC组。
四、恢复入肝血流对血流动力学和血管壁变化的影响Rex手术因可重建门静脉入肝血流,生理上恢复门静脉肝脏血供,成为当前治疗小儿EHPVO的最佳手术方法。但其能否在血流动力学方面逆转门静脉高压的低剪切力和高周向应力状态,尚不得而知。在既往研究中,我们成功采用可恢复性肝外门静脉高压兔模型模拟Rex手术治疗EHPVO[2]。在本研究中,我们利用该动物模型研究Rex手术对门静脉血流动力学的影响。研究发现,模型制作第28d时r-EHPVO组血管剪切力明显高于EHPVO组和14d拆管前的r-EHPVO组;但仍低于NC组。模型制作第28天时r-EHPVO组周向应力显著低于EHPVO组和模型制作第14天拆管前的r-EHPVO组,但仍高于NC组。由此表明,恢复门静脉入肝血流可以逆转门静脉高压的低剪切力和高周向应力状态,但仍与正常组存在差异。尽管Rex手术分流血管通畅,但部分患儿术后仍存在食管胃底静脉曲张和脾肿大,可能与门静脉高压引发的低剪切力与高周向应力未完全缓解有关[14-15]。通过对血管内膜和中膜厚度的变化研究发现,r-EHPVO组的内膜厚度、I/M和I/(I+M)显著低于EHPVO组,与NC组无差异;r-EHPVO组的中膜厚度与EHPVO组和NC组均无差异。由此表明,恢复门静脉入肝血流有利于逆转门静脉高压存在的门静脉血管内膜增厚现象。
综上所述,门静脉通畅情况与血流动力学变化明显相关,门静脉梗阻可导致门静脉血管剪切力减少、周向应力增大,进而引发血管内膜增厚。恢复门静脉血流有利于改善该状态。血流动力学变化与血管内膜厚度密切相关。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为张金山, 论文调查设计为张金山, 数据收集与分析为张金山、李龙, 论文结果撰写为张金山, 论文讨论分析为张金山
| [1] |
张宗棨, 汤松伟, 朱樑, 等. 肝前型门静脉高压兔门脉系统血管应力的研究[J]. 生物医学工程学杂志, 2008, 25(6): 1322-1326. Zhang ZQ, Tang SW, Zhu L, et al. Study of portal system vascular stress in a rabbit model of pre-hepatic portal hypertension[J]. Journal of Biomedical Engineering, 2008, 25(6): 1322-1326. DOI:10.3321/j.issn:1001-5515.2008.06.019 |
| [2] |
张金山, 李龙. 可恢复性肝外门静脉高压动物模型的建立及其实验研究[J]. 中华小儿外科杂志, 2021, 42(3): 252-257. Zhang JS, Li L. Establishment of a reversible animal model of extra-hepatic portal hypertension and experimental study[J]. Chinese Journal of Pediatric Surgery, 2021, 42(3): 252-257. DOI:10.3760/cma.j.cn421158-20191229-00715 |
| [3] |
Owens CD, Wake N, Jacot JG, et al. Early biomechanical changes in lower extremity vein grafts-distinct temporal phases of remodeling and wall stiffness[J]. J Vasc Surg, 2006, 44(4): 740-746. DOI:10.1016/j.jvs.2006.06.005 |
| [4] |
Turner NA, Ho S, Warburton P, et al. Smooth muscle cells cultured from human saphenous vein exhibit increased proliferation, invasion, and mitogen-activated protein kinase activation in vitro compared with paired internal mammary artery cells[J]. J Vasc Surg, 2007, 45(5): 1022-1028. DOI:10.1016/j.jvs.2007.01.061 |
| [5] |
Sterpetti AV, Cucina A, Lepidi S, et al. Progression and regression of myointimal hyperplasia in experimental vein grafts depends on platelet-derived growth factor and basic fibroblastic growth factor production[J]. J Vasc Surg, 1996, 23(4): 568-575. DOI:10.1016/s0741-5214(96)80034-6 |
| [6] |
Wu J, Zhang C. Neointimal hyperplasia, vein graft remodeling, and long-term patency[J]. Am J Physiol Heart Circ Physiol, 2009, 297(4): H1194-H1195. DOI:10.1152/ajpheart.00703.2009 |
| [7] |
Berceli SA, Tran-Son-Tay R, Garbey M, et al. Hemodynamically driven vein graft remodeling: a systems biology approach[J]. Vascular, 2009, 17(Suppl 1): S2-S9. DOI:10.2310/6670.2008.00083 |
| [8] |
Caro CG, Pedley TJ, Schroter RC, et al. The Mechanics of Circulation[J]. Oxford University Press, 1978. DOI: 10.1115/1.3138216.
|
| [9] |
Ojha M. Wall shear stress temporal gradient and anastomotic intimal hyperplasia[J]. Circ Res, 1994, 74(6): 1227-1231. DOI:10.1161/01.res.74.6.1227 |
| [10] |
Giddens DP, Zarins CK, Glagov S. The role of fluid mechanics in the localization and detection of atherosclerosis[J]. J Biomech Eng, 1993, 115(4B): 588-594. DOI:10.1115/1.2895545 |
| [11] |
Randone B, Sterpetti AV, Stipa F, et al. Growth factors and myointimal hyperplasia in experimental aortic allografts[J]. Eur J Vasc Endovasc Surg, 1997, 13(1): 66-71. DOI:10.1016/s1078-5884(97)80053-6 |
| [12] |
Sterpetti AV, Cucina A, Randone B, et al. Basic fibroblast growth factor and myointimal hyperplasia after experimental polytetrafluoroethylene arterial grafting[J]. Eur J Surg, 1999, 165(8): 772-776. DOI:10.1080/11024159950189564 |
| [13] |
Sterpetti AV, Cucina A, Randone B, et al. Increased production of cytokines and growth factors by aortic allografts: A possible explanation for myointimal hyperplasia formation[J]. Eur Surg Res, 1999, 31(4): 297-304. DOI:10.1159/000008706 |
| [14] |
Zhang JS, Li L, Cheng W. The optimal procedure of modified Rex shunt for the treatment of extrahepatic portal hypertension in children[J]. J Vasc Surg Venous Lymphat Disord, 2017, 5(6): 805-809. DOI:10.1016/j.jvsv.2017.02.011 |
| [15] |
张金山, 李龙, 李颀, 等. 移植血管间置、门静脉主干-门静脉肝内左支分流术在治疗小儿肝外门静脉高压中的应用[J]. 中华小儿外科杂志, 2016, 37(9): 682-686. Zhang JS, Li L, Li Qi, et al. Managing extra-hepatic portal obstruction through extra-hepatic portal vein-left intrahepatic portal shunting with interposition of bypass vein in children[J]. Chin J Pediatr Surg, 2016, 37(9): 682-686. DOI:10.3760/cma.j.issn.0253-3006.2016.09.010 |
 2022, Vol. 21
2022, Vol. 21


