2. 上海市儿童医院,上海交通大学医学院附属儿童医院神经外科,上海 200062
2. Department of Neurosurgery, Shanghai Children's Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200062, China
脑性瘫痪(cerebral palsy, CP)发病率约1/500,表现为复杂多样的姿势和感觉运动功能障碍,其中痉挛型脑瘫约占80%[1]。选择性脊神经后根离断术(selective dorsal rhizotomy, SDR)是目前公认的能有效缓解肌群痉挛(特别是双下肢肌群肌张力异常增高)的手术方案[2]。近年来临床上逐渐开展的单椎板入路SDR手术(single-level laminectomy for selective dorsal rhizotomy, SL-SDR)以其创伤小、术后脊柱侧弯等并发症少,成为目前被许多医院采纳的手术方案[3]。由于此类手术必须依赖术中神经电生理监测的研判来完成神经前、后根的区分以及目标神经后根的离断[4]。因此对麻醉深度的维持有较高的要求,既要避免麻醉过浅,患儿产生体动、发生肌电干扰,影响神经电生理指标的研判;又要防止麻醉过深、麻醉药物对感觉和运动神经根电活动传导的影响。脑电双频指数(bispectral index,BIS)作为一种实时麻醉深度监测工具,在临床麻醉中的应用日益广泛[5]。为探索BIS监测在SL-SDR术中的应用价值以及对手术中患儿安全的临床意义,本研究收集上海市儿童医院实施SL-SDR的相关临床数据,对神经电生理监测期间发生肌电干扰的风险因素进行分析和探讨。
材料与方法 一、临床资料收集自2019年3月至2022年3月期间在上海市儿童医院确诊为痉挛型脑瘫,并全程在BIS监测下行SL-SDR的患儿临床资料。患儿SL-SDR围手术期流程为:入手术室后连接常规心电图、无创血压、脉搏血氧饱和度以及BIS探头监测。麻醉诱导药物为咪达唑仑、舒芬太尼、阿托品、丙泊酚和罗库溴铵或顺式阿曲库铵。气管插管后麻醉维持使用吸入麻醉或静脉吸入复合麻醉。患儿改为俯卧位后,由神经电生理技师完成相关监测操作。手术开始后停用肌松药并逐渐以静脉麻醉为主。术中麻醉用药:七氟烷最低肺泡气有效浓度(minimum alveolar concentration, MAC)恒定保持在0.5,静脉麻醉药物微量泵泵注维持麻醉,静脉麻醉用药方案包括:丙泊酚+瑞芬太尼、右美托咪定+瑞芬太尼、丙泊酚+瑞芬太尼+右美托咪定。静脉麻醉药物用量的调整以麻醉深度监测指标BIS目标值40~60为依据。术中神经电生理监测提示肌电干扰影响手术进程时,予以追加静脉麻醉药物直至肌电干扰消失后继续手术。术中体温保持在36℃~37℃。术毕拔除气管插管,连接镇痛泵,入麻醉复苏室监护。
二、研究方法根据患儿病史、手术操作记录、麻醉记录单、BIS监测仪采集数据,汇总患儿一般资料、静脉麻醉维持方案及药物剂量、神经根阈值比(感觉根阈值/运动根阈值)、神经电生理监测期间BIS数值、标记肌电干扰的发生时间。从BIS监测仪(BIS EEG VISTA, Covidien LLC, USA)中导出每分钟BIS数值进行统计分析。根据术中是否发生肌电干扰(自由描记肌电图状态下,有两个及以上监测通道的肌电波幅≥50 μV),将研究对象分为肌电干扰组(D组)和无肌电干扰组(N组)。D组中收集自神经电生理刺激开始至首次出现肌电干扰期间所有BIS值,N组中收集自神经电生理刺激开始至刺激结束期间的所有BIS值。
三、统计学处理采用SPSS22.0进行统计学分析。正态分布或近似正态分布的计量资料以x±s表示,符合正态分布的两样本独立变量采用两样本独立t检验;不符合正态分布计量资料采用M(Q1, Q3)表示,采用Mann-Whitney非参数检验;计数资料以例数及百分比表示,采用Fisher精确概率法进行统计分析;风险因素分析采用二元Logistic分析,首先将可能的风险因素进行单独检验,将P<0.1的风险因素进行多因素分析;利用受试者操作特征曲线(receiver operating characteristic curve, ROC)曲线和约登指数(Yuden index, YI)最大法制定判断界值。P<0.05说明差异具有统计学意义。
结果 一、基本情况本研究共纳入43例SL-SDR手术。患儿年龄为5.3(4.8,8.2)岁;其中男性34例(34/43, 79.1%),女性9例(9/43, 20.9%);四肢瘫患儿9例(9/43, 20.9%)、双下肢瘫32例(32/43, 74.4%)、偏瘫2例(2/43, 4.7%);粗大运动功能分级(gross motor function classification system, GMFCS) 为Ⅰ级3例(3/43, 7.0%),Ⅱ级13例(13/43, 30.2%),Ⅲ级19例(19/43, 44.2%),Ⅳ级8例(8/43, 18.6%);神经电生理监测期间麻醉维持使用丙泊酚联合瑞芬太尼方案为主,共35例(35/43,81.4%)。
二、肌电干扰情况术中出现肌电干扰影响手术进程的病例有22例(51.2%,D组),未出现肌电干扰的病例为21例(48.8%,N组)。两组患儿在年龄、体重、脑瘫类型、运动功能障碍严重程度和所采用的麻醉方案以及电生理监测起始阶段感觉根/运动根的阈值比等方面比较,差异均无统计学意义(P>0.05)。D组中从神经电生理刺激开始至首次出现肌电干扰的时间为(39.0±24.0)min,BIS值为53.4±7.2;而N组中从神经电生理刺激开始到所有神经根探测结束的BIS均值为46.1±9.4,D组BIS值均值明显高于N组(P=0.007)。单因素回归分析显示只有两组间GMFCS及BIS均值的P值<0.1,其他所有参数的P值均>0.4(表 1)。
| 表 1 SL-SDR患儿临床特点及Logistic单因素回归分析 Table 1 Clinical features of patients with SL-SDR and Logistic univariate regression analysis |
|
|
多因素Logistic回归分析发现,GMFCS分级的每个亚型与肌电干扰的发生并无明显相关性。在神经电生理监测期间患儿的BIS值是影响肌电干扰发生的独立风险因素,其OR值为1.154,95%可信区间1.035~1.287(表 2)。
| 表 2 SL-SDR术中肌电干扰的多因素Logistic回归分析 Table 2 Multivariate Logistic regression analysis of electromyographic disturbance during SL-SDR |
|
|
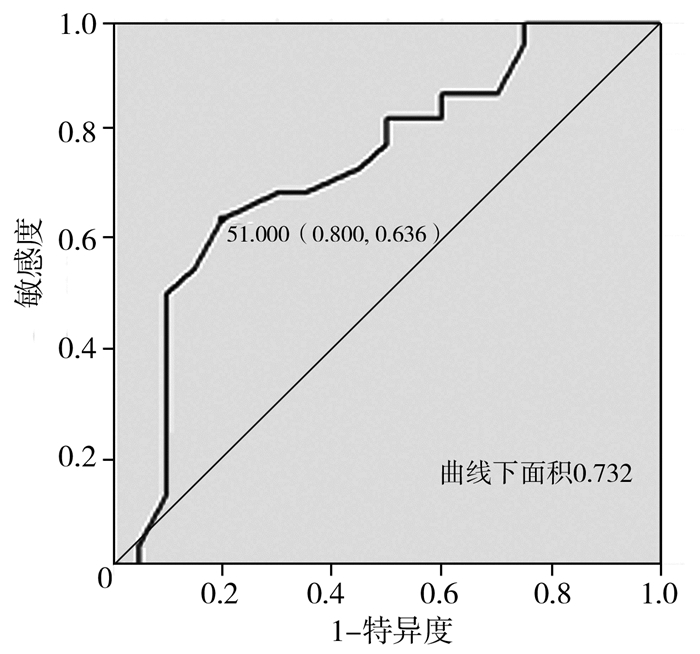
由于BIS值是影响肌电干扰发生的独立风险因素,通过ROC分析,可推算出BIS的临界值,图 1可见ROC曲线下面积为0.732,P=0.01,95%可信区间为0.575~0.889,预测效能中等。ROC制定判断界值,采用YI最大法,经计算最大YI=0.436,对应的BIS值为51,拟BIS值≥51作为预测术中神经电生理监测时易发生肌电干扰的指标(图 1)。
|
图 1 痉挛型脑瘫患儿脑电双频指数值提示肌电干扰情况的受试者特征曲线 Fig.1 ROC curve of BIS values and electromyographic disturbance |
近二十年来,随着神经电生理监测技术在神经外科手术中的开展,相应的术中麻醉技术及麻醉深度监测方案逐渐成熟[6-10]。BIS监测作为一种常用的实时麻醉深度监测工具,是反映麻醉深度的一个客观指标,在临床上应用广泛[5, 11]。Kim等[12]的研究表明,正常儿童和脑性瘫痪患儿在七氟烷麻醉诱导过程中的BIS值无差异。本研究也将BIS监测作为麻醉深度监测工具用于日常麻醉中,尤其应用于对麻醉深度要求较高的手术。与成人相同,小儿BIS值维持在40~60是比较适合的麻醉深度[6]。Jung等[13]学者在痉挛型脑性瘫痪患儿行肉毒素注射治疗中进行深度镇静,发现BIS值与镇静评分结果高度相关,且推算出痉挛型脑性瘫痪患儿充分深度镇静时BIS临界值为61.5。国内有学者提出在选择性脊神经后根部分切断术中,神经电生理刺激时平均BIS值为65,指出BIS值维持在60~75时,不会影响神经电生理监测,但电刺激时患儿易发生体动反应[14]。本研究发现BIS值≥51容易发生肌电干扰,影响手术进程。BIS值低于上述研究的原因可能和目前SL-SDR术中诱发肌电的准确判读对肌电稳定环境要求更高有关。
本研究中患儿在神经电生理监测期间BIS值均维持在40~60[5]。虽然麻醉方案及剂量无显著性差异,但可能因不同患儿脑发育的差异,对麻醉药物敏感性的不同,表现出不同的麻醉深度,术中出现肌电干扰的患儿BIS值普遍高于无肌电干扰的患儿,D组BIS值为53.4±7.2,而N组BIS值为46.1±9.4。且在出现肌电干扰前,BIS值会出现明显升高或波动,提示麻醉深度相对不足。在出现肌电干扰的患儿中,从神经电生理监测开始到首次出现肌电干扰之间的时间为(39.0±24.0)min,而BIS值明显升高后多长时间会出现肌电干扰仍需进一步观察研究。
本研究对SL-SDR术中影响神经电生理监测稳定性的众多相关因素进行分析发现,BIS值是影响该手术中神经电生理稳定性的独立风险因素。在本研究中,自神经电生理监测开始,当BIS值>51时,后续出现肌电干扰、影响手术进程的发生率为73.7%,而BIS值稳定在51以下时发生率为32%。这一结果提示SL-SDR术中神经电生理监测操作对于术中脊髓神经网络稳定性的影响大,对麻醉深度的控制要求高。
有文献提出在SDR手术中根据神经根阈值比(感觉根阈值/运动根阈值)来判断麻醉深度,最佳阈值比应在51~100,而10~50为临界区间,需再次评估麻醉深度[15]。本研究中两组患儿阈值比无显著差异,虽然BIS值维持在60以下,但多数患儿阈值比在50以下,提示麻醉深度对于神经电生理监测强度相对不足,由于麻醉深度不足,可能会导致刺激感觉根后出现过度肌电活动,且肌电活动时间延长[6]。在麻醉方案维持恒定时,BIS值不仅可以反映镇静状态的程度,还可反映阿片类药物对伤害性刺激反应的抑制程度,若BIS对伤害性刺激的反应突然增加,可能是皮质唤醒反应,提示可能存在镇痛不足的情况,且BIS值的改变可提早于血流动力学的变化[16-17]。本研究中发现随着神经电生理探测对神经根反复电刺激、离断和牵拉操作的变化,BIS值会出现一过性升高或下降,伴或不伴有血流动力学的变化,常需追加静脉麻醉药物来维持目标BIS值。
1992年有学者提出在SDR术中持续泵注丙泊酚不合适,可能与刺激时肌肉痉挛相关,也可能由于丙泊酚减弱了吸入麻醉药的肌松作用[18],而近年在SDR术中使用的麻醉维持药物包括丙泊酚、瑞芬太尼、右美托咪定、异氟烷(MAC值为0.7~0.8)、七氟烷(MAC值为0.5)、氧化亚氮[6-10]。本研究中瑞芬太尼于术中维持的平均剂量与Konya等学者在SDR手术的麻醉研究中相似,研究提出0.6%七氟烷联合50%笑气以及瑞芬太尼(0.25 μg·kg-1·min-1) 的麻醉维持方案,对预防术中过度肌电活动的效果优于0.5%异氟烷联合50%氧化亚氮与瑞芬太尼的方案[10]。本研究中出现肌电干扰后,均追加静脉麻醉药物,首选丙泊酚推注,多数患儿肌电干扰可快速停止,若无好转再根据血流动力学的变化适当追加瑞芬太尼或舒芬太尼。Rehberg和Duch[19]的研究证明,丙泊酚的临床药物浓度可阻止钠通道钠离子的内流,这可能解释了丙泊酚是如何阻止肌电干扰的。
本研究作为回顾性研究,存在着一定局限。首先病例数偏少导致亚组分析受限;其次,本研究重点关注了SL-SDR手术中BIS值的优化上限,对下限的范围没有进行探讨。但按目前文献报道,BIS值不低于40可提供良好的神经电生理敏感性[5, 15]。最后,由于痉挛型脑性瘫痪患儿配合能力有限,本研究中部分研究对象在麻醉诱导前无法完成BIS监测,对其BIS值变动情况无法做出标准化校准[16-17]。但本研究中所有患儿未出现BIS值持续异常偏低或偏高,且所有患儿拔除气管插管时BIS值均大于70,与已有的研究结果相似,因此我们认为缺乏诱导前BIS值的测定对本研究的结果影响不大[5]。
综上所述,在痉挛型脑性瘫痪患儿SL-SDR手术中,BIS监测可以作为一种可靠的实时监测麻醉深度、并指导术中麻醉管理的有效工具,术中神经电生理监测期间的BIS值是发生肌电干扰的独立风险因素。BIS值≥51可作为预测发生肌电干扰的指标来指导麻醉用药,以减少术中肌电干扰的发生,保证SL-SDR手术安全、顺利地完成。但关于设定SL-SDR这类特定手术中BIS值的最优范围还需后续更大样本的研究来实现。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为王国庆,论文研究方法为王国庆、刘珺珺,数据收集与分析为王国庆、王君璐、蒋文彬,论文结果撰写为王国庆,论文讨论分析为王国庆、刘珺珺
| [1] |
Pao LP, Zhu L, Tariq S, et al. Reducing opioid usage: a pilot study comparing postoperative selective dorsal rhizotomy protocols[J]. J Neurosurg Pediatr, 2019, 1-6. DOI:10.3171/2019.9.PEDS19398 |
| [2] |
Park TS, Gaffney PE, Kaufman BA, et al. Selective lumbosacral dorsal rhizotomy immediately caudal to the conus medullaris for cerebral palsy spasticity[J]. Neurosurgery, 1993, 33(5): 929-934. DOI:10.1227/00006123-199311000-00026 |
| [3] |
Zhan Q, Yu X, Jiang W, et al. Whether the newly modified rhizotomy protocol is applicable to guide single-level approach SDR to treat spastic quadriplegia and diplegia in pediatric patients with cerebral palsy?[J]. Childs Nerv Syst, 2020, 36(9): 1935-1943. DOI:10.1007/s00381-019-04368-w |
| [4] |
Xiao B, Constatntini S, Browd SR, et al. The role of intra-operative neuroelectrophysiological monitoring in single-level approach selective dorsal rhizotomy[J]. Childs Nerv Syst, 2020, 36(9): 1925-1933. DOI:10.1007/s00381-019-04408-5 |
| [5] |
Avidan MS, Zhang L, Burnside BA, et al. Anesthesia awareness and the bispectral index[J]. N Engl J Med, 2008, 358(11): 1097-1108. DOI:10.1056/NEJMoa0707361 |
| [6] |
Bales J, Apkon S, Osorio M, et al. Infra-Conus Single-Level Laminectomy for Selective Dorsal Rhizotomy: Technical Advance[J]. Pediatr Neurosurg, 2016, 51(6): 284-291. DOI:10.1159/000448046 |
| [7] |
Martinez V, Browd S, Osorio M, et al. Electrophysiology of sensory and motor nerve root fibers in selective dorsal rhizotomies[J]. Pediatr Neurosurg, 2020, 55(1): 17-25. DOI:10.1159/000502326 |
| [8] |
Fukuhara T, Nakatsu D, Namba Y, et al. Histological evidence of intraoperative monitoring efficacy in selective dorsal rhizotomy[J]. Childs Nerv Syst, 2011, 27(9): 1453-1458. DOI:10.1007/s00381-011-1462-5 |
| [9] |
Jeffery S, Markia B, Pople IK, et al. Surgical outcomes of single-level bilateral selective dorsal rhizotomy for spastic diplegia in 150 consecutive patients[J]. World Neurosurg, 2019, 125: e60-e66. DOI:10.1016/j.wneu.2018.12.187 |
| [10] |
Konya D, Gercek A, Dagcinar A, et al. Prevention of brisk hyperactive response during selective dorsal rhizotomy in children with spasticity: isoflurane versus sevoflurane maintenance anesthesia[J]. J Clin Neurosci, 2009, 16(2): 241-245. DOI:10.1016/j.jocn.2008.02.007 |
| [11] |
Oliveira CR, Bernardo WM, Nunes VM. Benefit of general anesthesia monitored by bispectral index compared with monitoring guided only by clinical parameters.Systematic review and meta-analysis[J]. Braz J Anesthesiol, 2017, 67(1): 72-84. DOI:10.1016/j.bjane.2015.09.001 |
| [12] |
Kim NY, Lee IO, Lim BG, et al. Comparison of bispectral index (BIS) and entropy in patients with cerebral palsy during sevoflurane induction[J]. Korean J Anesthesiol, 2009, 57(4): 422-427. DOI:10.4097/kjae.2009.57.4.422 |
| [13] |
Jung SM, Lee E, Park SJ. Validity of bispectral index monitoring during deep sedation in children with spastic cerebral palsy undergoing injection of botulinum toxin[J]. Korean J Anesthesiol, 2019, 72(6): 592-598. DOI:10.4097/kja.19129 |
| [14] |
李京生, 田肇隆. 右美托咪定用于小儿脑瘫选择性脊神经后根切断术麻醉的研究[J]. 临床小儿外科杂志, 2014, 13(3): 246-249. Li JS, Tian ZL. Use of dexmedetomidine on children with cerebral palsy during selective dorsal root rhizotomy[J]. J Clin Ped Sur, 2014, 13(3): 246-249. DOI:10.3969/j.issn.1671-6353.2014.03.023 |
| [15] |
Aatif MH. A practical approach to neurophysiologic intraoperative monitoring[M]. New York: Demos, 2008: 169-180.
|
| [16] |
Dahaba AA. Different conditions that could result in the bispectral index indicating an incorrect hypnotic state[J]. Anesth Analg, 2005, 101(3): 765-773. DOI:10.1213/01.ane.0000167269.62966.af |
| [17] |
Duarte LT, Saraiva RA. When the bispectral index (BIS) can give false results[J]. Rev Bras Anestesiol, 2009, 59(1): 99-109. DOI:10.1590/s0034-70942009000100013 |
| [18] |
Riegle EV, Gunter JB, Lagueruela RG, et al. Anesthesia for selective dorsal rhizotomy in children[J]. J Neurosurg Anesthesiol, 1992, 4(3): 182-187. DOI:10.1097/00008506-199207000-00006 |
| [19] |
Rehberg B, Duch DS. Suppression of central nervous system sodium channels by propofol[J]. Anesthesiology, 1999, 91(2): 512-520. DOI:10.1097/00000542-199908000-00026 |
 2022, Vol. 21
2022, Vol. 21


