2. 上海市儿童医院,上海交通大学医学院附属儿童医院神经外科,上海 200062
2. Department of Neurosurgery, Shanghai Children's Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200062, China
椎管内占位性疾病是指发生在脊髓、硬脊膜及神经根等部位的一系列占位性病变的统称[1]。这类疾病患儿往往会有肢体运动、感觉及大小便功能障碍等表现。椎管内占位性疾病在儿童神经外科疾病谱中并不罕见,病理类型主要有脂肪瘤、囊肿及肿瘤等[2]。椎管内占位性疾病的主要治疗方式是手术。但由于病变临近神经结构或直接位于神经组织内,容易造成神经功能损伤,故术中神经功能的保护尤为重要。由于术中神经电生理监测能实时动态监测神经传导性,近年来在椎管内手术中的应用日益广泛[3]。婴幼儿神经髓鞘化尚处于动态发育过程中,目前对于婴幼儿术中神经电生理监测的研究尚不多。本研究回顾性分析湖南省儿童医院近3年实施的椎管内占位性疾病手术患儿神经电生理监测资料,探讨不同年龄段患儿椎管内占位性疾病手术中神经电生理监测的适用性及有效性。
材料与方法 一、临床资料回顾性分析2019年1月至2022年4月湖南省儿童医院神经外科收治的75例接受椎管内占位性疾病手术治疗患儿的临床资料,其中男40例,女35例;手术时平均年龄3.7岁(1个月至13岁9个月);病变位于颈段5例,胸段3例,腰骶段67例。病例纳入标准:①MRI明确为椎管内占位性疾病,需要进一步手术治疗;②术中使用神经电生理监测,监测方案为:经颅电刺激运动诱发电位(transcranial electrical motor evoked potential, TCeMEP)、躯体感觉诱发电位(somatosensory evoked potential, SSEP)、和肌电图(electromyogram, EMG)。排除标准:①具有神经电生理监测禁忌证[3];②经过2次以上手术;③术前有明显肢体运动功能障碍影响诱发基线的建立。本研究经湖南省儿童医院伦理委员会批准(HCHLL—2022—67),家属均签署知情同意书。
二、麻醉方法麻醉诱导常规使用咪达唑仑0.1 mg/kg,舒芬太尼0.5 μg/kg,顺式阿曲库铵0.15 mg/kg,丙泊酚2~5 mg(或环泊酚0.4~1.0 mg/kg)。使用瑞芬太尼0.1~1.0 μg·kg-1·h-1(或环泊酚1~2 mg·kg-1·h-1)持续泵入维持麻醉。术中根据脑电双频指数(bispectralindex,BIS)值调节丙泊酚(或环泊酚)的用量。
三、手术方式患儿术中均采取俯卧位,打开椎板后的操作均在显微镜下进行。所有神经累及部位的手术操作均在神经电生理监测指导下完成。
四、电生理监测方法均采用美敦力32导NIM-Eclipse进行术中神经电生理监测。根据术中神经电生理监测协议,手术前记录一次TCeMEP和SSEP的信号,若术中需追加麻醉,则记录追加麻醉药物的种类、时间、剂量,在硬脊膜打开时建立基线,作为术中参考。手术全程实时监控EMG,必要时使用激发肌电图(Triggered EMG),以明确手术切除范围。
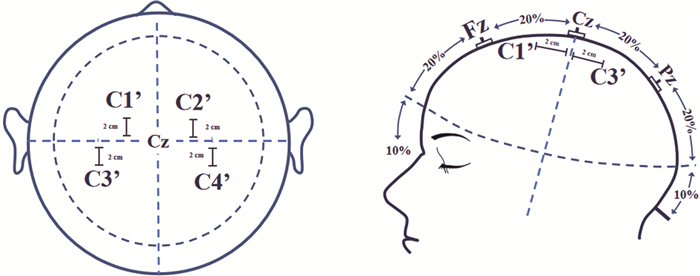
(一) TCeMEPTCeMEP通过电刺激大脑运动皮质,引发外周神经及肌肉的反应来了解运动下行传导功能。将波幅下降50%作为预警标准。根据国际10—20系统(图 1)刺激极C1′~C2′左右互为参考电极。根据手术节段选择不同的肌肉记录电极。颈椎手术选择斜方肌、三角肌、肱二头肌、拇短展肌、小指展肌为记录肌群;胸、腰、骶椎手术选择股四头肌、颈前肌、腓肠肌、肛门括约肌为记录肌群。均采用恒压电刺激,用5~7个串脉冲刺激,刺激强度100~400 V,刺激间歇时间2 ms。
|
图 1 国际10—20系统示意图 Fig.1 Schematic diagram of International 10/20 |
SSEP通过电刺激四肢外周神经末梢段(腕部正中神经或尺神经、内踝部胫后神经),引发感觉冲动,经脊髓上传至大脑,以了解感觉上行传导功能。将反应波幅降低>50%和(或)潜伏期延长>10%作为预警标准。上肢的刺激极位于腕横纹正中以上约2 cm,下肢的刺激极位于跟腱与内踝之间,参考级位于远端,相距2 cm。按照国际10—20系统(International 10—20 System)(图 1)上肢记录极位于C3′、C4′,下肢记录极位于Cz′,参考电极位于Fz。均采用恒流式电刺激方式,波宽0.2 ms、频率2.7~5.4 Hz,刺激强度15~30 mA;带通滤波范围30~500 Hz,重复信号平均100~200次。颈段手术主要监测上肢的SSEP,胸腰段手术主要监测双下肢体感诱发电位。
(三) EMG和Triggered-EMG通过记录肌肉活动情况了解支配肌肉的神经功能状态。将出现爆发肌电活动或连续发生的肌电活动作为预警标准。Triggered-EMG是通过电刺激脊髓神经根使得该神经根支配的肌肉收缩,以明确神经根的节段,同时判断是否为神经根或失活神经根。选择神经根对应的肌肉作为记录电极。EMG滤波范围为30~3 000 Hz,灵敏度为50~100 μV;Triggered-EMG刺激频率为3.1 Hz,刺激电量(0.01~3 mA)。
(四) 术中SSEP及TCeMEP基线的建立本研究将手术开始阶段有两个及以上病变对应监测通道出现可辨识的诱发电位,定义为诱发电位基线建立。
五、统计学处理采用SPSS 18.0进行统计学分析。对于符合正态分布的计量资料采用x±s表示;对于计数资料的多组资料(R×C资料)采用卡方检验分析组间差异是否具有统计学意义,P<0.05为差异有统计学意义。
结果 一、治疗结果75例患儿术后病理检查结果:脂肪瘤48例,囊肿14例,血管畸形3例,神经母细胞瘤2例,皮样囊肿2例,黏液乳头状瘤2例,神经鞘瘤2例,脊膜瘤1例,尤文氏肉瘤1例。患儿术后随访时间为2周。75例患儿中,4例出现肢体肌力明显降低、活动障碍等,经对症处理后症状逐步缓解。
二、术中诱发电位基线建立情况术中神经电生理监测数据显示,75例患儿中,成功建立TCeMEP基线57例(57/75,76.0%),建立SSEP基线34例(34/75,45.3%)。1岁以下组、1~3岁组及3岁以上组TCeMEP基线建立成功率分别为59.4%(19/32)、84.6%(11/13)及90.0%(27/30),SSEP基线建立成功率分别为21.9%(7/32)、53.9%(7/13)及66.7%(20/30)。
年龄>3岁组不论SSEP还是MEP的基线建立均高于1岁以下组及1~3岁组的基线建立(P<0.05),不同年龄段患儿诱发电位基线建立情况见表 2。
| 表 2 不同年龄段椎管内占位性疾病患儿术中诱发电位基线建立情况(例) Table 2 Intraoperative evoked potential baseline establishment in children with intraspinal space-occupying disease at different ages (n) |
|
|
在成功建立TCeMEP基线的57例患儿中,术中出现运动诱发电位波幅异常9例(9/57,15.7%);在成功建立SSEP基线的34例患儿中,术中指标出现波动9例(9/34,26.4%)。其中1例与中心静脉压降低相关,2例与麻醉相关,6例与术中操作相关。
出现TCeMEP及SSEP波幅异常至手术结束尚未完全恢复的4例患儿,术后均出现对应肌群一过性肌力下降、局部肢体麻木和疼痛等表现,经激素、营养神经等治疗,2周后症状逐渐缓解。出现TCeMEP及SSEP波幅一过性异常的2例患儿同时出现EMG爆发肌电,经温盐水局部冲洗、暂停手术操作及改变手术策略等针对性处理后,波幅很快恢复至基线。2例术中TCeMEP及SSEP波幅异常与麻醉药物剂量变化有关,经调整药物剂量后诱发电位均恢复正常。1例与中心静脉压降低有关,输血后波幅恢复至基线。
四、典型病例L4~S1段脂肪瘤型脊髓栓系患儿,双下肢活动可,无肢体麻木及疼痛不适。术前基线建立:SSEP右上肢因桡动脉置管使SSEP波幅未引出,其余肢体波幅良好,在0.5MAC时TCeMEP波幅可引出。术中在分离脂肪瘤时,由于神经根与脂肪瘤包绕,术中行脂肪瘤切除时出现了爆发肌电反应,右侧TCeMEP波幅降低至消失,同一时间SSEP右下肢波幅逐步降低至消失,手术结束后波幅未恢复(图 2),术后予激素、营养神经及对症支持治疗,术后2周症状明显缓解。

|
图 2 1例L4~S1段脂肪瘤型脊髓栓系患儿手术前后SSEPs和TCeMEP波形图 Fig.2 Preoperative and postoperative graphs of SSEPs and TCeMEP in a child with L4-S1 tethered cord |
C2~C6段血管畸形患儿在手术病灶处理、压迫止血过程中,出现TCeMEP波幅下降80%、SSEP下降50%。麻醉医生观察到此时患儿血压明显偏低、血气提示血红蛋白为65 g/L,即予快速补液及输血,后SSEP基本恢复,TCeMEP较前明显好转。术后患儿无不适(图 3)。

|
图 3 1例C2~C6血管畸形患儿手术前后TCeMEPs波形图 Fig.3 Preoperative and postoperative graphs of TCeMEPs in a child with C2~C6 vascular malformation |
术中神经电生理监测是对手术中机体电生理信号进行监测的技术,该技术能够为手术医生提供有效及可靠信息,使医生能从功能上了解患儿神经系统是否受到损害,进而客观判断术中神经功能的完整性,使得手术更加安全、顺利[4]。近年来,随着监测设备的更新及技术的发展,术中神经电生理监测技术已逐步成为保护神经功能不可或缺的一部分,虽然该技术在成人神经外科得到广泛应用,但国内在儿童疾病中的应用报道较少[5]。因此,本研究探讨术中神经电生理监测在儿童椎管内占位性疾病中的应用。
一、诱发电位基线建立不同年龄段小儿诱发肌电的建立情况不同。由于小儿神经发育不完善,电传导过程易受干扰,传导波幅不稳定,年龄越小所受影响因素越多。本研究发现,年龄越大基线建立成功率越高,TCeMEP基线建立在1岁以下组、1~3岁组及3岁以上组患儿中的成功率分别为59.4%、84.6%及90.0%,SSEP基线建立在1岁以下组、1~3岁组及3岁以上组患儿中的成功率分别为21.9%、53.9%及66.7%,这与国外学者认为的波幅的稳定性会随着儿童年龄的增长而增强这一观点一致[6]。本研究年龄分组组间差异显著,符合统计学分组标准,数据具有效性。在1岁以下组中,TCeMEP和SSEP的基线建立都不甚理想,我们认为这与婴儿期运动、感觉系统发育不完善相关,故在1岁以内患儿中应用该监测技术的有效性需进一步验证。在1~3岁组中,TCeMEP基线建立的成功率已接近85%,但能顺利诱发SSEP的成功率仅53.9%,基于此,我们认为幼儿时期神经髓鞘处于动态发育过程,随着幼儿精细运动及大运动的发育,TCeMEP及SSEP的建立成功率较1岁以内婴儿明显提高,但3岁以内患儿诱发肌电的基线建立成功率仍远低于成人(成人TCeMEP及SSEP基线建立成功率分别为93.6%、100%),这是由于婴儿和蹒跚学步的幼儿神经系统发育尚不成熟,如髓鞘形成不完全、传导速度慢以及皮质脊髓束和α运动神经元之间的单突触连接少等[7-8]。当患儿年龄大于3岁时,无论是TCeMEP还是SSEP,基线建立的成功率较之前都有所提高。本研究的年龄分组并不一定是最佳年龄分组,在实际监测过程中还需要考虑个体差异性以及疾病的具体性。
本研究数据显示,儿童TCeMEP基线的建立情况优于SSEP,但在成人中SSEP的基线往往更稳定[9]。我们认为出现这种情况的原因大致是:第一,儿童尚处在生长发育中,TCeMEP及SSEP传导通路均发育不完全,且运动传导电突触接头的数目较感觉传导少,神经传导速度快[10];第二,儿童颅骨薄,TCeMEP的刺激更容易激活皮层下运动神经;第三,SSEP在儿童中应用更容易受到麻醉的影响[11]。
二、本研究监测结果的影响因素建立手术基线后,术中根据TCeMEP和SSEP的信号波幅变化及EMG爆发肌电反应,可提醒手术者尽早发现和辨明由于手术造成的神经损害,并迅速纠正引起损害的原因,避免永久性神经损伤。
本研究中,基线建立后有15例患儿在处理病变过程中EMG出现爆发肌电及持续肌电反应,其中仅有4例术中出现TCeMEP及SSEP波幅异常,术后出现相应的运动、感觉功能变化。我们认为EMG出现爆发肌电及持续肌电反应,可能是正常生理反应,如术中麻醉不足导致肌肉紧张或牵拉肌肉引起的伪差[12];但也可能是病理反应,如神经紧张性活动(对神经元的刺激或损伤),因此,术中需综合TCeMEP及SSEP,分析患儿术中状态[13]。随着仪器设备的更新,目前我们已构建起多模态的监测模式,允许几种模式之间相互切换、相互比较,并在某一模式波幅发生变化时,为手术者提供其他模式下神经状态的参考,以判断神经是否受损,降低假阳性率。
本研究阳性病例中,有1例C2~C6段血管畸形患儿在处理手术病灶、压迫止血过程中,TCeMEP波幅下降80%、SSEP下降50%,麻醉医生同时观察到患儿血压及血红蛋白仅65 g/L,表明TCeMEP及SSEP的信号变化早于仪器设备监测到的生命体征变化,因此,电生理监测也能给麻醉医师提供反馈[14]。本组有2例患儿术中TCeMEP及SSEP波幅异常与麻醉药物剂量变化有关,经调整药物后TCeMEP及SSEP的波幅均完全恢复。因此,作为一个合格的电生理医生,术中需要加强与麻醉医师的沟通,并记录术中对波幅产生影响的因素(如脑脊液释放、麻醉药物的添加等)。同时对于波幅的变化,需要系统审视患儿的变量(血压、温度等)、麻醉的深度以及手术技术的影响[15]。
综上所述,神经电生理技术在儿童椎管内占位性病变手术中应用,是一种有效的方式。3岁以上患儿TCeMEP和SSEP的术中监测均相对稳定,术中神经电生理监测能对神经结构的早期损伤发挥预警作用;对于3岁以下(特别是1岁以内)的患儿,虽然SSEP的基线建立率不高,但TCeMEP基线建立率较高,监测指标的变化能及时发现手术操作造成的神经组织损伤,进而通过合理调整手术操作,达到减少神经功能不可逆损害的目的。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为蒋文彬、伍添,论文调查设计为苏君、李浩,数据收集为伍添,论文结果撰写为蒋文彬、伍添,论文讨论分析为伍添、苏君、李浩、蒋文彬、吴水华
| [1] |
刘世平, 袁方, 许学军, 等. 椎管内占位性病变ICD-10编码案例分析[J]. 中国病案, 2020, 21(7): 35-37. Liu SP, Yuan F, Xu XJ, et al. Cases Analysis on ICD-10 coding of intra-spinal occupying lesions[J]. Chinese Medical Record, 2020, 21(7): 35-37. DOI:10.3969/j.issn.1672-2566.2020.07.014 |
| [2] |
Howick J, Cohen BA, McCulloch P, et al. Foundations for evidence-based intraoperative neurophysiological monitoring[J]. Clin Neurophysiol, 2016, 127(1): 81-90. DOI:10.1016/j.clinph.2015.05.033 |
| [3] |
中国医师协会神经外科分会神经电生理监测专家委员会. 中国神经外科术中电生理监测规范(2017版)[J]. 中华医学杂志, 2018, 98(17): 1283-1293. Expert Committee of Neurophysiology Monitoring, Branch of Neurosurgery, Chinese Medical Doctor Association. 2017 Chinese Standard of Intraoperative Neurophysiological Monitoring during Neurosurgery[J]. National Medical Journal of China, 2018, 98(17): 1283-1293. DOI:10.3760/cma.j.issn.0376-2491.2018.17.002 |
| [4] |
Møller AR, Ansari S, Cohen-Gadol AA. Techniques of intraoperative monitoring for spinal cord function: their past, present, and future directions[J]. Neurol Res, 2011, 33(4): 363-370. DOI:10.1179/016164110X12807570510130 |
| [5] |
Cofano F, Zenga F, Mammi M, et al. Intraoperative neurophysiological monitoring during spinal surgery: technical review in open and minimally invasive approaches[J]. Neurosurg Rev, 2019, 42(2): 297-307. DOI:10.1007/s10143-017-0939-4 |
| [6] |
Nuwer MR. Intraoperative monitoring of neural function[J]. Handbook of Clinical Neurophysiology, 2008, 128-140. |
| [7] |
陈艺, 叶劲, 林志雄, 等. 多模式神经电生理监测在椎管内占位手术中的应用[J]. 中国临床解剖学杂志, 2017, 35(3): 331-335. Chen Y, Ye J, Lin ZX, et al. Multiple intraoperative monitoring of neuroelectrophysiology during operation for intraspinal occupying lesion[J]. Chinese Journal of Clinical Anatomy, 2017, 35(3): 331-335. DOI:10.13418/j.issn.1001-165x.2017.03.020 |
| [8] |
MacDonald DB. Overview on criteria for MEP monitoring[J]. J Clin Neurophysiol, 2017, 34(1): 4-11. DOI:10.1097/WNP.0000000000000302 |
| [9] |
陆南, 陈超, 高干, 等. 术中体感诱发电位监测在椎管内肿瘤手术中的预测价值[J]. 中国矫形外科杂志, 2018, 26(7): 619-621. Lu N, Chen C, Gao G, et al. Predictive value of intraoperative somatosensory evoked potential monitoring in spinal cord tumor surgery[J]. Orthopedic Journal of China, 2018, 26(7): 619-621. DOI:10.3977/j.issn.1005-8478.2018.07.09 |
| [10] |
Galloway GM, Zamel K. Neurophysiologic intraoperative monitoring in pediatrics[J]. Pediatr Neurol, 2011, 44(3): 161-170. DOI:10.1016/j.pediatrneurol.2010.11.008 |
| [11] |
Nagarajan L, Ghosh S, Dillon D, et al. Intraoperative neurophysiology monitoring in scoliosis surgery in children[J]. Clin Neurophysiol Pract, 2019, 4: 11-17. DOI:10.1016/j.cnp.2018.12.002 |
| [12] |
Barzilai O, Roth J, Korn A, et al. The value of multimodality intraoperative neurophysiological monitoring in treating pediatric Chiari malformation type Ⅰ[J]. Acta Neurochir (Wien), 2016, 158(2): 335-340. DOI:10.1007/s00701-015-2664-5 |
| [13] |
Bidkar PU, Thakkar A, Manohar N, et al. Intraoperative neurophysiological monitoring in paediatric neurosurgery[J]. Int J Clin Pract, 2021, 75(8): e14160. DOI:10.1111/ijcp.14160 |
| [14] |
Sala F, Krzan MJ, Deletis V. Intraoperative neurophysiological monitoring in pediatric neurosurgery: why, when, how?[J]. Childs Nerv Syst, 2002, 18(6-7): 264-287. DOI:10.1007/s00381-002-0582-3 |
| [15] |
Busso VO, McAuliffe JJ. Intraoperative neurophysiological monitoring in pediatric neurosurgery[J]. Paediatr Anaesth, 2014, 24(7): 690-697. DOI:10.1111/pan.12431 |
 2022, Vol. 21
2022, Vol. 21


