脑性瘫痪(简称脑瘫)的发病率约为0.26%,其中痉挛型脑瘫约占2/3[1]。肢体及躯干肌肉的持续痉挛是造成痉挛型脑瘫患儿运动功能发育障碍的重要原因。如何及时、有效且持久地降低患儿痉挛肌群异常增高的肌张力,改善其运动功能,一直是临床医生面临的难题。早在1889年,英国神经生理学先驱C.S.Sherrington就发现离断去大脑强直动物模型(猫)的脊神经后根,能显著改善受累肌群肌肉痉挛的现象。美国著名的神经外科医生Harvey Cushing于1908—1912年间尝试应用这一手术治疗了3例痉挛疼痛患者。1913年,德国的神经外科医生Otfrid Foerster正式发表了采用脊神经后根离断术治疗的大宗病例报告[2]。二十世纪六七十年代以后,随着对脑瘫病理机制研究的深入,临床研究人员逐渐认识到痉挛型脑瘫患儿肌张力异常增高的原因主要是由于大脑受损后,下行传导束无法传递足够的抑制信号,导致脊髓前角的α运动神经元兴奋- 抑制失去平衡所造成。而手术离断脊髓感觉后根能在一定程度上抑制其兴奋性,从而达到降低肌张力、改善痉挛状态的目的。但由于不同脊神经后根传入信号在脊髓不同节段的α运动神经元兴奋- 抑制失衡中所占权重不同,因而在数十枚神经根内准确找到权重较大的感觉根便成了临床亟待解决的问题。
一、脊神经后根离断术神经根的“选择”和脊神经诱发肌电Otfrid Foerster除了是第一位大宗报道经脊神经后根离断病例效果评估的研究者外,也是第一位使用术中诱发肌电来鉴别脊髓运动前根和感觉后根的临床医生。脊髓运动根和感觉根诱发肌电刺激阈值的巨大差异为术中有效避免运动前根损伤提供了极具操作性的方案。
无论是早期的脊髓段入路,还是二十世纪七八十年代美国神经外科医生Warwick Peacock在南非开普敦开始尝试的脊髓马尾段入路,脊神经后根离断术对于需处理感觉后根的选择基本依据人类神经皮节分布的特点,即术中需先找到痉挛肌群感觉对应的脊髓传入神经后根,再根据术前制定的方案,以不同比例离断这些神经纤维。只是相对于脊髓段入路的操作,直接暴露第2腰椎至第2骶椎脊髓马尾神经在各个节段出孔的方法,神经根节段的判断更为直观准确。同时,由于术中避免了脊髓的直接暴露,马尾段入路方案大大减少了手术相关并发症[3]。与此同时,意大利的VA Fasano医生在前人动物实验研究的基础上,首次提出了应用串刺激实时鉴别容易诱发痉挛的脊髓感觉传入神经根的方法。为在神经皮节节段性分布初筛基础上神经后根选择的进一步优化,提供了一个具有操作性的神经诱发肌电判读方案;该方案重点关注神经后根串刺激后对应肌群诱发肌电的模式[4];如渐强型和强直型肌电反应就被定义为“异常”(图 1),需在术中予以处理。自此选择性神经后根离断术(selective dorsal rhizotomy, SDR)的手术框架开始逐渐成形。
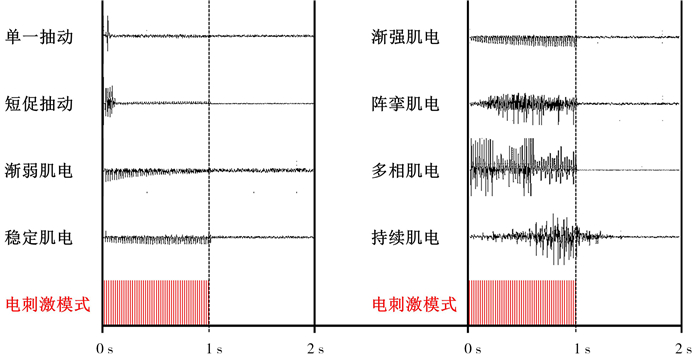
|
图 1 脑瘫患儿神经后根串刺激(50 Hz,1 s)后的诱发肌电模式 Fig.1 Patterns of EMG discharges from nerve rootlets when a 50-Hz train stimulus was applied for 1s (pulse duration 0.2 ms) 注 左侧四类为“正常”;右侧四类为“异常” |
此后十多年间,又有不少类似神经后根选择的优化方案被国外学者提出,其中一个被广泛应用的判读方案是“阈值法”[5-6]。其基本出发点是低阈值脊髓神经后根在诱发痉挛状态中的权重更大。因此手术时,在神经皮节对应的多枚神经后根中,通常只处理电刺激阈值较低的部分。当时的术中神经电生理诱发肌电判读方案制定出发点,是为了在神经皮节分布初筛基础上对神经后根做出进一步的精准化选择,以减少盲目离断带来的并发症,特别是术后的感觉及括约肌功能障碍。
这一情况在二十世纪九十年代初,美国韩裔神经外科医生ParkTS提出肌电图(electromyogram, EMG)肌电反应分级体系后开始变得有所不同[7]。这个分级方案把串刺激后的肌电反应依其扩布范围分为五级(表 1)。只有当分级为3+或4+时,才符合离断标准。这一诱发肌电分级方案无需参照神经皮节的分布情况,就能有很好的“选择性”。按EMG肌电反应分级体系操作的SDR手术,对于累及双下肢的痉挛型脑瘫患儿神经后根的选择具有很强的操作性,术后患儿痉挛状态获得明显改善[8]。
| 表 1 EMG肌电反应分级 Table 1 Grading system of EMG response |
|
|
2015年,美国的Sameul Browd医生团队提出了一个在EMG肌电反应分级体系(串刺激诱发肌电)基础上再叠加单刺激诱发肌电(compound muscle action potential, CMAP)判读的方案,应用该方案的SDR手术能同时适用于偏瘫及单瘫患儿。但由于该方案增加了新的纳入标准,神经根的离断率(满足离断标准的神经后根数/所有与双下肢相关的神经后根总数)有所增加[9]。3年后肖波团队正式发表了单纯依赖单刺激诱发CMAP模式来指导术中神经后根选择的SDR大宗病例研究报告(图 2)[10-12]。诱发肌电CMAP神经根“选择”方案能在维持较低神经后根离断率的基础上,对所有累及下肢的痉挛型脑瘫患儿术中神经根的选择提供很强的操作性。SDR术中常用的诱发肌电方案见表 2。
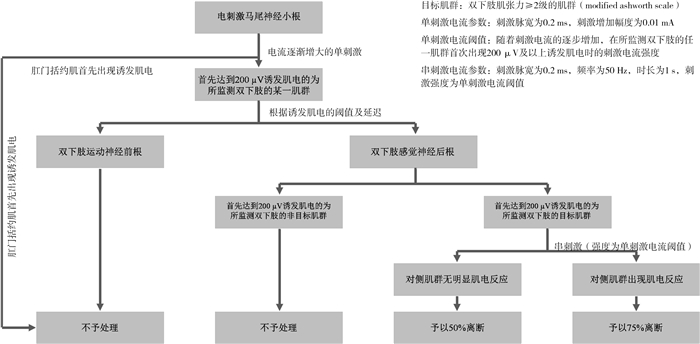
|
图 2 单刺激诱发肌电CMAP方案应用于SDR术中的神经根选择流程图 Fig.2 Scheme of modified rhizotomy protocol as proposed by Xiao & Zhan 注 CMAP: 单刺激诱发肌电;SDR:选择性神经后根离断术 |
| 表 2 SDR术中神经电生理监测判读方案汇总 Table 2 Summary of intra-operative EMG intraoperative |
|
|
为避免因体温变化导致肌肉神经电生理反应,术中患儿的核心体温需维持在36.0℃~36.5℃;麻醉过程中应尽量避免使用肌松药物,特别是神经根开始刺激前的1小时内及整个神经根探测期间;术中最低肺泡气有效浓度(minimum alveolar concentration, MAC)需尽可能稳定在0.5以下;术中麻醉深度需维持在一个稳定的水平(若采用BIS值监测,则可通过调整静脉麻醉药物剂量的方法,使其基本稳定在40~50左右);术中若出现两个及以上监测通道自由描计肌电(Free Run)波幅>50 μV,需及时增加静脉麻醉药物的剂量,以免影响后续诱发肌电判读的准确性。
(二) 监测肌群的选择由于担心术中误判造成括约肌功能损伤,目前几乎所有SDR手术医生都会在术中对肛门括约肌进行神经电生理监测。下肢肌群的监测范围往往涵盖股内收肌、股直肌、腘绳肌、股内侧肌、股外侧肌、胫前肌、腓肠肌内外侧头、腓骨长短肌等影响下肢大关节活动的肌群[3-4, 7, 9-10]。不同医疗中心在具体病例的手术操作过程中,对下肢监测肌群的选择可能会有所不同。但总体而言,考虑到诱发肌电判读时的简洁及准确,目前普遍认为监测肌群的数量并不是越多越好。
(三) 刺激参数的设定自Fasano医生在脊神经后根离断术中采用脊神经串刺激“选择”神经后根以来的四十多年里,大部分的刺激参数几乎没有发生过大的变动:单相波,刺激脉宽基本维持在1 ms以内,刺激频率为30 Hz或50 Hz,刺激时长一般为1 s。近年来变化较大的是刺激方式[13]。早期基本采用定压刺激模式,即刺激强度采用电压输入方式。随着对神经电生理特性研究的深入,目前定流刺激(constant current)即以输入电流大小作为刺激强度的方式,有逐渐取代定压刺激的趋势。早先的串刺激强度设定往往采用的是逐渐增强的电刺激(电压/电流),直到某一刺激强度下能观察到下肢肌群有明显抽动或电生理监测通道出现可辨别的诱发肌电。由于反复增强的串刺激非常容易造成相应肌群疲劳,导致由这一刺激方式诱发的肌电可重复性不强。目前一般先使用逐渐增强的单刺激来定义该神经根的串刺激强度,逐步增加刺激电流(0.01~0.10 mA),刺激间期为0.5~1.0 s,直到某一电流强度能诱发任一监测通道达到某一波幅的诱发肌电为止,然后再使用该电流强度作为该神经根串刺激时的电流输入值。
三、SDR术中诱发肌电判读对神经根“选择”的影响由于Fasano串刺激诱发肌电方案及单刺激阈值选择方案都需依赖神经皮节分布进行神经后根的初筛,在同一患儿神经根的“选择”上即便存在有差异,也由于范围已被限定,区别可能并不显著[4-6]。主要的差别可能来自不同医疗机构手术中串刺激强度不同,以及术前对患儿神经根离断比例的预设存在差异。
EMG肌电反应分级方案由于采用的是串刺激诱发肌电模式,对轻症患儿(术前GMFCS分级1~2级),特别是仅累及一侧下肢的痉挛型脑瘫患儿术中神经根的选择不甚理想。有研究表明,采用该方案指导轻症患儿SDR手术时,可能会有15%~30%的病例无法完成术中对神经后根的“选择”。尽管Browd医生通过增加单刺激诱发CMAP判读的方法解决了EMG肌电反应分级在这个方面的短板,但这一“选择”叠加却增加了20%~25%的神经后根离断率[14]。而仅依赖单刺激诱发肌电CMAP来做神经后根初筛的方法,能同时兼顾前两个方案的优点,即在维持较低神经后根离断率的同时,能对所有累及下肢的痉挛型脑瘫患儿SDR术中神经后根的“选择”有较好的操作性。有研究显示,由于上述三种判读协议采用的刺激模式不甚相同,对神经后根的最终选择也存在差异[10]。在中、重度患儿中,采用串刺激的EMG肌电反应分级方案和单刺激诱发肌电CMAP方案,神经后根“选择”的重合度为50%~60%,而在轻症患儿(特别是术前GMFCS分级为1级的患儿)中不到40%。
EMG肌电反应分级方案把短时间内连续注入电刺激后能激活脊髓前角α运动神经元的节段数量,作为区分该感觉后根在下肢痉挛状态表现中所起作用大小的判定标准;认为串刺激后诱发肌电扩布范围越广泛,作用越大;而单刺激诱发肌电方案的出发点是通过在神经后根注入逐渐增加的短脉宽电流,观察最小能量输入情况下最先或最主要兴奋的脊髓前角α运动神经元是否为主要支配痉挛肌群的方法,进而实时“选择”并处理更容易加剧α运动神经元兴奋-抑制失衡表现的所谓“痉挛肌群责任神经后根”。
到目前为止,对于串刺激后诱发肌电可重复性的研究很少,且结论不一。在Warf等[15]的病例研究中,有高达2/3的神经后根串刺激结果无法重复;而Mittal等[16]的报告提示有约93%的神经后根串刺激后的EMG肌电反应分级基本稳定(同一或相差一个级别)。我们在SDR手术实践中发现,当采用脉宽0.2 ms、刺激强度为单刺激诱发监测肌群首先达到200 μV电流强度时,串刺激的可重复性也不甚理想,其原因可能在于串刺激的稳定性极度依赖高强度电流输入。在Mittal的研究中,术中电流输入平均强度为10 mA,同时脉宽也长达1 ms。而当术中诱发肌电采用单刺激模式时,即便输入的电流脉宽只有Mittal团队的20%(0.2 ms),强度不到8%(本中心的数据显示平均为0.78 mA),诱发的CMAP可重复性也较好(图 3),主要表现在:①当输入电流逐渐增加时,首先被激活的脊髓前角α运动神经元网络的一致性;②当输入电流强度固定时(采用阈值电流强度),最大被激活的脊髓前角α运动神经元网络的一致性;最大被激活脊髓前角α运动神经元网络兴奋程度的相似性;所有被激活脊髓前角α运动神经元网络的相似性。
尽管串刺激在高电流注入时也能显示出一定的可重复性,但类似可重复性往往只能作定性研究,而很难作定量研究;单刺激诱发肌电的稳定性及指向性非常好,且由于短时间内注入的电量比采用串刺激方案时小了至少3个数量级(电流脉宽0.2 ms比1.0 ms,电流强度0.78 mA比10.00 mA,刺激模式1 Hz比50 Hz),对患儿脊髓神经网络的潜在影响也小很多。
四、目前SDR术中诱发肌电面临的问题由于脊髓神经网络的复杂性,按感觉神经皮节分布特点“选择”的神经后根,仅承载痉挛肌群感觉信号传入,并不一定具有在兴奋- 抑制失衡脊髓前角α运动神经元过度兴奋中占有高权重的特性。而按照诱发肌电模式的神经后根“选择”,无论是串刺激还是单刺激方案,由于建立了“神经后根(传入信号)→α运动神经元→相关肌群(传出信号)”这一基本完整的输入/输出信号通路,并在此基础上对采集到的数据进行半定量/定量分析,相较于按神经皮节分布特点进行的神经后根“选择”,对患儿的痉挛状态可能是更符合逻辑的处理方案。但两者间究竟在神经后根“选择”方面有多大差异,还需进一步的研究来阐明。
采用诱发肌电判读来“选择”神经后根的一个优势是可以提供手术操作的微创入路。但在实际操作过程中,下肢肌群运动前根的术中有效判别一直困扰着SDR手术与监测人员。即便运动前根往往具有刺激电流极低阈值的特点,但手术中还是会遇到偏高阈值运动根及偏低阈值感觉根存在的现象。如何解释及安全量化区分这两者可能是未来研究的方向。括约肌功能的保护是SDR手术安全性的关键指标。括约肌功能相关神经根手术中的实时判别是诱发肌电判读方案中一个极其关键的组成部分。由于脊髓神经网络的复杂性,即便是单刺激时,有部分神经后根电刺激后产生的诱发肌电出现在括约肌监测通道的同时,也会出现在腓肠肌和(或)腘绳肌监测通道上,当这些肌群也是痉挛肌群时,实时“取舍”的量化标准也需要未来临床研究来明确。另外,如何达到术后肌张力的适度降低,从而使得脑瘫整体治疗效果实现最优化,也是摆在SDR手术团队面前一个亟待解决的临床问题。脊神经后根单刺激诱发肌电的重复性好,因此通过标准化的术中输入-输出配对数据采集、过滤及分析,再结合患儿术前术后肌张力及运动功能变化等参数进行相应相关性研究,可能是解答这个问题的潜在研究路径。
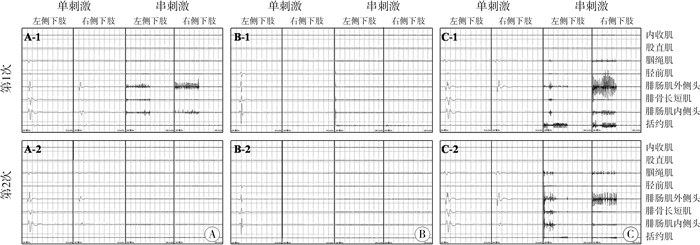
|
图 3 脑瘫患儿单刺激及串刺激诱发肌电稳定性比较(两次电刺激时间相差2 min) Fig.3 Reproducibility of EMG evoked during SDR procedure when trigger or train stimulus was applied to dorsal roots (2nd stimulus was given 2 min after 1st one) 注 神经后根A:电流强度为0.56 mA,第1次单刺激时主要诱发双侧腓肠肌内外侧头肌电活动(左侧为主),串刺激诱发肌电符合EMG肌电反应分级4+;重复测试显示:在同样的刺激电流强度下,单刺激的可重复性非常稳定,而串刺激则几乎没有诱发可辨识的肌电反应。神经后根B:电流强度为0.97 mA,第1次单刺激时主要诱发左侧腓肠肌内外侧头肌电活动,串刺激诱发肌电符合EMG肌电反应分级一级;重复测试显示:在同样的刺激电流强度下,单刺激的可重复性非常稳定,而串刺激则未诱发出任何可辨识的肌电反应。神经后根C:电流强度为0.73 mA,第1次单刺激时诱发了双侧腓肠肌的肌电活动(左侧为主),串刺激诱发肌电符合EMG肌电反应分级4+;重复测试显示:在同样的刺激电流强度下,单刺激诱发肌电依然稳定地出现在双侧腓肠肌(左侧为主)的监测通道上,串刺激后诱发肌电虽然也符合EMG肌电反应分级的4+,但各个通道的肌电模式不甚稳定 |
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为肖波、蒋文彬、王君璐,论文设计为肖波、詹琪佳,数据收集为肖波、蒋文彬
| [1] |
魏民. 选择性脊神经后根切断术治疗痉挛型脑瘫的应用进展[J]. 临床小儿外科杂志, 2019, 18(12): 1061-1066. Wei M. Application progress of selective dorsal rhizotomy in the treatment of spastic cerebral palsy[J]. J Clin Ped Sur, 2019, 18(12): 1061-1066. DOI:10.3969/j.issn.1671-6353.2019.12.015 |
| [2] |
Foerster. Resection of the posterior spinal nerve-roots in the treatment of gastric crises and spastic paralysis[J]. Proc R Soc Med, 1911, 4(Surg Sect): 254. |
| [3] |
Peacock WJ, Arens LJ. Selective posterior rhizotomy for the relief of spasticity in cerebral palsy[J]. S Afr Med J, 1982, 62(4): 119-124. |
| [4] |
Fasano VA, Broggi G, Barolat-Romana G, et al. Surgical treatment of spasticity in cerebral palsy[J]. Childs Brain, 1978, 4(5): 289-305. DOI:10.1159/000119785 |
| [5] |
Lazareff JA, Garcia-Mendez MA, De Rosa R, et al. Limited (L4-S1, L5-S1) selective dorsal rhizotomy for reducing spasticity in cerebral palsy[J]. Acta Neurochir (Wien), 1999, 141(7): 743-752. DOI:10.1007/s007010050370 |
| [6] |
Hicdonmez T, Steinbok P, Beauchamp R, et al. Hip joint subluxation after selective dorsal rhizotomy for spastic cerebral palsy[J]. J Neurosurg, 2005, 103(1 Suppl): 10-16. DOI:10.3171/ped.2005.103.1.0010 |
| [7] |
Park TS, Johnston JM. Surgical techniques of selective dorsal rhizotomy for spastic cerebral palsy.Technical note[J]. Neurosurg Focus, 2006, 21(2): e7. |
| [8] |
Park TS, Liu JL, Edwards C, et al. Functional outcomes of childhood selective dorsal rhizotomy 20 to 28 years later[J]. Cureus, 2017, 9(5): e1256. DOI:10.7759/cureus.1256 |
| [9] |
Bales J, Apkon S, Osorio M, et al. Infra-conus single-level laminectomy for selective dorsal rhizotomy: technical advance[J]. Pediatr Neurosurg, 2016, 51(6): 284-291. DOI:10.1159/000448046 |
| [10] |
Xiao B, Constatntini S, Browd SR, et al. The role of intra-operative neuroelectrophysiological monitoring in single-level approach selective dorsal rhizotomy[J]. Childs Nerv Syst, 2020, 36(9): 1925-1933. DOI:10.1007/s00381-019-04408-5 |
| [11] |
Zhan Q, Tang L, Wang Y, et al. Feasibility and effectiveness of a newly modified protocol-guided selective dorsal rhizotomy via single-level approach to treat spastic hemiplegia in pediatric cases with cerebral palsy[J]. Childs Nerv Syst, 2019, 35(11): 2171-2178. DOI:10.1007/s00381-019-04194-0 |
| [12] |
Zhan Q, Yu X, Jiang W, et al. Whether the newly modified rhizotomy protocol is applicable to guide single-level approach SDR to treat spastic quadriplegia and diplegia in pediatric patients with cerebral palsy?[J]. Childs Nerv Syst, 2020, 36(9): 1935-1943. DOI:10.1007/s00381-019-04368-w |
| [13] |
Masuda K, Shigematsu H, Tanaka M, et al. Monophasic transcranial constant-current versus constant-voltage stimulation of motor-evoked potentials during spinal surgery[J]. Sci Rep, 2019, 9(1): 3773. DOI:10.1038/s41598-019-39883-y |
| [14] |
Martinez V, Browd S, Osorio M, et al. Electrophysiology of sensory and motor nerve root fibers in selective dorsal rhizotomies[J]. Pediatr Neurosurg, 2020, 55(1): 17-25. DOI:10.1159/000502326 |
| [15] |
Warf BC, Nelson KR. The electromyographic responses to dorsal rootlet stimulation during partial dorsal rhizotomy are inconsistent[J]. Pediatr Neurosurg, 1996, 25(1): 13-19. DOI:10.1159/000121090 |
| [16] |
Mittal S, Farmer JP, Poulin C, et al. Reliability of intraoperative electrophysiological monitoring in selective posterior rhizotomy[J]. J Neurosurg, 2001, 95(1): 67-75. DOI:10.3171/jns.2001.95.1.0067 |
 2022, Vol. 21
2022, Vol. 21


