2. 复旦大学附属儿科医院新生儿外科,上海 20110
2. Department of Neonatal Surgery, Affiliated Children's Hospital of Fudan University, Shanghai 201102, China
脑室腹腔分流术是新生儿脑积水的常规治疗手段。不同母体妊娠合并症及胎儿畸形可导致不同病因的新生儿期脑积水,手术策略需根据术前脑室形态、脑脊液性状、患儿体重等因素进行个体化调整[1]。
脑室腹腔分流术后分流障碍的相关因素研究显示,低龄儿童(尤其是新生儿)存在较高的分流障碍发生率,但影响新生儿分流障碍发生的相关因素尚不明确,产前检查对分流障碍发生的影响研究较少[2-3]。本研究旨在回顾性分析新生儿期脑积水行脑室腹腔分流术患儿的产前筛查及产后治疗资料,寻找新生儿期脑积水分流障碍的相关因素。
材料与方法 一、研究对象本研究为回顾性研究。收集2013年1月至2020年1月复旦大学附属儿科医院收治的产前和新生儿期(生后≤28 d)诊断为脑积水,并接受脑室腹腔分流术治疗的53例患儿作为研究对象。排除标准:①因硬膜下出血致硬膜下积液,行硬膜下腹腔分流;②失访,随访时间少于2年或随访期间去除分流管;③缺乏关键临床资料(如产前胎儿筛查资料、母亲孕期资料及术前关键检查检验结果)。男30例,女23例;体重中位数2 650 g(820~4 500 g)。
本研究通过复旦大学附属儿科医院医学伦理委员会批准(审批号:复儿伦审[2018]267号)。所有患儿监护人均签署知情同意书。
二、观察指标及相关定义纳入研究的53例患儿中,无分流障碍37例(为无分流障碍组),分流障碍16例(为分流障碍组)。比较分流障碍组与无分流障碍组患儿在母亲孕期、产前筛查情况方面的差异,并对两组患儿母亲孕期资料、术前基本临床资料、脑积水影像学资料及手术相关因素进行对比分析。
母亲孕期资料包括胎产次、妊娠方式、单或多胎妊娠、妊娠并发症、分娩方式及妊娠期并发症(包括未足月胎膜早破、妊娠期相关高血压、产前出血、母亲感染及自发早产)。产前筛查胎儿畸形包括需手术矫治的先天性心脏病、膈膨升、肠道畸形及神经系统畸形[4]。
术前基本临床资料包括孕周、性别、手术月龄、体重、脑积水病因(脑室内出血后脑积水、感染后脑积水、先天性脑积水);脑积水影像学资料为额枕角比值(frontal and occipital horn ratio, FOHR),通过超声、CT或MR测量,主要用以评估术前脑室扩张程度[5]。手术相关因素包括脑室端入点(额角或枕角)、外引流穿刺点位置、脑室端是否跨中线、脑室端尖端环境(脑脊液环绕、贴壁、部分进入脑实质)、分流管阀类型(不同设计原理的可调压阀门)、分流管类型(包含或不含抗生素涂层)。
研究的主要观察终点为首次分流失败的发生时间。分流失败包括分流管功能障碍和分流管相关感染。分流管功能障碍的定义为需要再次手术翻修、更换分流管组件,或者去除分流管后行三脑室造瘘术。分流管感染定义为存在以下某一种或多种情况:①从脑脊液、分流管组件或伤口培养或通过Gram染色发现病原菌;②分流管外露(分流管走形的皮肤伤口并肉眼可见分流管组件);③腹腔包裹性囊肿(即使培养未见阳性)。该分流失败的定义标准与已发表的临床试验一致[6-7]。
三、统计学处理使用SPSS 20.0进行统计分析。连续型变量使用x±s或M(Q1,Q3)表示;分类变量使用频率、构成比表示。符合正态分布的连续型变量采用独立样本t检验比较组间差异,不符合正态分布的连续型变量采用Mann-Whitney秩和检验比较组间差异。分类变量采用卡方或Fisher精确检验进行组间比较。将具有统计学意义的变量使用Logistic回归模型进行风险因素评估,结果以风险比及其95%置信区间表示。生存分析采用Kaplan-Meier(K-M)法,绘制生存曲线,采用Log-Rank检验比较脑室端穿刺点对分流管生存率的影响。P < 0.05为差异有统计学意义。
结果53例新生儿脑积水患儿平均随访4年6个月(2年3个月至9年4个月)。无分流障碍率为69.8%(37/53),无分流障时间为44.8个月(1.1~108.9)个月。分流障碍组中,产前检查共有11例患儿母亲存在妊娠合并症;11例存在胎儿畸形;早产儿19例,足月儿18例;14例剖宫产,23例顺产;9例为双胎,28例为单胎;试管婴儿5例。在分流障碍组中,产前检查共有5例患儿母亲存在妊娠合并症;5例存在胎儿畸形;早产儿11例,足月儿5例;3例剖宫产,13例顺产;1例为双胎,15例为单胎;试管婴儿4例。
两组患儿术前脑室前角扩张程度、手术月龄、手术时体重差异无统计学意义(P>0.05), 见表 1。导致脑积水的病因及术前脑脊液蛋白水平与分流障碍的发生相关。出血及感染后脑积水的分流障碍发生率高(P=0.04),脑脊液蛋白水平高的患儿分流障碍发生率高(P=0.002)。
| 表 1 新生儿脑积水分流障碍的相关因素分析 Table 1 Analysis of clinical factors for shunt malfunction in neonatal hydrocephalus |
|
|
脑积水病因包括先天性脑积水8例(中脑导水管狭窄2例,四脑室出口闭塞2例,侧脑室囊肿伴脑积水2例,Dandy-Walker畸形1例,胼胝体缺如伴脑积水1例),为先天性脑积水组;继发性脑积水45例其中脑室内出血后脑积水19例(Ⅲ级9例,Ⅳ级10例),感染后脑积水26例,为继发性脑积水组。产前检查与脑积水病因关系的分析显示:早产与脑积水病因相关(P=0.04),14/19的脑出血后脑积水发生于早产儿(表 2)。胎儿畸形与脑积水病因相关(P=0.007),先天性脑积水多在产前检查发现(6/8)。脑室内出血和感染后脑积水患儿多无胎儿产前检查异常(35/37)。分娩方式与脑积水病因相关(P=0.01),先天性脑积水多选择剖宫产(6/8),而继发性脑积水(出血及感染后)多选择顺产(34/36)。
| 表 2 先天性脑积水组与继发性脑积水组产前情况对比(例) Table 2 Comparison of prenatal examination related factors between congenital hydrocephalus group and secondary hydrocephalus group(n) |
|
|
分流管脑室端头端周围环境(脑室端被脑脊液环绕、贴壁、部分进入脑实质)、脑室端头端跨中线及分流管涂层(抗菌涂层及无涂层)与分流障碍的发生无相关性。采用额角穿刺(P=0.04)和使用Strata分流阀(P=0.02)者分流障碍发生率低(表 3)。
| 表 3 无分流障碍组与分流障碍组脑室端入点及分流管情况对比(例) Table 3 Comparison of ventricular end entry point and shunt tube between children without shunt disorder and children with shunt disorder(n) |
|
|
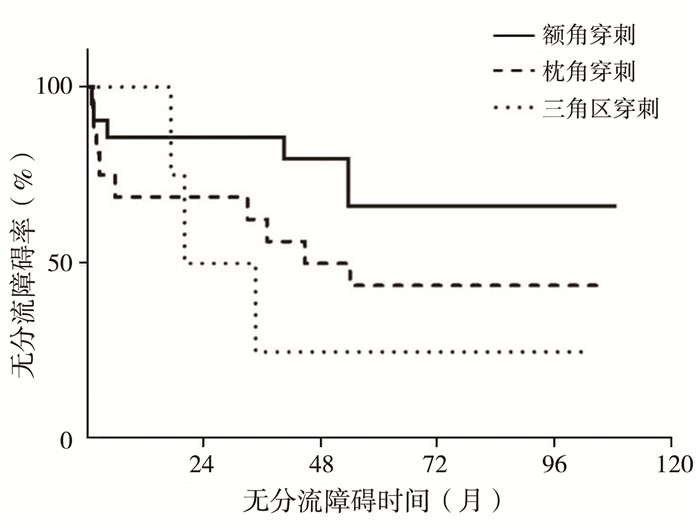
多因素分析显示,术前脑脊液蛋白水平(OR=2.198, 95%CI: 1.015~4.758,P=0.04)和脑室端入点位置(OR=3.600, 95%CI: 1.257~7.088,P=0.03)是分流障碍发生的风险因素。生存分析结果显示(图 1),脑室端穿刺点与无分流障碍率相关(P=0.04)。
|
图 1 不同脑室穿刺位置脑积水患儿的无分流障碍率、无分流障碍时间比较 Fig.1 Survival curve of ventricular catheter entry site |
自20世纪下半叶脑室腹腔分流术作为脑积水治疗方法问世以来,小儿神经外科医生重点关注的问题之一就是如何提高分流存活率[8]。20世纪90年代后期的研究显示,术后2年的分流存活率为50% ~75%[9-11]。尽管分流设备的设计在进步,但脑室腹腔分流术后分流存活超过10年的病例仍不到1/3[12]。目前导致分流障碍的原因仍不明确,近10年的研究显示,年龄小、体重低、出血及感染后脑积水以及合并需要手术治疗的其他系统异常,均与分流障碍的发生相关[13]。本文针对分流障碍发生率较高的新生儿群体展开研究,通过平均近5年的随访,总结产前、产后及手术相关的临床因素,分析导致新生儿脑积水脑室腹腔分流术后分流障碍的相关风险因素。
既往回顾性研究显示,年龄和病因均与分流障碍的发生有关,一项研究显示首次分流管置入年龄小于1岁是发生分流障碍的风险因素[14]。而另一项研究显示,分流障碍发生的风险因素与脑积水的病因而非年龄相关,脑出血后脑积水是分流障碍发生的风险因素[15]。一项大型多中心前瞻性研究发现,年龄小于6个月是发生分流障碍的风险因素[16]。本研究单因素分析提示脑积水的病因以及分流术前脑脊液蛋白水平是分流障碍发生的主要相关因素。多因素分析提示,脑脊液蛋白水平与分流障碍相关,提示出血或感染后脑积水可能通过改变脑脊液性状而影响分流障碍的发生率。
脑出血后脑积水(post hemorrhagic hydrocephalus, PHH)与早产儿脑室内出血(intraventricular hemorrhage, IVH)的严重程度直接相关,超过75%的PHH患儿有Ⅲ/Ⅳ级IVH[17]。分娩方式和脐带钳夹的时间影响IVH的发生率。延迟脐带钳夹的时间、增加胎盘内血液回流(胎盘输血),不仅可以减少新生儿期IVH的发生和输血的需要,而且在生后18个月的评估中还显示出神经和运动方面的获益[18]。
本研究未发现产前检查中孕期一般情况、妊娠合并症、胎儿畸形与分流障碍之间的直接关系,但发现产前检查与新生儿脑积水的病因相关。14/19的脑出血后脑积水发生于早产儿,存在母体妊娠合并症(P=0.001)、试管婴儿(P=0.02)和双胎妊娠(P=0.002)者易发生胎儿早产。75%的先天性脑积水(6/8)于产前检查发现,并行计划性剖腹产。因此产前检查及相应的产前处理,可从病因学上降低新生儿脑积水分流障碍的发生率。
本研究多因素分析显示分流阀的类型与分流障碍的发生率无关,与目前已有的研究结论一致[6]。在儿童脑积水诊疗指南中,肯定了抗菌分流管在减少分流管相关感染中的作用[19]。但本研究中抗菌涂层分流管或无涂层分流管与分流障碍的发生没有明显的相关性,可能与病例数较少、未对不同类型的分流障碍进行分层分析有关。
目前,脑室穿刺方法、脑室端导管的头端位置对分流障碍发生的影响尚缺乏统一的认识[20]。本研究发现脑室端导管头端位置与分流障碍的发生无关,脑室穿刺方法与分流障碍的发生相关,采用额角穿刺可降低分流障碍率(P < 0.05),提示脑室端导管进入脑室的方式比其最终在脑室内的位置更重要。我们推测,从枕角穿刺,导管从后向前进入脑室内,脑脊液的引流方向使导管易靠近或停留于脑室底或脉络丛,因而易早期发生梗阻。而从额角穿刺,导管头端位于脑室顶部,脑脊液引流的方向远离脑室壁、脑室底和脉络丛,从而降低了分流障碍的发生率。
本研究存在一定的局限性,由于入组病例均为存活且经手术治疗的新生儿,回顾性分析产前母体及胎儿畸形因素可能存在选择偏倚。此外由于本研究样本量较少,无法对母体及胎儿相关因素进行逐一分组分析,因此仍需大样本、多中心、前瞻性研究进行验证。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 课题设计为李昊、沈淳、张毅,数据收集与分析为张毅、薛萍,论文结果撰写为张毅,论文讨论分析为张毅、沈淳、赵瑞、施伟、李昊
| [1] |
曹广娜, 张扬, 常艳美, 等. 脑室帽状腱膜下引流术治疗早产儿脑室内出血后脑积水的疗效分析[J]. 临床小儿外科杂志, 2022, 21(3): 242-247. Cao GN, Zhang Y, Chang YM, et al. Effect of ventriculosubgaleal shunts in the treatment of posthemorrhagic hydrocephalus of preterm infants[J]. J Clin Ped Sur, 2022, 21(3): 242-247. DOI:10.3760/cma.j.cn101785-202106021-008 |
| [2] |
Paulsen AH, Lundar T, Lindegaard KF. Pediatric hydrocephalus: 40-year outcomes in 128 hydrocephalic patients treated with shunts during childhood.Assessment of surgical outcome, work participation, and health-related quality of life[J]. J Neurosurg Pediatr, 2015, 16(6): 633-641. DOI:10.3171/2015.5.PEDS14532 |
| [3] |
Tully HM, Doherty D, Wainwright M. Mortality in pediatric hydrocephalus[J]. Dev Med Child Neurol, 2022, 64(1): 112-117. DOI:10.1111/dmcn.14975 |
| [4] |
Gagliardi L, Rusconi F, Da Frè M, et al. Pregnancy disorders leading to very preterm birth influence neonatal outcomes: results of the population-based ACTION cohort study[J]. Pediatr Res, 2013, 73(6): 794-801. DOI:10.1038/pr.2013.52 |
| [5] |
o'hayon, Hayon BB, Drake JM, et al. Frontal and occipital horn ratio: A linear estimate of ventricular size for multiple imaging modalities in pediatric hydrocephalus[J]. Pediatr Neurosurg, 1998, 29(5): 245-249. DOI:10.1159/000028730 |
| [6] |
Drake JM, Kestle JR, Milner R, et al. Randomized trial of cerebrospinal fluid shunt valve design in pediatric hydrocephalus[J]. Neurosurgery, 1998, 43(2): 294-303. DOI:10.1097/00006123-199808000-00068 |
| [7] |
Kestle JR, Drake JM, Cochrane DD, et al. Lack of benefit of endoscopic ventriculoperitoneal shunt insertion: a multicenter randomized trial[J]. J Neurosurg, 2003, 98(2): 284-290. DOI:10.3171/jns.2003.98.2.0284 |
| [8] |
Aschoff A, Kremer P, Hashemi B, et al. The scientific history of hydrocephalus and its treatment[J]. Neurosurg Rev, 1999, 22(2-3): 67-93. DOI:10.1007/s101430050035 |
| [9] |
Notarianni C, Vannemreddy P, Caldito G, et al. Congenital hydrocephalus and ventriculoperitoneal shunts: influence of etiology and programmable shunts on revisions[J]. J Neurosurg Pediatr, 2009, 4(6): 547-552. DOI:10.3171/2009.7.PEDS08371 |
| [10] |
Kulkarni AV, Riva-Cambrin J, Butler J, et al. Outcomes of CSF shunting in children: comparison of hydrocephalus clinical research network cohort with historical controls: clinical article[J]. J Neurosurg Pediatr, 2013, 12(4): 334-338. DOI:10.3171/2013.7.PEDS12637 |
| [11] |
Stone JJ, Walker CT, Jacobson M, et al. Revision rate of pediatric ventriculoperitoneal shunts after 15 years[J]. J Neurosurg Pediatr, 2013, 11(1): 15-19. DOI:10.3171/2012.9.PEDS1298 |
| [12] |
Symss NP, Oi S. Is there an ideal shunt? A panoramic view of 110 years in CSF diversions and shunt systems used for the treatment of hydrocephalus: from historical events to current trends[J]. Childs Nerv Syst, 2015, 31(2): 191-202. DOI:10.1007/s00381-014-2608-z |
| [13] |
Khan F, Shamim MS, Rehman A, et al. Analysis of factors affecting ventriculoperitoneal shunt survival in pediatric patients[J]. Childs Nerv Syst, 2013, 29(5): 791-802. DOI:10.1007/s00381-012-2004-5 |
| [14] |
Tuli S, Drake J, Lawless J, et al. Risk factors for repeated cerebrospinal shunt failures in pediatric patients with hydrocephalus[J]. J Neurosurg, 2000, 92(1): 31-38. DOI:10.3171/jns.2000.92.1.0031 |
| [15] |
Simon TD, Whitlock KB, Riva-Cambrin J, et al. Association of intraventricular hemorrhage secondary to prematurity with cerebrospinal fluid shunt surgery in the first year following initial shunt placement[J]. J Neurosurg Pediatr, 2012, 9(1): 54-63. DOI:10.3171/2011.10.PEDS11307 |
| [16] |
Riva-Cambrin J, Kestle JR, Holubkov R, et al. Risk factors for shunt malfunction in pediatric hydrocephalus: a multicenter prospective cohort study[J]. J Neurosurg Pediatr, 2016, 17(4): 382-390. DOI:10.3171/2015.6.PEDS14670 |
| [17] |
Christian EA, Jin DL, Attenello F, et al. Trends in hospitalization of preterm infants with intraventricular hemorrhage and hydrocephalus in the United States, 2000-2010[J]. J Neurosurg Pediatr, 2016, 17(3): 260-269. DOI:10.3171/2015.7.PEDS15140 |
| [18] |
Mercer JS, Erickson-Owens DA, Vohr BR, et al. Effects of placental transfusion on neonatal and 18 month outcomes in preterm infants: a randomized controlled trial[J]. J Pediatr, 2016, 168: 50-55. DOI:10.1016/j.jpeds.2015.09.068 |
| [19] |
Bauer DF, Baird LC, Klimo P, et al. Congress of neurological surgeons systematic review and evidence-based guidelines on the treatment of pediatric hydrocephalus: update of the 2014 guidelines[J]. Neurosurgery, 2020, 87(6): 1071-1075. DOI:10.1093/neuros/nyaa434 |
| [20] |
Riva-Cambrin J, Kestle JR, Holubkov R, et al. Risk factors for shunt malfunction in pediatric hydrocephalus: a multicenter prospective cohort study[J]. J Neurosurg Pediatr, 2016, 17(4): 382-390. DOI:10.3171/2015.6.PEDS14670 |
 2022, Vol. 21
2022, Vol. 21


