2. 苏州大学附属苏州儿童医院泌尿外科,苏州 215002
2. Department of Pediatric Urological Surgery, Affiliated Children's Hospital, Soochow University, Suzhou 215002, China
神经源性膀胱是小儿泌尿外科常见疾病之一,根据患儿逼尿肌、括约肌的尿动力学改变,临床上可表现出不同的储尿、排尿功能障碍。神经源性逼尿肌过度活动(neurogenic detrusor overactive, NDO)可造成储尿期膀胱压力升高、功能性膀胱容量减少、膀胱顺应性下降,引起泌尿道感染、继发性膀胱输尿管反流等,进而对上尿路功能造成损害,影响患儿身体健康及生活质量[1-2]。神经源性膀胱的治疗以预防尿路感染、保护肾功能及改善尿失禁为目标。抗胆碱能药物(如奥昔布宁等),可使逼尿肌松弛,从而增加功能性膀胱容积、降低膀胱内压、改善膀胱顺应性。然而,长期服药的不便以及对药物不良反应的不耐受,使得部分患儿对口服药物治疗的依从性受到影响[2-3]。此外也有部分患儿对抗胆碱能药物治疗效果不明显。A型肉毒杆菌毒素(botulinum toxin A, BTX-A)通过抑制突触前膜释放乙酰胆碱,产生长期的局部化学性去神经支配作用,使膀胱松弛[3-4]。BTX-A在泌尿外科领域应用广泛,但在国内的应用起步较晚,尤其在小儿泌尿外科领域鲜有报告。本研究拟通过回顾性分析,对膀胱镜下BTX-A膀胱注射治疗儿童NDO的临床效果进行初步评估,探讨BTX-A对小儿NDO的治疗意义。
材料与方法 一、研究对象回顾性分析2020年4月至2021年6月复旦大学附属儿科医院行BTX-A膀胱注射治疗的NDO患儿临床资料。患儿均在本院门诊就诊,根据基础疾病诊疗史及手术史、临床症状、尿动力检查结果等,诊断为神经源性膀胱。尿动力检查结果皆提示膀胱充盈期压力升高、膀胱容量小、顺应性下降。患儿均首先给予清洁间歇导尿(clean intermittent catheterization, CIC),联合持续预防性抗生素(continuous antibiotic prophylaxis, CAP)及抗胆碱能药物口服,治疗时间至少在3个月以上,但均无明显疗效,因而考虑选择BTX-A注射治疗。
所有患儿在注射治疗前完成泌尿系统B超、排泄性膀胱尿道造影、尿动力检查等。收集并记录患儿性别、年龄、体重、CIC频率、单次最大导尿量、发热性尿路感染发生率、超声下膀胱壁厚度及尿动力检查中膀胱最大灌注容量、膀胱安全容量、膀胱顺应性。本研究项目及药品的使用均经复旦大学附属儿科医院伦理委员会审批通过(复儿伦审2018-140),所有治疗开展前均向监护人充分告知并签署书面知情同意书。
二、注射治疗方法本研究采用保妥适(BOTOX,爱力根爱尔兰制药公司;批准文号:S20171005;规格:100 U/支)作为注射用肉毒毒素药物。单次注射治疗的剂量参考美国泌尿外科学会(American Urological Association, AUA)指南,为10~12 U/kg,总量不超过200 U[5]。
患儿于全身麻醉下接受膀胱镜检查及BOTOX注射治疗。取截石体位,应用膀胱镜(9.5 Fr, Karl Storz Endoscopy Ltd, Germany)进行检查操作。将BOTOX溶于15 mL生理盐水,经膀胱镜并使用膀胱镜下注射用针(COOK Medical, USA),避开膀胱三角区,直视下注入膀胱顶部(8针)、两侧体部(各7~8针)、底部膀胱壁黏膜下肌层(8针)。共注射30点、每点0.5 mL。术后常规留置导尿管,24 h后拔除导尿管,恢复CIC。记录血尿、疼痛等围手术期并发症情况。
三、随访1. 后续治疗、随访计划:注射治疗后,患儿被要求维持注射前的CIC频率,维持CAP治疗,停止口服抗胆碱能药物。随访以本院神经源性膀胱专病门诊为主要随访平台,并结合电话、网络医疗进行。要求患儿在注射后第1、3、6个月进行随访。对失访者、随访资料不全者、治疗及随访依从性差者予以剔除。
2. 随访内容:在注射治疗后第1、3、6个月,从家长提供的导尿日记中收集CIC频率、单次最大导尿量,记录随访期间发热性尿路感染(febrile urinary tract infection, fUTI)发生情况。在注射后第3个月行B超及尿动力检查,记录膀胱壁厚度、最大膀胱灌注容量、膀胱安全容量、膀胱顺应性。随访期内全程记录有无BOTOX注射相关治疗后并发症。
四、观察指标的定义fUTI:体温≥38℃,尿液浑浊,尿白细胞增高或尿培养发现细菌,为fUTI;体温升高而无上述尿液改变;或单纯尿液性状改变、尿常规检查结果异常,而不伴有发热者非fUTI。随访期间发生1次及以上fUTI均视为发生fUTI。
膀胱壁厚度(bladder wall thickness, BWT):根据CIC单次最大导尿量进行预估,在膀胱充分充盈时行B超测量。
尿动力检查方法:使用莱博瑞尿动力学检查仪(AQS1001, Laborie Medical Technologies Corp, Canada)进行检查,检查方法参照国际尿控协会(International Continence Society, ICS)标准进行[6]。
五、统计学处理采用SPSS 20.0进行统计学分析,首先对数据分布类型进行Shapiro-Wilk检验,对正态分布数据以x±s表示,统计分析采用配对t检验(因本文数据涉及术前、术后1个月、术后3个月、术后6个月共4个时点的比较结果,因此对t检验组间差异有统计学意义的显著性水准进行校正,为0.05/4=0.0125);非正态分布数据以M(Q1, Q3)表示,统计分析采用非参数秩和检验;分类变量以例数(%)表示,统计分析采用卡方检验。P<0.05为差异有统计学意义。
结果本研究在设定时段内诊断为神经源性膀胱并进行BOTOX注射治疗的患儿共15例,排除因随访时间不足、随访资料缺失、注射后未坚持规范化CIC的患儿4例,共有11例患儿纳入研究,其中男1例,女10例。注射时年龄(80.36±43.35)个月,体重(21.86±7.47)kg。注射前平均CIC频率为(5.86±1.60)次/天,单次最大导尿量为(152.73±58.10)mL;9例存在膀胱输尿管反流,11例有fUTI;超声检查膀胱壁厚度为(4.41±1.95)mm;尿动力检查膀胱最大灌注量(158.44±57.26)mL、膀胱安全容量(139.78±66.09)mL、膀胱顺应性(4.37±2.16)mL/cmH2O。
注射治疗后1个月、3个月、6个月的CIC频率分别为(6.18±2.31)次/天(P=0.652)、(5.91±2.38)次/天(P=0.948)、(5.68±1.91)次/天(P=0.736),与术前相比,差异均无统计学意义。
注射后1个月、3个月、6个月的单次最大导尿量分别增加至(206.82±72.05)mL(P=0.004)、(227.28±94.67)mL(P=0.003)、(185.46±75.38)mL(P=0.024),见图 1、表 1。
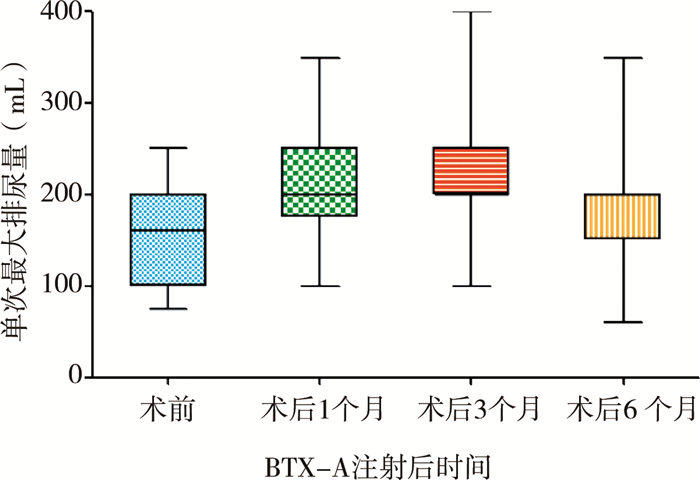
|
图 1 神经源性膀胱并进行BOTOX注射治疗患儿单次最大排尿量变化 Fig.1 Change of Maximum Voiding Volume after the Injection of BTX-A |
| 表 1 神经源性逼尿肌过度活动患儿不同时段单次最大导尿量、CIC频率及fUTI的变化 Table 1 Change of maximal voiding volume, CIC frequency and fUTI in NDO children after an injection of BTX-A |
|
|
11例患儿术前均反复出现fUTI。1例注射后1个月内有fUTI(P < 0.001),注射后3个月时,该患儿仍有fUTI(P < 0.001);至注射后6个月时,11例中有3例存在fUTI,见表 1。
注射后3个月,患儿平均膀胱壁厚度下降至(2.75±0.84)mm,较术前显著改善(P=0.004);在9例有完整尿动力检查随访数据的患儿中,最大膀胱灌注容量上升至(225.44±94.03)mL(P=0.041),最大安全容量上升至(216.11±106.44)mL(P=0.049),膀胱顺应性上升至(9.43±5.74)mL/cmH2O,(P=0.023),均较注射治疗前显著改善,见表 2。
| 表 2 神经源性逼尿肌过度活动患儿术前术后不同时段B超及尿动力检查变化(x±s) Table 2 Change of ultrasound and urodynamics in NDO children after an injection of BTX-A(x±s) |
|
|
11例患儿随访期间,无一例发生血尿、疼痛等并发症。
讨论BTX-A自1988年由Dykstra等[7]首先报道以来,其在泌尿外科的应用日益广泛。相关研究发现,BTX-A膀胱注射后,神经源性膀胱患儿膀胱容量增加,压力下降,疗效满意[3, 8-9]。2011年8月美国食品药品监督管理局(Food and Drug Administration, FDA)批准BTX-A膀胱逼尿肌注射治疗顽固性膀胱过度活动,括约肌注射治疗膀胱出口梗阻,研究结果证实在成人患者中应用安全可行[3, 10]。国际上也有大量文献证实BTX-A在儿童NDO患儿中应用的安全性及有效性,欧洲泌尿外科学会(European Association of Urology, EAU)指南中明确推荐BTX-A作为儿童NDO的重要治疗手段[2, 11]。本研究中患儿BTX-A注射治疗后,在保持CIC频率一致的前提下,其单次最大导尿量明显上升;同时,注射后3个月的尿动力学检查结果显示,患儿膀胱最大灌注量、膀胱安全容量及膀胱顺应性均有明显改善。初步验证了BTX-A注射在儿童患者中的有效性。
文献报道BTX-A膀胱注射治疗的并发症多集中在膀胱容量增加引起的尿潴留和尿路感染[12-13]。而本研究涉及的11例患儿中,并未观察到此类并发症。我们认为可能与本组患儿在围手术期留置导尿、随访期能配合完成规范的CIC治疗有关。此外,也未观察到血尿、疼痛、肌无力等其他并发症,我们认为,BTX-A膀胱注射治疗在儿童中是安全可行的。
既往文献指出,神经源性膀胱患儿中,膀胱壁增厚可能与膀胱压力增高及肾实质瘢痕有关[14]。因此,本研究采用膀胱壁厚度作为膀胱形态指标,发现患儿术后3个月时的BWT明显低于术前,提示BTX-A注射治疗可能有助于降低膀胱压力、保护上尿路和预防肾实质瘢痕。但由于BWT可能与多种因素有关,因此后续仍需进一步随访证实BTX-A注射对保护上尿路、预防肾瘢痕的效果[14]。
EAU及AUA指南中均指出,单次BTX-A注射对于扩大膀胱容量这一效果的持续时间尚无定论[5, 15]。根据既往来自成人方面的研究报道,对比口服抗胆碱能药物,BTX-A注射治疗后疗效持续的时间明显较长,约70 d至9个月之间[3, 16]。在本研究纳入的儿童患者中,患儿单次注射6个月后,其单次最大导尿量较注射前明显增加,提示在儿童患者中,BTX-A膀胱注射治疗的效果也可以维持与成人类似的时间。但本研究涉及样本量较少,随访时间较短,需要后续纳入更多病例并延长随访时间进行进一步的分析。
在本组患儿中,注射治疗后fUTI的发生较注射前明显好转。既往研究认为,神经源性膀胱患儿fUTI发生率高,表现多样,且与尿潴留、膀胱压力增加显著相关[17-18]。而BTX-A注射引起的膀胱有效容量增大、压力下降有利于防治fUTI。但神经源性膀胱患儿发生fUTI的相关因素众多,包括继发性膀胱输尿管反流、CAP等[18-19]。本组11例患儿中,9例存在继发性反流,所有患儿注射治疗前后都接受了CAP,因而我们也同意上述结论。但仍需要增加样本量,纳入多因素分析,以证实BTX-A注射和fUTI之间的相关性。
本研究存在一些不足:①本研究为回顾性分析,旨在对BTX-A膀胱内注射治疗的经验进行初步分析,然而BTX-A在儿童神经源性膀胱治疗中的应用在国内尚属起步阶段,因此,本研究涉及病例较少,随访时间较短,缺乏长期作用的研究结果;②由于部分患儿随访依从性欠佳,因此部分患儿随访信息有缺失,可能造成结论偏倚;③本研究纳入指标较少,对BTX-A注射治疗的其他影响尚不能进行详细研究,亟需后续纳入多中心研究,扩大样本量,加入多因素分析,进行更深入的探讨。
综上所述,BTX-A膀胱注射治疗儿童神经源性逼尿肌过度活动,可增加神经源性膀胱患儿功能性膀胱容量,降低患儿膀胱内压,改善膀胱顺应性,治疗安全有效,是儿童神经源性膀胱的重要治疗手段。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为刘嘉林、刘颖、沈剑, 论文调查设计为刘嘉林、毕允力、刘颖、王翔, 数据收集与分析刘嘉林、汤梁峰、王安乐、周燕华、万嫣敏, 论文结果撰写为刘嘉林、王翔, 论文讨论分析为刘嘉林、刘颖、汤梁峰、王翔
| [1] |
Sripathi V, Mitra A. Management of neurogenic bladder[J]. Indian J Pediatr, 2017, 84(7): 545-554. DOI:10.1007/s12098-017-2356-7 |
| [2] |
Stein R, Bogaert G, Dogan HS, et al. EAU/ESPU guidelines on the management of neurogenic bladder in children and adolescent part Ⅱ operative management[J]. Neurourol Urodyn, 2020, 39(2): 498-506. DOI:10.1002/nau.24248 |
| [3] |
Cooley LF, Kielb S. A review of botulinum toxin a for the treatment of neurogenic bladder[J]. PM R, 2019, 11(2): 192-200. DOI:10.1016/j.pmrj.2018.07.016 |
| [4] |
Baldwin MR, Barbieri JT. Association of botulinum neurotoxins with synaptic vesicle protein complexes[J]. Toxicon, 2009, 54(5): 570-574. DOI:10.1016/j.toxicon.2009.01.040 |
| [5] |
Lightner DJ, Gomelsky A, Souter L, et al. Diagnosis and treatment of overactive bladder (Non-Neurogenic) in adults: AUA/SUFU guideline amendment 2019[J]. J Urol, 2019, 202(3): 558-563. DOI:10.1097/JU.0000000000000309 |
| [6] |
Schäfer W, Abrams P, Liao L, et al. Good urodynamic practices: uroflowmetry, filling cystometry, and pressure-flow studies[J]. Neurourol Urodyn, 2002, 21(3): 261-274. DOI:10.1002/nau.10066 |
| [7] |
Dykstra DD, Sidi AA, Scott AB, et al. Effects of botulinum A toxin on detrusor-sphincter dyssynergia in spinal cord injury patients[J]. J Urol, 1988, 139(5): 919-922. DOI:10.1016/s0022-5347(17)42717-0 |
| [8] |
Reitz A, Stöhrer M, Kramer G, et al. European experience of 200 cases treated with botulinum-A toxin injections into the detrusor muscle for urinary incontinence due to neurogenic detrusor overactivity[J]. Eur Urol, 2004, 45(4): 510-515. DOI:10.1016/j.eururo.2003.12.004 |
| [9] |
Dyer LL, Franco I. Botulinum Toxin-A therapy in pediatric urology: indications for the neurogenic and non-neurogenic neurogenic bladder[J]. Scientific World Journal, 2009, 9: 1300-1305. DOI:10.1100/tsw.2009.146 |
| [10] |
Thaker H, Zhang S, Diamond DA, et al. Beyond botulinum neurotoxin A for chemodenervation of the bladder[J]. Curr Opin Urol, 2021, 31(2): 140-146. DOI:10.1097/MOU.0000000000000843 |
| [11] |
Hascoet J, Manunta A, Brochard C, et al. Outcomes of intra-detrusor injections of botulinum toxin in patients with spina bifida: A systematic review[J]. Neurourol Urodyn, 2017, 36(3): 557-564. DOI:10.1002/nau.23025 |
| [12] |
Kaviani A, Khavari R. Disease-specific outcomes of botulinum toxin injections for neurogenic detrusor overactivity[J]. Urol Clin North Am, 2017, 44(3): 463-474. DOI:10.1016/j.ucl.2017.04.012 |
| [13] |
Rovner E, Dmochowski R, Chapple C, et al. OnabotulinumtoxinA improves urodynamic outcomes in patients with neurogenic detrusor overactivity[J]. Neurourol Urodyn, 2013, 32(8): 1109-1115. DOI:10.1002/nau.22376 |
| [14] |
Şekerci ÇA, Işbilen B, Işman F, et al. Urinary NGF, TGF-β1, TIMP-2 and bladder wall thickness predict neurourological findings in children with myelodysplasia[J]. J Urol, 2014, 191(1): 199-205. DOI:10.1016/j.juro.2013.08.025 |
| [15] |
Apostolidis A, Dasgupta P, Denys P, et al. Recommendations on the use of botulinum toxin in the treatment of lower urinary tract disorders and pelvic floor dysfunctions: a European consensus report[J]. Eur Urol, 2009, 55(1): 100-119. DOI:10.1016/j.eururo.2008.09.009 |
| [16] |
Rajkumar GN, Small DR, Mustafa AW, et al. A prospective study to evaluate the safety, tolerability, efficacy and durability of response of intravesical injection of botulinum toxin type A into detrusor muscle in patients with refractory idiopathic detrusor overactivity[J]. BJU Int, 2005, 96(6): 848-852. DOI:10.1111/j.1464-410X.2005.05725.x |
| [17] |
周广伦, 孙俊杰, 尹鉴淳, 等. 儿童神经源性膀胱并尿路感染的临床特点及病原菌分析[J]. 临床小儿外科杂志, 2021, 20(11): 1021-1025. Zhou GL, Sun JJ, Yin JC, et al. Analysis of pathogens and clinical features of neuropathic bladder with urinary tract infection in children[J]. J Clin Ped Sur, 2021, 20(11): 1021-1025. DOI:10.12260/lcxewkzz.2021.11.005 |
| [18] |
Vigil HR, Hickling DR. Urinary tract infection in the neurogenic bladder[J]. Transl Androl Urol, 2016, 5(1): 72-87. DOI:10.3978/j.issn.2223-4683.2016.01.06 |
| [19] |
Wu CQ, Franco I. Management of vesicoureteral reflux in neurogenic bladder[J]. Investig Clin Urol, 2017, 58(Suppl 1): S54-S58. DOI:10.4111/icu.2017.58.S1.S54 |
 2022, Vol. 21
2022, Vol. 21


