2. 国家儿童医学中心,复旦大学附属儿科医院神经外科,上海 201102;
3. 国家儿童医学中心,复旦大学附属儿科医院麻醉科,上海 201102;
4. 国家儿童医学中心,复旦大学附属儿科医院超声科,上海 201102
2. bNational Children's Medical Center (Shanghai), Children's Hospital of Fudan University, Department of Neurosurgery, Shanghai 201102;
3. National Children's Medical Center (Shanghai), Children's Hospital of Fudan University, Department of Anesthesiology, Shanghai 201102;
4. National Children's Medical Center (Shanghai), Children's Hospital of Fudan University, Department of Medical Ultrasonography, Shanghai 201102, China
胆道闭锁(biliary atresia, BA)患儿术中如何判断胆汁引流情况以及寻找预后指标一直是小儿外科医生的关注点。2015年日本学者首先使用吲哚菁绿(indocyanine green, ICG)反映Kasai术中胆汁引流情况,5例患儿术前大便不显色,术后都显示出明显荧光,表明Kasai术中有胆汁引流到肠管之中;而肝门处弥散强光的患儿术后未退黄并进行肝移植,表明术中ICG的变化可能与预后相关[1]。但文献研究例数较少,ICG反映的胆汁情况与预后关系值得进一步探索。本研究通过术前注射ICG,术中观察肝脏荧光显像特征,扩大样本分析肝门ICG显影速度(胆汁排泄速度)、肝脏ICG显像(胆汁分布)及肝门亮度值(瞬时胆汁流量)等参数,验证检测参数与BA早期预后之间的关联。
材料与方法 一、研究对象回顾性分析2019年11月至2020年5月复旦大学附属儿科医院外科收治的胆道闭锁部分患儿临床资料。病例纳入标准:术中探查为Ⅲ型胆道闭锁并行Kasai手术,术后病理证实为胆道闭锁者。排除标准:①严重肝肾功能异常;②碘造影剂过敏;③Ⅰ型、Ⅱ型胆道闭锁,合并内脏反位、多脾综合征等;④患儿监护人拒绝签署知情同意书。本研究通过复旦大学附属儿科医院医学伦理委员会审批(复儿伦审(2020)82号),患儿家属均知情同意并签署知情同意书。
二、研究方法 (一) ICG注射及显像方法术前24 h,按0.1 mg/kg外周静脉注射ICG。术中于距肝脏10~15 cm处应用780 mm近红外探头(photo dynamic eye, PDE; Hamamatsu Photonics, 日本)检查肝脏。设定固定参数,对比度2.5,背景衰弱-10。在切除纤维块后立即对肝脏表面及肝门进行显像,录像1 min,待空肠后壁与肝门吻合完成(约5 min)后重复显像。
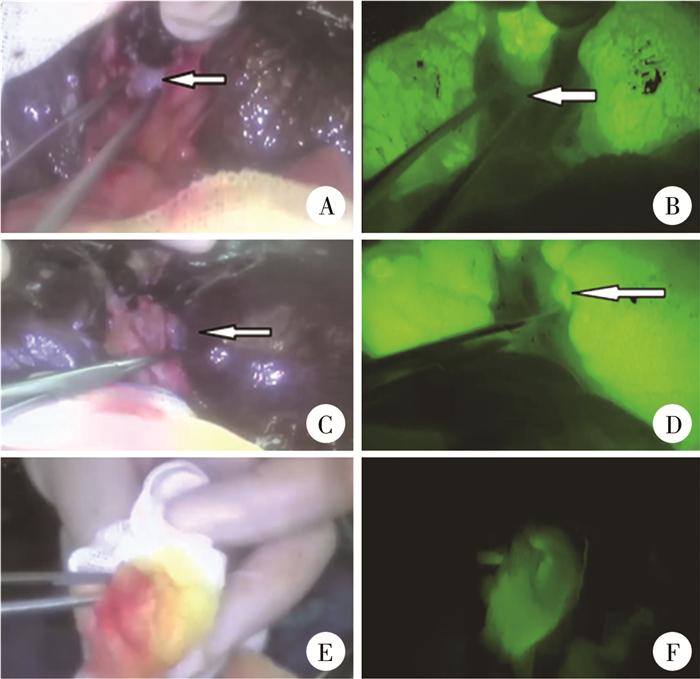
(二) 观察指标及分组1. 肝门显影速度(胆汁排泄速度):切除纤维块前,肝门部未观察到荧光,当纤维块切除后立即在肝门部显像,并蘸取肝门部分泌物进行荧光检测以验证,5 min后重复上述步骤。若初次检测即出现荧光,为快显像型(ⅰ组);若延迟至第2次显像,则为慢显像型(ⅱ组);若两次均未发现荧光,则为不显像型(ⅲ组)。见图 1。
|
图 1 胆道闭锁Kasai术中切除纤维块前后肝门荧光显像图 Fig.1 Hepatic portal fluorescent imaging during Kasai intraoperative resection of fibrous mass A:切除纤维块后的肝门;B:肝门部ICG荧光不显像;C:切除纤维块后的肝门;D:肝门部ICG显像;E:沾有肝门分泌物的纱布;F:沾有肝门分泌物的纱布荧光显像(A/C不一样,只是为了说明肝门显像) |
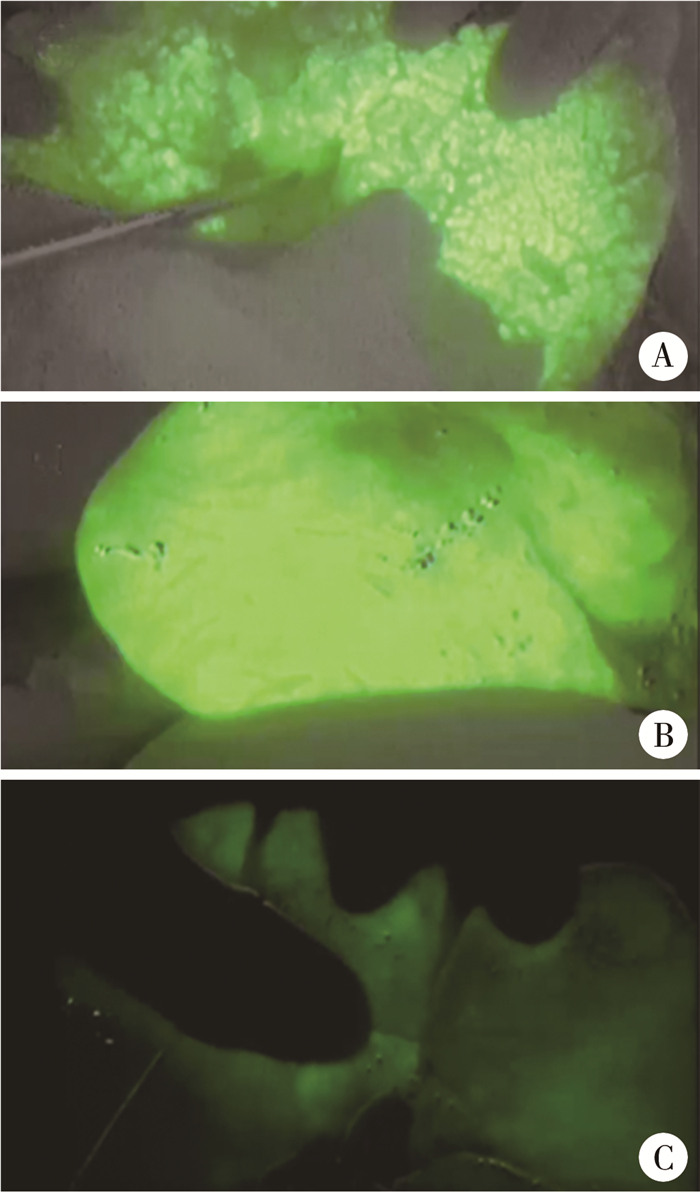
2. 肝面荧光模式(胆汁分布):切除纤维块前观察肝面荧光表现,根据肝脏表面荧光亮度分为点状荧光(A组),均匀强荧光(B组)和均匀弱荧光(C组),见图 2。
|
图 2 Kasai术中肝面荧光模式图 Fig.2 Fluorescent patterns of liver surface A:点状荧光;B:均匀强荧光;C:均匀弱荧光 |
3. 肝门荧光亮度(瞬时胆汁流量):使用近红外摄像系统自带视频亮度分析软件(ROIs系统),选取10×10的ROI采集单位(图像分析单位),分别置于肝门、肝脏表面最亮处测量,见图 3,可获得相应的亮度值ROI#1、ROI#2。计算ROI#1/2,再将第2次测量的ROI#1/2与初次ROI#1/2比较,得到肝门亮度比值比。

|
图 3 胆道闭锁Kasai术切除纤维块前后肝门亮度测量图 Fig.3 Hepatic portal brightness measurement before and after Kasai procedure for removing fibrous mass 方框为ROI测量单位,其中红色测量肝门,测得数值为ROI#1;蓝色测量肝脏表面最亮点,测得数值为ROI#2;黄色为亮度为0的调节点, 无实际意义 |
4. 患儿术前大便及术后大便荧光显像:于ICG注射后24 h内(手术前)收集一次粪便并测量荧光显像结果,不定期收集患儿术后大便进行显像。
三、手术方法及围手术期治疗患儿均由高级职称医生进行相应根治手术葛西手术(kasai portoenterostomy, KPE),所有患儿术后观察2周,常规使用三代头孢抗生素及抗厌氧菌药物,术后第4天开始口服优思弗15~20 mg· kg-1· d-1,美能2~4 mg·kg-1·d-1;每7天复查1次肝肾功能,若患儿直接胆红素较术前升高、且大便呈陶土色,则予激素冲击治疗(起始剂量为4 mg· kg-1· d-1,每3天减量1 mg·kg-1·d-1,至用量为2 mg·kg-1·d-1时改口服)。
四、随访出院后通过电话、微信、门诊进行随访,患儿术后1、3、6、12个月常规复查血常规、肝肾功能、凝血功能及腹部B超。随访时间截至2021年6月,早期预后指标为术后6个月退黄率(jaundice clearance rate, JCR)(总胆红素小于2 mg/L为黄疸消退),术后3个月退黄率(随访率97.7%)和术后1年自体肝生存率(native liver survival, NLS)(随访率90.8%)。
五、统计学处理使用SPSS 20.0进行统计学分析,对符合正态分布连续数据用均值加减标准差表示,两组之间数据比较采用独立样本t检验,三组数据总体均值比较采用方差分析;两组或多组间分类变量分布差异使用卡方检验;多重测量数据使用Stata/MP 16进行多水平混合效应模型分析,生存数据采用Cox回归,P < 0.05为差异有统计学意义。
结果 一、一般资料2019年11月至2020年5月本院共收治97例Ⅲ型胆道闭锁患儿,按纳入标准, 10例被排除,其余87例患儿参与了这项研究。其中男38例,女49例,手术日龄(60.49±20.75)d,体重(4.83±0.76)kg。所有患儿在注射ICG后未出现发热、皮疹、过敏等不良反应。
二、Kasai术中使用ICG后的肝脏荧光显像特点与胆道闭锁早期退黄的关系 (一) ICG肝门显像反映胆汁排泄速度本研究中,患儿术中ICG显像为快显像型66例(ⅰ组),慢显像型5例(ⅱ组),不显像型16例(ⅲ组)。三组患儿基本情况比较,差异无统计学意义(P>0.05);ⅰ组、ⅱ组、ⅲ组患儿术后3个月及6个月退黄率比较,差异无统计学意义(P>0.05),见表 1。
| 表 1 Kasai术中肝门ICG显像分组胆道闭锁患儿一般资料比较 Table 1 Comparison of general data of children grouped by Kasai intraoperative hepatic portal ICG imaging |
|
|
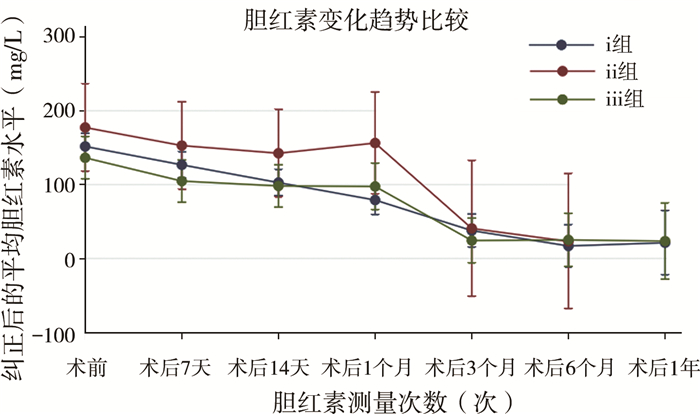
以术前直接胆红素为基准(t1),比较三组患儿术后7 d(t2)、14 d(t3)、1个月(t4)、3个月(t5)、6个月(t6)5个时间点的直接胆红素(direct bilirubin, DB)水平,结果显示三组之间初始胆红素水平无明显差异。以实时直接胆红素数值(t)作为被解释变量,以分组(ⅰ组,ⅱ组,ⅲ组)和检验次数(j)的交乘项建立胆红素-时间相关多水平混合效应模型,ⅰ组和ⅲ组术后各时间点胆红素均较术前下降;ⅱ组t2、t3、t4时点胆红素数值较t1增加,术后1个月胆红素未见明显下降;三组患儿术后胆红素总体下降趋势无明显差异(P=0.0641),见图 4。
|
图 4 胆道闭锁Kasai手术患儿肝门显像亚组间术后胆红素变化趋势图 Fig.4 Trends in postoperative bilirubin changes in children between subgroups of hepatic portal imaging 注 ⅰ: 快显像型;ⅱ:慢显像型;ⅲ:不显像型 |
本研究患儿术中肝面为点状荧光33例(A组),均匀强荧光40例(B组)和均匀弱荧光14例(C组)。三组患儿性别、术前胆红素以及白蛋白水平比较,差异无统计学意义(P>0.05);A组、B组、C组患儿术后3个月及6个月退黄率比较,差异无统计学意义(P>0.05),见表 2。
| 表 2 Kasai术中肝面ICG荧光模式分组患儿一般资料比较 Table 2 Comparison of general data of children grouped by Kasai intraoperative liver surface ICG fluorescent pattern |
|
|
各组各时间点DB的平均值差异无统计学意义,总体均呈胆红素下降趋势,且下降速度相似(P=0.923),见图 5。

|
图 5 Kasai术中肝面荧光模式亚组间术后胆红素变化趋势图 Fig.5 Trends in postoperative bilirubin changes in children between subgroups of hepatic portal imaging liver surface ICG fluorescent pattern 注 A组为点状荧光组; B组为均匀强荧光组; C组为均匀弱荧光组 |
本研究按照术后3个月、6个月是否退黄分组(3个月退黄,n=43;未退黄,n=44;6个月退黄,n=52;未退黄,n=35)比较两个时间段退黄组与未退黄组患儿术中肝门部亮度比值比,结果显示差异均无统计学意义(P=0.862,P=0.432)。根据术后14 d、术后1个月胆红素是否较术前下降分组(术后14 d下降70例,未下降17例;术后1个月下降75例,未下降12例)比较肝门部亮度比值比,结果显示,两组两个时间段的差异均无统计学意义(P=0.210,P=0.091)
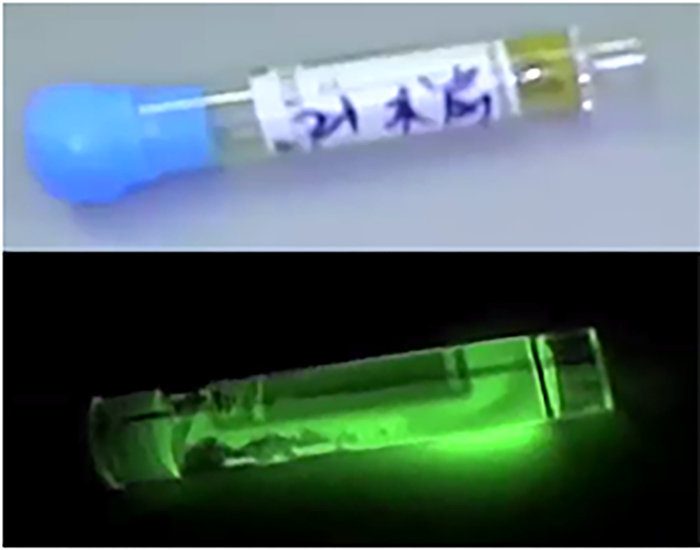
三、患儿大便荧光显像共收集到胆道闭锁患儿大便36例,其中32例术前荧光显像(图 6),术后大便荧光消退时间3~14 d。以5例胆总管囊肿患儿大便为对照,其中4例术前可见荧光显像,术后荧光显像未检测。
|
图 6 胆道闭锁患儿术前大便荧光显像图 Fig.6 Preoperative fluoroscopic image of stool in a BA child |
使用Cox多因素回归分析预后结果,分类变量以第一个哑变量为参考。结果显示,手术日龄、术前直接胆红素数值、术后3个月退黄、术中肝门部荧光显像快慢、肝面荧光显像特点以及肝门部亮度比值比不是胆道闭锁患儿Kasai术后一年生存率的影响因素。术后6个月退黄是影响术后1年自体肝生存率的独立预测因素(P=0.023),术后6个月未退黄患儿与退黄患儿相比,需要肝移植或死亡的风险更高,风险比(hazard ratio, HR)=15.415(95%CI : 1.468~161.895)。按照术中肝门ICG显像分组的ⅰ、ⅱ、ⅲ组患儿术后一年自体肝生存率分别为62.1%、40%和56.3%(χ2=1.165,P=0.573)。按照术中肝面荧光模式分组的A、B、C组患儿术后一年自体肝生存率分别为54.5%、62.5%和64.3%(χ2=0.617,P=0.734)。
讨论ICG是目前唯一被批准使用在人体的荧光引导造影剂,只在胆汁中排泄,无肝肠循环、淋巴逆流[2-3]。静脉内给药时,ICG大部分与蛋白质结合在血管内,并被肝脏清除,血管内半衰期约3 min,可用于评估血流量、定位肿瘤、观察胆瘘、测定肝功能、识别肝衰竭和指导肝硬化肝切除的范围[4-9]。
在胆道闭锁诊断中,尹强[10]建议对怀疑BA或胆道变异的患儿可于术中使用ICG造影确定病变情况;该方法与传统碘水造影相比,耗时少,辐射量小。在使用ICG评估术中胆汁引流、术后退黄和自体肝生存的关系方面,Hirayama等[1]率先使用ICG观察BA肝门处显像特点并对KPE术后大便荧光检测观察胆汁引流情况。Yanagi等[2]使用相同方法,比较是否使用ICG对患儿术后退黄的影响,发现ICG组整体退黄率较未使用者高。
本试验中肝门显像的分组方式与文献报道不同。与Hirayama等[1]研究相同的是患儿术后半年退黄率60%左右,但并未发现胆汁流动速度快与退黄之间的优势关系。退黄率方面ⅰ组,ⅱ组,ⅲ组KPE术后3个月退黄率分别为51.1%,20%,50%,三组总体退黄率差异无统计学意义(P=0.499)。ⅱ组退黄率仅20%,推测可能与肝门部的微小胆管分布、直径、数量和总面积相关。此外日本胆道闭锁中心(Japanese Biliary Atresia Registry, JBAR)的JBAS分类标准将Ⅲ型胆道闭锁根据肝板结构分为γ、μ、ν、o四型,且各组间术后JCR差异有统计学意义(γ:56.0%,μ:59.1%,ν:62.1%,ο:41.7%;P=0.0148)[11]。受肝脏荧光背景影响,本试验ICG模式下并不能区分上述四种亚型,也就无法确定ⅱ组是否属于特殊类型BA。据报道,Kasai术后胆汁流量与肝纤维化程度以及胆管和集合管的存在及大小相关;纤维块内残存胆管越多,胆管可测量的最大外径越大,胆管存在越少的增殖,都被认为与预后成正相关;也有研究发现胆管总面积超过50 000 μm2的人更易达到胆汁流动[12-14]。当然,由于术后3个月ⅱ组退黄仅1例,有可能因为个体差异,但是如果能进一步研究ⅱ组纤维块和肝内胆管的显微结构,可能会得出更好的解释。在肝面荧光模式的分类上,根据肝面荧光表现分为点状荧光,均匀强荧光和均匀弱荧光三组,这与Hirayama等[1]观察到的荧光表现一样,假设术前肝门处纤维块完全封闭出口或术中胆汁排泄较少的患儿,肝面的整体荧光强度增高,术后退黄失败而需肝移植可能性大,Hirayama等[1]研究中仅有一例证明,但课题数据并不支持假设结果。这种结果的差异,可能与样本量差异相关,也可能是ICG荧光显像原理所致。ICG被激发后的近红外光可穿透5 mm×10 mm的结缔组织,因此被观察到的单位面积内的光亮度实际是以单位表面积为底,高约5 mm×10 mm的组织长方体的亮度和。因此使用肝面荧光分布模拟胆汁分布受组织厚度、荧光浓度等多种客观条件制约,其对预后的影响意义可能有待商榷。为了客观计算胆汁流量,消除个体差异,本实验限制肝门观测面积计算肝门的亮度值,与同一肝面最亮的点对比得出肝门亮度值比。5 min后再次测量,将第二次肝门亮度值比与初次相比较,若比值比大于1,则说明肝门处的胆汁流量增加。但统计学结果并未发现其与预后的相关性。
胆道闭锁术后家属情绪受黄疸消退时间快慢的影响,尤其是在术后1个月内。本研究中,快显像组,慢显像组和不显像组术后退黄速度不一致。慢显像型患儿术后1周、2周、1个月时复查直接胆红素均较术前增高或持平,但后期3~6个月胆红素快速下降并达到其他几组水平。比较术后3个月和6个月退黄率,我们发现,显像组(快显像组、慢显像组)的退黄比例随时间不断增长,尤其是慢显像组从20%增长至60%,不显像组尽管术后早期退黄比例较高,但其退黄比例增高有限。因此对于术中发现慢排泄型患儿,需告知家属其黄疸需要更长的消退时间,而对不排泄型患儿,若3个月黄疸未能消退,则告知后期黄疸继续消退的可能性较低。当然本组病例数较少,仅供临床参考。但BA患儿的生存状态确实受退黄速度的影响,退黄越早,自体肝生存越易实现。有研究表明术后7天总胆红素下降20%以上者,1年NLS可达85%, 术后4周内退黄率可预测5年NLS(风险比为0.089)[15-16]。术后3个月是否退黄2年NLS差异显著(86%vs.20%), 6个月内JCR的患儿占所有2年NLS患儿的72%,占5年NLS患儿的45.7%[17-18]。因此慢显像组之后的生存情况如何,还需累积病例长期观察。
利用ICG在Kasai术中测量瞬时胆汁流速,胆汁分布和胆汁量都无法预测BA短期结果,预后可能与多因素相关。Takimoto等[19]发现Kasai术后发生肠梗阻的患儿黄疸持续时间长,且自体肝生存率较低。与非肠梗阻患儿相比,即使达到完全的黄疸消退,术后2年内肝移植概率是非肠梗阻患儿的3.81倍。Chen[20]发现在其研究时间内术后接受肝移植的患儿,术后胆管炎的发病率和术后2年内累积胆管炎的发病次数较自体肝存活组更高。此外,多数文献中均有提及,KPE术后6个月的血清总胆红素水平的评估是BA预后的重要预测指标,本研究也证实术后6个月退黄为影响术后1年自体肝生存的独立预测因素(P=0.023)[21]。
本研究中几乎全部BA患儿术前大便均有较强的荧光显像,这与既往文献报道有一定出入。理论上静脉注射的ICG以两种形式在血液中运输,98%的染料与血清蛋白结合。未结合的ICG会被肝脏迅速从血管系统中清除,并通过蛋白质谷胱甘肽S-转移酶未经修饰运输到胆汁中[22]。即使从间质中注射,ICG在经过淋巴系统和血管系统后,最终都会通过胆汁从体内排泄[23]。本实验中大便荧光显像的原因,作者认为可能有以下几个方面的解释:①Ⅲ型胆道闭锁的患儿肝内外胆道并不是完全堵塞。多数患儿术前大便颜色为浅黄和黄绿色,很少有人完全达到陶土色,说明多数患儿胆道通而不畅而不是完全闭锁。②淋巴液排泄ICG:在文献中淋巴液显像可能通过EPR(enhanced permeability and retention effect, EPR)效应,也称增强渗透滞留效应,是指一些特定大小的大分子物质(如脂质体、纳米颗粒以及一些大分子药物)更容易渗透进入肿瘤组织并长期滞留(和正常组织相比)的现象[24]。对于BA患儿,肝内胆管系统高压,脉管区炎症浸润,淤积胆汁长期损害胆管上皮,这可能致使ICG分子流入组织中被淋巴吸收,从而通过淋巴系统排入肠管与大便混合。此外ICG在淋巴系统存留时间较长,这也解释了为什么Kasai手术后患儿大便荧光消失时间较长。③胆道闭锁患儿可能有其他ICG排泄或肝肠循环途径,需要进一步探讨[25]。
Yaseen等[26]比较了10例术中使用ICG胆道造影和35例不使用ICG的BA患儿术后退黄情况,结果发现前者退黄率明显高于后者(1.0比0.65,P<0.05),他认为尽管病例数较少,但ICG可能会改善BA术后近期效果。由于时间问题,本研究并未对此进行证实。此外,ICG也是一种光敏剂,有研究表明ICG在808 nm的激光照射下可观察到明显热毒性,对靶细胞产生破坏。EVA对ICG光分解的研究中,他发现ICG分子在足够的光吸收后会产生有毒性的分解产物,这些光源包括激光、手术灯、阳光等,在体外实验中与分解产物一起孵育的视网膜色素上皮细胞活力明显降低[22]。但作者也并未找到关于ICG损伤肝胆系统的相关报道。因此,使用ICG的患儿在手术灯光下的暴露是否造成了肝脏的进一步损伤还需进一步研究。
BA总体治疗失败率约25%,在其他75%中,它究竟如何将胆汁排入肠道,并不清楚。多数文献中将KPE血液中总胆红素清除作为胆汁流动的指标,也有人尝试直接测量胆道引流液中的胆汁色素和脂质,或使用肝胆显像直观证明胆汁流动[27-29]。利用ICG观察患儿术后大便荧光消退与血液中胆红素下降是否存在相关性,能否成为无创性监测指标,还有待进一步研究。
综上所述,我们的研究是目前为止样本量最大的ICG在BA患儿中的预后研究发现,Ⅲ型BA术中肝脏ICG显像具有多样性。ICG可显示胆汁流动,但术中瞬时检测的胆汁流速,胆汁量及胆汁分布无法稳定预测近期退黄及生存状态,以及慢显像患儿黄疸是否消退需要更长的时间。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为徐琛、汤悦,论文调查设计为徐琛、汤悦、陈功、郑珊,数据收集为朱叶、黄焱磊、杨少波、孙松、李军、刘源鑫、宋再、董晨彬,论文结果撰写为徐琛,论文讨论分析为徐琛、陈功
| [1] |
Hirayama Y, Iinuma Y, Yokoyama N, et al. Near-infrared fluorescence cholangiography with indocyanine green for biliary atresia.Real-time imaging during the Kasai procedure: a pilot study[J]. Pediatr Surg Int, 2015, 31(12): 1177-1182. DOI:10.1007/s00383-015-3799-4 |
| [2] |
Yanagi Y, Yoshimaru K, Matsuura T, et al. The outcome of real-time evaluation of biliary flow using near-infrared fluorescence cholangiography with Indocyanine green in biliary atresia surgery[J]. J Pediatr Surg, 2019, 54(12): 2574-2578. DOI:10.1016/j.jpedsurg.2019.08.029 |
| [3] |
Reinhart MB, Huntington CR, Blair LJ, et al. Indocyanine green: historical context, current applications, and future considerations[J]. Surg Innov, 2016, 23(2): 166-75. DOI:10.1177/1553350615604053 |
| [4] |
Goldstein SD, Heaton TE, Bondoc A, et al. Evolving applications of fluorescence guided surgery in pediatric surgical oncology: A practical guide for surgeons[J]. J Pediatr Surg, 2021, 56(2): 215-223. DOI:10.1016/j.jpedsurg.2020.10.013 |
| [5] |
Cho YJ, Namgoong JM, Kwon HH, et al. The advantages of indocyanine green fluorescence imaging in detecting and treating pediatric hepatoblastoma: a preliminary experience[J]. Front Pediatr, 2021, 9: 635394. DOI:10.3389/fped.2021.635394 |
| [6] |
Leon P, Panaro F. Intra-operative trans-cystic indocyanine green (ICG) cholangiography: a high-sensitive method to identify bile leakage after hepatic resection[J]. Hepatobiliary Surg Nutr, 2020, 9(2): 260-262. DOI:10.21037/hbsn.2019.12.08 |
| [7] |
Nielsen J, Nerup N, Møller S, et al. Minimally invasive assessment of hepatic function in children with indocyanine green elimination: a validation study[J]. Scand J Gastroenterol, 2019, 54(4): 485-491. DOI:10.1080/00365521.2019.1591497 |
| [8] |
Quintero J, Miserachs M, Ortega J, et al. Indocyanine green plasma disappearance rate: a new tool for the classification of paediatric patients with acute liver failure[J]. Liver Int, 2014, 34(5): 689-694. DOI:10.1111/liv.12298 |
| [9] |
Chan A, Kow A, Hibi T, et al. Liver resection in Cirrhotic liver: Are there any limits?[J]. Int J Surg, 2020, 82S: 109-114. DOI:10.1016/j.ijsu.2020.06.050 |
| [10] |
尹强. 吲哚菁绿荧光成像技术在小儿外科领域的应用与局限[J]. 临床小儿外科杂志, 2021, 20(10): 901-905. Yin Q. Application and prospect of indocyanine green fluorescence imaging in pediatric surgery[J]. J Clin Ped Sur, 2021, 20(10): 901-905. DOI:10.12260/lcxewkzz.2021.10.001 |
| [11] |
Sasaki H, Nio M, Ando H, et al. Anatomical patterns of biliary atresia including hepatic radicles at the porta hepatis influence short- and long-term prognoses[J]. J Hepatobiliary Pancreat Sci, 2021, 28(11): 931-941. DOI:10.1002/jhbp.989 |
| [12] |
Morecki R, Glaser JH, Cho S, et al. Biliary atresia and reovirus type 3 infection[J]. N Engl J Med, 1982, 307(8): 481-484. DOI:10.1056/NEJM198208193070806 |
| [13] |
Mirza Q, Kvist N, Petersen BL. Histologic features of the portal plate in extrahepatic biliary atresia and their impact on prognosis-a Danish study[J]. J Pediatr Surg, 2009, 44(7): 1344-1348. DOI:10.1016/j.jpedsurg.2008.11.054 |
| [14] |
Matsuo S, Ikeda K, Yakabe S, et al. Histological study of the remnant of porta hepatis in patients with extrahepatic biliary atresia-A computed picture analysis of 30 cases[J]. Z Kinderchir, 1984, 39(1): 46-49. DOI:10.1055/s-2008-1044168 |
| [15] |
Chusilp S, Sookpotarom P, Tepmalai K, et al. Prognostic values of serum bilirubin at 7th day post-Kasai for survival with native livers in patients with biliary atresia[J]. Pediatr Surg Int, 2016, 32(10): 927-931. DOI:10.1007/s00383-016-3951-9 |
| [16] |
Wang Z, Chen Y, Peng C, et al. Five-year native liver survival analysis in biliary atresia from a single large Chinese center: The death/liver transplantation hazard change and the importance of rapid early clearance of jaundice[J]. J Pediatr Surg, 2019, 54(8): 1680-1685. DOI:10.1016/j.jpedsurg.2018.09.025 |
| [17] |
Shneider BL, Magee JC, Karpen SJ, et al. Total serum bilirubin within 3 months of hepatoportoenterostomy predicts short-term outcomes in biliary atresia[J]. J Pediatr, 2016, 170: 211-217.e1-2. DOI:10.1016/j.jpeds.2015.11.058 |
| [18] |
Chiang LW, Lee CY, Krishnaswamy G, et al. Seventeen years of Kasai portoenterostomy for biliary atresia in a single Southeast Asian paediatric centre[J]. J Paediatr Child Health, 2017, 53(4): 412-415. DOI:10.1111/jpc.13379 |
| [19] |
Takimoto A, Sumida W, Amano H, et al. Postoperative intestinal obstruction in patients with biliary atresia impedes biliary excretion and results in subsequent liver transplantation[J]. Pediatr Surg Int, 2021, 37(2): 229-234. DOI:10.1007/s00383-020-04807-9 |
| [20] |
Chen SY, Lin CC, Tsan YT, et al. Number of cholangitis episodes as a prognostic marker to predict timing of liver transplantation in biliary atresia patients after Kasai portoenterostomy[J]. BMC Pediatr, 2018, 18(1): 119. DOI:10.1186/s12887-018-1074-2 |
| [21] |
Du M, Wang J, Tang Y, et al. Evaluation of perioperative complications in the management of biliary atresia[J]. Front Pediatr, 2020, 8: 460. DOI:10.3389/fped.2020.00460 |
| [22] |
Engel E, Schraml R, Maisch T, et al. Light-induced decomposition of indocyanine green[J]. Invest Ophthalmol Vis Sci, 2008, 49(5): 1777-1783. DOI:10.1167/iovs.07-0911 |
| [23] |
Nimura H, Narimiya N, Mitsumori N, et al. Infrared ray electronic endoscopy combined with indocyanine green injection for detection of sentinel nodes of patients with gastric cancer[J]. Br J Surg, 2004, 91(5): 575-579. DOI:10.1002/bjs.4470 |
| [24] |
姚伟, 董岿然. 荧光引导技术在儿童肿瘤手术中的应用及展望[J]. 临床小儿外科杂志, 2021, 20(10): 906-910. Yao W, Dong KR. Applications and future prospects of fluorescence guided surgery for pediatric tumors[J]. J Clin Ped Sur, 2021, 20(10): 906-910. DOI:10.12260/lcxewkzz.2021.10.002 |
| [25] |
Kwon IG, Son T, Kim HI, et al. Fluorescent lymphography-guided lymphadenectomy during robotic radical gastrectomy for gastric cancer[J]. JAMA Surg, 2019, 154(2): 150-158. DOI:10.1001/jamasurg.2018.4267 |
| [26] |
Yaseen MA, Yu J, Jung B, et al. Biodistribution of encapsulated indocyanine green in healthy mice[J]. Mol Pharm, 2009, 6(5): 1321-1332. DOI:10.1021/mp800270t |
| [27] |
Dolgin SE. Answered and unanswered controversies in the surgical management of extra hepatic biliary atresia[J]. Pediatr Transplant, 2004, 8(6): 628-631. DOI:10.1111/j.1399-3046.2004.00243.x |
| [28] |
Lilly JR, Javitt NB. Biliary lipid excretion after hepatic portoenterostomy[J]. Ann Surg, 1976, 184(3): 369-375. DOI:10.1097/00000658-197609000-00014 |
| [29] |
Castagnetti M, Davenport M, Tizzard S, et al. Hepatobiliary scintigraphy after Kasai procedure for biliary atresia: clinical correlation and prognostic value[J]. J Pediatr Surg, 2007, 42(6): 1107-1113. DOI:10.1016/j.jpedsurg.2007.01.063 |
 2022, Vol. 21
2022, Vol. 21


