FAVA英文全称为fibro-adipose vascular anomaly,由Alomari等[1]于2014年首次详细描述并命名,国内尚无统一的翻译名称,暂称为纤维脂肪血管病变。该病在国际血管异常研究学会(International Society for the Study of Vascular Anomalies, ISSVA)2018年分类中被划入暂未归类的血管异常类型,即不属于血管肿瘤或脉管畸形[2]。FAVA发病率尚不清楚,据波士顿儿童医院血管瘤与脉管畸形中心的回顾性资料,FAVA在血管瘤与脉管畸形中的占比低于1%,属于罕见疾病[3-4]。FAVA的高发年龄在9~12岁,也可迟至30岁发病,表现为患肢肌肉局部肿块,伴有明显疼痛、相应肌肉肌腱挛缩、关节活动障碍和畸形[1, 4-5]。该病与其他脉管疾病常难以鉴别,患儿常就诊于介入科、骨科等,误诊率极高,多被诊断为静脉畸形、肌间血管瘤、肌肉血管瘤等[1, 3-4]。本文旨在初步探讨FAVA的诊断要点和治疗原则,以降低误诊率,改善预后。
材料与方法回顾性分析2019年9月至2020年12月西安国际医学中心医院小儿外科收治的FAVA病例资料,总结患儿性别、初诊年龄、临床表现、病变范围、前期诊断与治疗、影像学特点、治疗方法、病理特点、康复和随访计划。该研究已征得西安国际医学中心伦理审查委员会同意(伦理审批编号:2021-0017)
共13例在本中心诊治(表 1)。前期诊断包括:静脉畸形(n=8)、肌间血管瘤(n=2)、肌肉淋巴管畸形(n=1)、动静脉畸形(n=1)和海绵状血管瘤(n=1)。无一例在就诊前确诊为FAVA。
| 表 1 13例FAVA患儿的临床资料 Table 1 Clinical profiles of FAVA cohort |
|
|
根据患儿就诊时情况制定个体化治疗方案,包括术前口服西罗莫司和功能锻炼、手术切除、功能重建、术后口服西罗莫司和康复锻炼。
术前准备:结合病史和体格检查,初步定位受累肌群/肌肉;根据MRI图像确定具体受累肌肉和范围,拟定手术切除范围与功能重建方法。
FAVA诊断标准:①缓慢生长的肿块伴有疼痛和(或)挛缩;②MRI平扫见肌肉内弥漫性不均匀长短混杂信号病变,伴静脉扩张;③病理学检查病变以实性为主,浸润肌肉,可见异常静脉、纤维和脂肪组织增生伴淋巴浆细胞浸润[1]。
结果 一、临床特征男4例,女9例。出生时均未发现病变。发病年龄0~15岁;诊断年龄1岁2个月至18岁,平均诊断年龄10岁。下肢病变11例,上肢2例。无一例累及躯干。
初始表现为疼痛和局部肿胀(包块)。疼痛呈自发性持续钝痛,活动后加剧,按压或触碰后剧烈疼痛。5例伴有肿胀处皮肤感觉过敏,即使无意的衣裤摩擦也会疼痛难忍。患儿在日常活动中倾向于健侧用力,避免患肢活动。经过数月至数年的发展,逐渐出现患肢变细(废用性肌肉萎缩)、关节活动障碍、关节强直。11例伴社交活动减少,患儿有强烈自卑感,与同龄人交往减少。
二、影像学特点所有患儿行MRI平扫检查。MRI特征(图 1):疼痛对应区域脂肪层增厚,肌肉内和皮下静脉扩张;病变肌肉肿胀,周围肌肉受挤压而移位变薄。T1加权像见病变位于肌肉内,并沿受累肌肉-肌腱连续分布,可跨关节分布。T2抑脂序列可见水样长信号与被抑制的脂肪信号和其他短信号混杂;肌筋膜可受累增厚且不连续,病变跨筋膜分布(图 2);部分病例伴骨髓水肿。
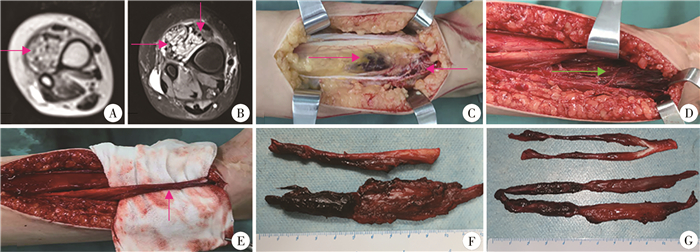
|
图 1 纤维脂肪血管病变(FAVA)患儿小腿部位的MRI表现、术中所见和大体病理标本 A:T1加权像可见病变位于趾长伸肌和踇长伸肌,病变呈弥漫性长信号脂肪影与短信号混杂; B:T2抑脂序列可见病变呈水样长信号与被抑制的脂肪信号和其他短信号混杂,病变区域脂肪层较正常区域增厚;趾长伸肌和踇长伸肌肿胀(横箭头),胫前肌受挤压而移位变薄(竖箭头);骨间膜增厚; C:切开皮肤、脂肪层和肌筋膜后,见趾长伸肌正常肌肉外观消失,被纤维组织、脂肪和静脉病变浸润(向右箭头),纤维脂肪组织和黑色静脉团累及并突破部分肌筋膜(向左箭头); D:趾长伸肌切除后,可见踇长伸肌和骨间膜受累; E:踇长伸肌及肌腱受累,呈黑色外观; F、G:切除的趾长伸肌和踇长伸肌及肌腱,可见正常肌腱质地和色泽消失,肌纹理消失,被质硬的纤维脂肪组织和成团的静脉病变浸润代替 Fig.1 MRI features, intraoperative findings and gross specimens of FAVA in calf |
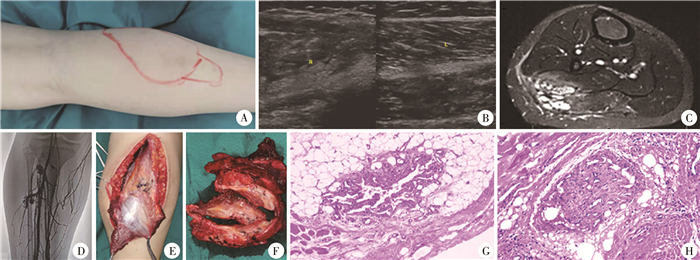
|
图 2 纤维脂肪血管病变(FAVA)患儿小腿部位的外观、影像学表现、术中所见和病理 A:外观可见小腿上段后方偏外侧局部隆起; B:两侧对比检查,超声检查可见受累肌肉的正常纹理消失,被实性、回声不均匀的组织代替,不可压缩,与正常肌纹理分界不清; C:MRI T2抑脂序列可见病变累及腓肠肌外侧头和比目鱼肌外侧,跨过腓肠肌与比目鱼肌之间的筋膜;呈水样长信号与短信号混杂; D:静脉造影见病变区域内静脉扩张、增多;深静脉正常; E:切开腓肠肌外侧头后,见比目鱼肌外侧表面附着簇状“蛙卵样”静脉团;病变呈跨筋膜累及,导致腓肠肌与比目鱼肌不能分离; F:腓肠肌外侧头和比目鱼肌外侧部分完整切除标本剖面观。病变部分质硬,表面可见簇状“蛙卵样”静脉团,剖面呈灰黄色,肌纹理消失,由纤维-脂肪和静脉病变浸润替代,与正常肌肉界限不清;肌肉之间的筋膜受累而不完整,病变跨筋膜分布; G、H:FAVA的镜下病理所见,增生的纤维和脂肪组织浸润骨骼肌和筋膜,纤维组织有明显的玻璃样变;骨骼肌内有明显异常的血管,被纤维脂肪组织包围[HE染色,×40(G), ×100(H)] Fig.2 Outer appearances, imaging features, intraoperative findings and histopathology of FAVA in calf |
超声检查(n=10)可见皮下脂肪增厚,病变肌肉内可见回声不均匀的实性肿物,正常肌纹理消失,与正常肌肉分界不清,不可压缩(图 2)。病变肌肉内动脉无异常,可见肌肉内静脉扩张。
X线平片(n=6)异常发现包括:骨皮质增厚、骨盆倾斜、下肢不等长、骨骼变形、骨密度减低、关节间隙变窄(图 3)。
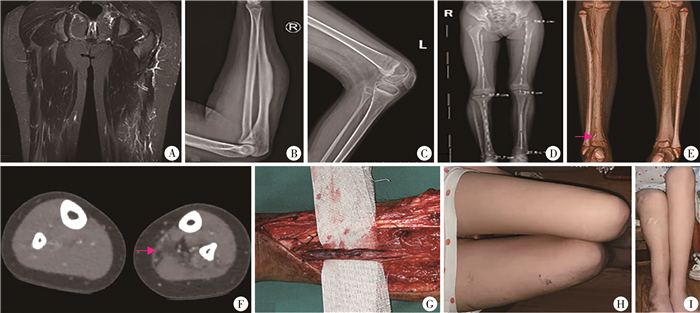
|
图 3 纤维脂肪血管病变(FAVA)患儿的其他表现 A:累及股二头肌患儿,MRI T2抑脂序列可见病变区域皮肤皮下和肌肉内静脉增多、扩张; B:1例上肢尺侧腕伸肌FAVA患儿,X线片示尺骨皮质局部增厚; C:1例FAVA累及股二头肌和髂胫束导致膝关节屈曲畸形患儿,X线片示骨皮质变薄,密度减低; D:病例5,X线片提示骨盆倾斜、下肢不等长、患侧腓骨变形; E:病例5,CT增强可见病变区域内动脉分支细少,有扩张静脉(箭头);还可见腓骨变形和小腿变细; F:病例5,CT增强可见病变区域内静脉增多,弥漫分布密度不均的低密度影取代了正常的比目鱼肌;肌群整体较健侧变薄、变小; G:病例5,术中见胫神经受累; H和I:1例股二头肌和小腿后侧肌群FAVA患儿,大腿和小腿均明显短缩 Fig.3 Miscellaneous findings of FAVA |
CT检查(n=2)异常表现包括:患侧肌肉萎缩变小;病变肌肉密度不均,其内可见散在低密度影,与脂肪密度相近(图 3)。增强CT(n=1)可见受累肌群动脉分支细小,肌肉区域内可见扩张静脉。
血管造影(n=8)表现:无动静脉分流,深静脉正常,病变肌肉内和皮下有静脉扩张(图 3)。
三、术中所见未见病灶累及皮肤及皮下脂肪层。切开病变肌肉表面皮肤时可见脂肪层增厚(图 1)。受累肌肉的肌筋膜亦受累,表现为筋膜增厚、筋膜内有散在黑点状静脉病变和脂肪浸润(图 2)。切开肌筋膜后可见病变分两部分,即肌肉肌腱外附着的黑色成团病变和肌肉肌腱内病变(图 1、图 2)。前者紧贴肌肉肌腱,沿肌间隙、神经血管束分布,呈簇状的“蛙卵样”静脉团,黑色外观。可突出筋膜外,使肌肉无完整筋膜。该组织质脆、易出血、不易止血。筋膜受累在肌腱附着处、关节附近尤为明显,表现为明显增厚、筋膜内密集黑点状静脉病变和显著的脂肪浸润(图 1)。肌肉内病变质硬、边界不清,可见明显的脂肪沉积和纤维化(图 1)。切开肌肉可见海绵状静脉窦结构,不易止血;电刺激时肌肉收缩减弱。未发现病变穿透骨间膜,侵及对侧肌群者。病变亦可累及骨膜,受累骨膜明显增厚纤维化(图 3)。如病变累及神经外膜、浸润神经,神经束表现为明显增粗,呈蓝黑色外观,可见到神经内散在黑点状静脉病变(图 3)。
手术治疗12例(表 1),均行根治性切除,即在保护重要血管、神经的前提下,扩大切除局限性病变;弥漫性病变则切除受累的整块肌肉和肌筋膜;如累及重要神经,则切开松解神经外膜;如有肌腱挛缩导致关节活动障碍,切除受累的整块肌肉和肌筋膜后,还需肌腱延长/转移以重建功能。12例均留置创面负压引流;肌腱延长/转移者、关节强直松解矫正者予石膏固定1~4周。关节活动障碍者,术后4周开始功能锻炼。
四、病理学特征病变主体位于肌肉内,肌肉外可附着簇状“蛙卵样”静脉团(图 2)。病变处质硬,肌肉-肌腱纹理中断消失、脂肪增多(图 1、图 2)。病变剖面呈灰黄色,可见明显的纤维组织、脂肪组织和血管病变,无明显肌纤维,与正常肌肉界限不清(图 2)。受累肌腱内可见显著脂肪浸润和静脉病变(图 1)。
镜下可见增生的致密纤维组织和脂肪,前者多集中在异常的血管周围,可呈星形放射状分布到周围的骨骼肌或脂肪中。脂肪浸润至骨骼肌。纤维组织可见明显的玻璃样变性(图 2)。不规则扩张的静脉可见肌肉化表现,血栓少见。
五、预后及随访术后随访1~16个月。1例上肢FAVA患儿口服西罗莫司后疼痛缓解,余12例均在我院行手术治疗,无明显术后并发症。手术后疼痛缓解,关节活动障碍治愈或明显好转(表 1)。
讨论FAVA的误诊率极高,波士顿儿童医院报告的19例上肢FAVA中,只有1例前期被正确诊断[4]。本中心无一例前期被正确诊断。回顾本中心病例和文献报道,我们发现大多数患儿经历了数年甚至十几年的漫长诊治历程。因此,总结FAVA的特征性诊断要点以降低误诊率、改善疗效是十分必要的。
一、临床表现、鉴别诊断和疾病分期疼痛多为该病的首发症状[1, 3-4]。疼痛为持续性,在关节活动而导致肌肉牵拉时加重,且随着疾病进展而进行性加重。浅表肌肉受累者查体可见局部肿胀,稍隆起,可触及病变质硬,压痛明显,局部按压出现剧烈疼痛,部分伴有皮肤感觉过敏,即使轻微摩擦亦可表现出明显疼痛。疼痛特点明显不同于静脉畸形疼痛,绝大多数静脉畸形不伴疼痛,偶发疼痛源于静脉压增高、局限性血管内凝血或血栓性静脉炎。疼痛多间歇性出现,程度较轻,可在过量活动、创伤后出现,疼痛部位不定。在弹力加压或休息后可缓解甚至消失。因此,持续且进行性加重的疼痛、局部显著压痛是FAVA与其他脉管疾病相鉴别的最重要特征之一。
肌肉肌腱挛缩为FAVA的另一特征性表现。FAVA病变主体位于肌肉内,随着受累肌肉进行性纤维化和脂肪沉积,肌肉会出现进行性挛缩,导致相应肌腱短缩。该病常累及小腿后侧肌群,因此会出现跟腱挛缩,早期表现为踝关节背屈部分受限以及患肢下蹲受限。被动背屈踝关节时受累肌肉被牵拉,出现小腿后侧疼痛,且该疼痛区域与压痛区域一致。如病变累及小腿前群肌肉,挛缩的早期表现为跖屈部分受限。例如,病变只累及趾长伸肌,查体可见趾长伸肌走行区压痛,跖屈时该肌腱紧绷而导致活动受限。随着疾病进展,活动范围渐渐缩小,踝关节渐接近90°。根据压痛部位和挛缩导致的关节活动障碍具体表现,大多可初步定位受累肌肉/肌群。
关节畸形为疼痛和挛缩进行性发展的结果,也是FAVA的特征性表现之一。在肌肉肌腱挛缩早期,关节活动仅部分受限。随着疾病发展,肌肉肌腱呈进行性挛缩,导致相应的关节活动范围逐渐缩小,最终出现关节强直畸形和关节完全活动障碍。
因此,根据疾病进展程度和临床表现,FAVA可分为3期:Ⅰ期(疼痛期),以疼痛为主要或唯一的临床表现,肌腱无明显挛缩,关节活动不受限;Ⅱ期(挛缩期),肌腱明显挛缩,关节活动部分受限,但无关节畸形;Ⅲ期(畸形期),关节已形成强直畸形,伴或不伴有肢体的不等长、不等粗(图 3)。要指出的是,疼痛贯穿整个病程,且呈进行性加重。FAVA的大致发展过程为:随着病变肌肉内纤维脂肪组织的过度增生,可出现早期的局部压痛。早期疼痛为病变部位的原发性疼痛,是组织内的神经末梢直接受到机械性或化学性刺激而产生的疼痛;随着病变在肌肉内逐渐浸润,疼痛范围增大,程度加重,肌肉开始出现挛缩,关节活动受限;疼痛和挛缩进一步发展,最终形成关节强直畸形。
二、继发/伴随临床表现FAVA的其他伴随症状包括患肢变细、肌肉萎缩、缩短。这些表现不会出现于静脉畸形。患肢疼痛而导致负重或用力减少,病程较长者可出现患肢整体变细、废用性肌萎缩。如病变位于小腿肌肉,长期的肌肉肌腱挛缩导致患儿在生长发育中出现相应的骨骼和肌群发育受限,可出现小腿缩短。如病变位于大腿,相应的股骨、收肌群、股四头肌等均可出现发育延迟,大腿亦可出现缩短(图 3)。X线平片检查所提示的骨皮质增厚、骨盆倾斜、下肢不等长、骨骼变形、关节间隙变窄等表现均可归因于疼痛和挛缩。骨密度减低则为骨骼的废用性萎缩表现。根据上述典型症状、体格检查和特征性的影像学表现,可临床诊断FAVA。
三、外科手术原则和康复治疗根据我们的病例和文献报道,绝大部分患儿前期接受了介入/硬化治疗,但似乎无效[1, 3-4]。我们的经验是,FAVA患儿的介入穿刺较为困难,不易直接穿刺到血管。而静脉畸形的直接穿刺介入则较容易。因此,从介入穿刺难易程度和介入/硬化治疗反应方面,也与静脉畸形不同。外科手术是FAVA的主要治疗方式[3-4]。手术原则包括:第一,明确诊断后尽早手术治疗。第二,不伴明显挛缩者,行局部扩大切除;伴明显挛缩者,切除范围包括受累的整块肌肉、肌腱、筋膜,切断受累肌肉肌腱的连续性,解除并防止进一步挛缩。但必须保护重要的神经,即使神经已受累。肌肉内实性的纤维脂肪成分须完全切除,否则术后疼痛难以改善。第三,明显挛缩者伴有关节活动障碍,切除受累的整块肌肉、肌腱、筋膜后,必要时需关节松解、肌腱延长、肌腱转移、肌瓣转移等,以重建关节功能。MRI可准确定位受累肌肉,这有助于规划治疗方案和手术切除范围。
手术后功能康复亦为治疗的重要组成部分。大部分患儿在就诊时已处于挛缩期和畸形期,关节活动已部分受限或完全强直畸形。手术解除痉挛后或功能重建后需进行康复锻炼,以恢复关节功能。康复锻炼的前提是病变已切除和疼痛消失,否则可能因康复时疼痛剧烈而无法顺利完成康复计划。
四、口服mTOR抑制剂治疗FAVA发病原因不清,目前被认为是PIK3CA突变导致的一种纤维脂肪血管病变[2, 5]。西罗莫司作为mTOR抑制剂,文献报道可有效改善疼痛[6-7]。我们的病例中,口服西罗莫司1~2周后疼痛均显著缓解。因废用性肌肉萎缩导致患肢变细者,疼痛缓解并康复锻炼后部分肌力恢复,患肢较前明显增粗至接近健侧,这为手术后肌肉功能代偿创造了条件。1例伴胫神经浸润,术后第5天出现阵发性放射痛,放射至足底,口服西罗莫司后消失,持续口服1个月停药,未再出现疼痛。文献报道冷冻消融可有效治疗FAVA,疼痛明显缓解,患儿满意度提高,但关节功能改善有限,长期疗效有待观察[8-9]。
综上,FAVA罕见且容易误诊,早期正确诊治至关重要。具体治疗方案应基于具体分期。Ⅰ期(疼痛期)宜尽早行根治性切除术。Ⅱ期(挛缩期)肌腱已有明显挛缩,关节活动部分受限,可根治性切除,必要时肌腱延长或转移。Ⅲ期(畸形期)关节已强直畸形,如果手术前患肢因废用性萎缩明显变细,可口服西罗莫司,疼痛缓解后进行有限的功能锻炼,恢复部分肌力和关节活动,择期行根治性切除、功能重建及术后康复锻炼。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为王怀杰、谢崇,论文调查设计为王怀杰、郭正团,数据收集与分析为谢崇、蔺卫龙、杨伟家和周金榜,论文结果撰写为王怀杰,论文讨论分析为谢崇、周金榜和郭正团
| [1] |
Alomari AI, Spencer SA, Arnold RW, et al. Fibro-adipose vascular anomaly: clinical-radiologic-pathologic features of a newly delineated disorder of the extremity[J]. Journal of Pediatric Orthopedics, 2014, 34(1): 109-117. DOI:10.1097/BPO.0b013e3182a1f0b8 |
| [2] |
刘文英. 脉管异常类疾病的分类及相关临床问题[J]. 临床小儿外科杂志, 2019, 18(8): 621-625. Liu WY. Classifications and clinical managements of vascular abnormalities[J]. J Clin Ped Sur, 2019, 18(8): 621-625. DOI:10.3969/j.issn.1671-6353.2019.08.001 |
| [3] |
Cheung K, Taghinia AH, Sood RF, et al. Fibroadipose vascular anomaly in the upper extremity: a distinct entity with characteristic clinical, radiological, and histopathological findings[J]. The Journal of Hand Surgery, 2020, 45(1): 68.e1-e13. DOI:10.1016/j.jhsa.2019.05.008 |
| [4] |
Wang KK, Glenn RL, Adams DM, et al. Surgical management of fibroadipose vascular anomaly of the lower extremities[J]. Journal of pediatric orthopedics, 2020, 40(3): e227-e236. DOI:10.1097/BPO.0000000000001406 |
| [5] |
Lindhurst MJ, Parker VER, Payne F, et al. Mosaic overgrowth with fibroadipose hyperplasia is caused by somatic activating mutations in PIK3CA[J]. Nature Genetics, 2012, 44(8): 928-933. DOI:10.1038/ng.2332 |
| [6] |
Erickson J, McAuliffe W, Blennerhassett L, et al. Fibroadipose vascular anomaly treated with sirolimus: Successful outcome in two patients[J]. Pediatric Dermatology, 2017, 34(6): e317-e320. DOI:10.1111/pde.13260 |
| [7] |
Hori Y, Hirose K, Aramaki-Hattori N, et al. Fibro-adipose vascular anomaly(FAVA): three case reports with an emphasis on the mammalian target of rapamycin(mTOR)pathway[J]. Diagnostic Pathology, 2020, 15(1): 98. DOI:10.1186/s13000-020-01004-z |
| [8] |
Shaikh R, Alomari AI, Kerr CL, et al. Cryoablation in fibro-adipose vascular anomaly(FAVA): a minimally invasive treatment option[J]. Pediatric Radiology, 2016, 46(8): 1179-1186. DOI:10.1007/s00247-016-3576-0 |
| [9] |
Ramaswamy RS, Tiwari T, Darcy MD, et al. Cryoablation of low-flow vascular malformations[J]. Diagn Interv Radiol, 2019, 25(3): 225-230. DOI:10.5152/dir.2019.18278 |
 2022, Vol. 21
2022, Vol. 21


