慢性胰腺炎是一种胰腺组织和功能损伤均不可逆的慢性炎症性疾病。儿童慢性胰腺炎临床发病率低,缺乏特异性表现,潜在危害较大,主要临床表现为顽固性反复腹痛。一旦胰腺形态出现较为明显的改变,将导致胰腺内分泌、外分泌功能永久性下降甚至丧失。对于内科治疗无效、主胰管扩张或发生炎性包块者,应积极外科干预。Frey手术为治疗慢性胰腺炎的经典手术方式,该术式应用于成人的报道较多,疗效肯定;但儿童病例国内外文献鲜有报道,该术式在儿童慢性胰腺炎合并胰管扩张治疗中的有效性及安全性需进一步探讨。本文总结复旦大学附属儿科医院近5年来采用Frey手术治疗慢性胰腺炎合并胰管扩张的临床经验,探讨该手术的有效性及安全性。
材料与方法 一、临床资料1. 基本资料:2015年1月至2020年5月复旦大学附属儿科医院共收治确诊慢性胰腺炎的儿童患者16例。纳入标准:①反复发作上腹部疼痛,淀粉酶和(或)脂肪酶升高;②影像学检查如超声、CT、经内镜逆行性胰胆管造影术(encoscopic retrograde cholangio-pancreatography,ERCP)和(或)磁共振胰胆管造影(magnetic resonance cholangio-pancreatography,MRCP)提示主胰管扩张;③保守治疗6个月无效。排除标准:慢性胰腺炎仅保守治疗或局部囊肿引流者。16例均符合以上纳入、排除标准,故全数入组。男5例,女11例;年龄5岁7个月至12岁1个月,中位年龄7.8岁。16例患儿均有腹痛症状,病程6个月至3年,首次出现症状至诊断时间3个月至3年。其中10例腹痛发作与进食有关,以反复发作上腹痛为主,6例伴有恶心呕吐。消瘦、体重减轻6例,合并腹泻2例,合并皮肤黄染1例。本研究经复旦大学附属儿科医院伦理委员会批准(2020 - 296)。
2. 实验室检查:发作时血清淀粉酶升高,范围143.5~678.8 U/L,非急性发作期血清淀粉酶3~108 U/L;脂肪酶升高,范围345.5~1 412 U/L;肝功能及胆红素指标:15例肝功能维持在正常水平;1例合并胰头占位、胰腺假性囊肿形成伴梗阻性黄疸,术前谷丙转氨酶最高201 U/L,直接胆红素最高达147.6 μmol/L。所有患儿血糖检测结果基本正常。
3. 影像学检查:16例术前均接受了腹部B超、CT、MRCP检查(图 1),均发现胰管扩张,扩张直径2.6~12.2 mm,中位数9.1 mm。胰腺肿胀2例,胰腺萎缩9例(其中1例严重萎缩,仅残留扩张胰管及瘢痕样组织)。少量腹腔积液4例,大量腹腔积液2例;胰管结石/蛋白栓例7例。

|
图 1 1例慢性胰腺炎患儿术前MR及CT表现 A:胰腺MR提示胰管扩张,胰腺萎缩改变; B:MRCP提示胰管全程扩张,直径9~10 mm,呈串珠状; C:腹部增强CT亦提示胰腺实质减少,胰管扩张伴扭曲,胰头占位性病变; D:胰腺平扫CT提示胰头点状钙化,近端胰管内稍高密度影,可能为胰管结石 Fig.1 Preoperative imaging (MR & CT) findings of chronic pancreatitis 注 MRCP:磁共振胰胆管造影 |
4. 手术指征:①反复发生胰腺炎,病程半年以上;②合并有胰头包块、胰管明显扩张伴有钙化或结石;③非手术治疗或内镜治疗无法缓解疼痛。
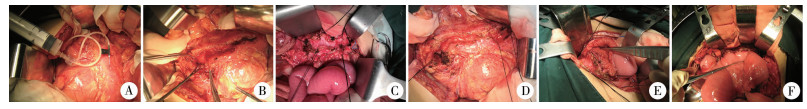
二、手术过程及术后处理取上腹部横行切口,打开胃结肠韧带,暴露胰腺。术中通过空针穿刺定位,逐渐横行切开胰腺组织,必要时行欧乃派克胰管造影,确定胰管位置(图 2中A)。沿主胰管方向纵向切开胰管,自胰尾向胰头部纵行尽可能全程劈开(图 2中B、图 2中C),包括主胰管和副胰管,剜除胰腺头部钙化病灶(图 2中D),充分敞开扩张胰管,保留主胰管近端以及胆管的共同通路至十二指肠大乳头部通路,生理盐水冲洗出蛋白栓。距离屈氏韧带15 cm处横断空肠,近端空肠袢纵行劈开,穿过结肠系膜,分别与腺体和胰管行浆肌层和黏膜层双层缝合(图 2中E),近端空肠与距胰肠吻合口下方30 cm处空肠端侧吻合。“Y”形肠襻近端浆肌层缝合数针防反流,吻合口下方置引流管(图 2中F)。
|
图 2 1例儿童慢性胰腺炎Frey手术过程图 A: 术中穿刺扩张胰管见胰液,并行胰管造影检查; B;自胰腺尾部向胰头切开胰管; C:切开扩张的胰管,可见胰腺萎缩,周围可见皂化斑,胰管扭曲扩张,胰头部可见结石; D:切除部分胰头组织,打开胰腺钩突部,保持引流通畅; E: 胰腺创面与空肠侧侧吻合; F: 吻合后外观 Fig.2 Intraoperative findings of Frey's operation |
以门诊、电话、微信的方式进行术后随访,随访时间11个月至5年,平均随访42个月。随访内容包括:腹部疼痛情况、有无腹泻、血糖、血尿淀粉酶、腹部B超、胰腺MRCP等。
结果 一、围手术期情况16例患儿均接受Frey手术,术中出血40~60 mL (平均50 mL),住院时间7~18 d(平均9 d),手术时间123~243 min(平均186 min)。术中见胰腺呈皂化斑样改变,质地硬,伴胰腺萎缩,周围纤维脂肪组织增生。胰管不同程度扩张,术中测主胰管内径最大值为2.6~12.2 mm,中位数为5.8 mm,扩张多为串珠状。7例伴有蛋白栓和(或)胰管结石。所有患儿术后胰腺病理均符合慢性胰腺炎改变。
术后短期并发症中,1例出现胰瘘,延长引流管放置时间,2周后愈合;1例出现梗阻性黄疸,行ERCP十二指肠乳头切开后黄疸消失;1例出现胰腺假性囊肿,二次手术引流后治愈。其余患儿均无早期术后并发症,顺利出院。
二、随访结果随访期间,10例患儿术后第7天血清淀粉酶恢复正常、腹痛症状完全消失;5例术后腹痛逐渐缓解,1个月后腹痛消失,血清淀粉酶逐渐恢复正常,生长发育较满意;1例术前胰腺严重萎缩,术后仍有腹痛反复,血淀粉酶时有升高,生长发育较差。4例少量腹腔积液术后基本消失,2例大量腹腔积液2周后基本消失。2例术前慢性腹泻患儿术后腹泻明显缓解。术后腹部B超显示术前胰腺肿胀2例,术后胰腺水肿均有明显缓解,8例胰腺萎缩无明显变化。在所有接受Frey手术的16例患儿中,无一例术后新发慢性脂肪泻等外分泌功能异常。此外,本组患儿无一例术后出血及肠梗阻并发症,术后血糖基本维持正常。
讨论 一、关于儿童慢性胰腺炎的诊断慢性胰腺炎是胰腺不可逆转的疾病,其特征是慢性进行性胰腺炎症、纤维化和瘢痕,伴随胰腺实质细胞的破坏,导致患者内分泌、外分泌功能的丧失,最终形成慢性纤维化[1-3]。胰腺星状细胞介导慢性胰腺炎患者胰腺的纤维化破坏,导致胶原形成和细胞外基质蛋白在间质中沉积,导致腺泡和导管细胞的破坏,其最终结果是胰腺小叶结构和导管结构的逐渐丧失。儿童慢性胰腺炎的诊断主要依据临床表现和影像学检查结果,胰腺内分泌、外分泌功能检测可作为诊断的补充。据报道,与ERCP相比,MRI在鉴别中重度慢性胰腺炎患者的病理导管变化方面具有较高的敏感性(88%)、特异性(98%)和准确性(91%)[4]。因此,在中重度和晚期慢性胰腺炎患儿中,MRCP及胰腺MRI已取代ERCP,作为慢性胰腺炎患儿的首选辅助检查项目[5]。本研究中我们把MRCP及胰腺MRI作为主要的主要影像学参考依据,而病理学结果是慢性胰腺炎诊断的金标准。
二、Frey手术的指征及时机对慢性胰腺炎进行治疗的主要目的是使患儿疼痛得到缓解,保护胰腺内、外分泌功能,延缓病情进展。慢性胰腺炎的外科治疗适应证主要包括:①难以忍受的疼痛;②胆总管阻塞;③胰腺假性囊肿;④腹水;⑤十二指肠和结肠梗阻;⑥血管并发症,如假性动脉瘤和与肠系膜静脉阻塞相关的血栓形成;⑦胰腺病变,不能排除恶性可能[7]。儿童手术适应证更为狭窄,慢性顽固性疼痛通常是手术干预的最常见指征。研究表明:40% ~75%的慢性胰腺炎患儿最终需要手术[8-9]。本组病例中,上腹痛是患儿的主要临床表现,且腹痛多与进食有关。若胰管扩张不显著,即使慢性胰腺炎诊断明确,具备手术指征,也不满足手术条件。此外,慢性胰腺炎急性发作期手术,往往出血增多,吻合不满意,胰瘘发生的概率增加。本组中有6例术前出现胰性腹水,均予以生长抑素等对症治疗,直至腹水缓解甚至消失,待急性期消退后再次行根治术,手术创伤相对较小。
对于早期慢性胰腺炎,手术的作用存在争议[10]。近年研究结果显示,早期手术(慢性胰腺炎发病<3年)在控制远期疼痛、保留内外分泌功能和提高生命质量等方面均优于后期手术[5, 11]。既往观点主张药物治疗、内镜治疗、外科手术的序贯治疗,即优先考虑非手术治疗,在内镜治疗无效或慢性胰腺炎出现严重临床症状时,再进行手术[7, 12]。但这一观点未得到广泛认同,Cahen等[13]在慢性胰腺炎和胰管梗阻患者中发现,在2年的随访中,手术引流比内镜治疗更有效。本组病例部分患儿发病时间不长,但胰管扩张及胰腺萎缩较严重,且年龄较小,因此直接选择了胰管敞开引流手术。
三、Frey手术的优点及疗效Frey手术的主要特点是在不离断胰颈部前提下,充分敞开引流胰管,剜除胰头部腹侧面主胰管浅层炎性组织。胰头部位的慢性炎症病变,主胰管或分支胰管多发结石,同时胰体尾部主胰管存在结石或狭窄的患者尤其适用该术式。相较于单纯引流术,Frey手术切除了部分胰头部慢性炎症组织;且不需要游离门静脉前壁胰腺组织,保留胰腺颈部;解除远端主胰管梗阻并充分引流,降低操作难度与手术风险。Frey手术治疗慢性胰腺炎合并胰管扩张可明显提高疼痛缓解率。Rollins和Meyers报道儿童Frey手术后疼痛缓解率为82% ~91%[14]。Ray等研究发现实施Frey手术后,患者疼痛缓解率为85%,由于Frey手术对胰头部分的减压更充分,术后疼痛缓解效果更好[15]。与传统的Whipple手术比较,Frey手术后并发症发生率小于10%。本研究中,患儿疼痛缓解率为93.7%,防止了胰腺内分泌、外分泌功能进一步恶化。长期随访中,部分患儿胰腺有进一步萎缩的可能[5]。当然,本组病例目前随访时间相对较短,血糖及粪便脂肪酶需要在此类患者中长期监测。此外,Frey手术后胰液通畅引流对胃肠道的消化吸收功能改善起到了至关重要的作用。本研究中2例脂肪泻患儿,行Frey手术后脂肪泻明显好转。
四、Frey手术的并发症及预防胰头肿块可能压迫胆总管、十二指肠及门静脉,造成相应的合并症[16-17]。Frey手术中应注意慢性胰腺炎造成胰腺及胰周纤维化、水肿等,易发生意外血管损伤和出血,并避免发生胆胰肠结合部医源性损伤。手术可能造成胰腺体积的丧失,加重原有胰腺功能的减退,手术解剖胰头时,要充分切开胰管及可疑副胰管,充分引流。
Frey手术后常见短期并发症包括胰瘘、胆道损伤等。本组病例中1例胰瘘保守治疗后治愈,考虑为胰腺萎缩伴僵硬钙化、胰肠吻合愈合不良引起。1例胰尾部假性囊肿形成,考虑为胰尾部管道敞开不充分,胰尾部蛋白栓梗阻引起胰腺假性囊肿形成,予手术内引流后治愈。笔者认为术中造影可协助准确定位,术中需全程切开扩张到胰尾部胰管,有术者采用部分胰腺尾部切除的杂交引流手术,在成人可避免局部敞开不全,儿童目前缺乏相应报道。
综上所述,Frey手术治疗儿童慢性胰腺炎合并胰管扩张能够最大限度保存胰腺组织,手术操作相对简单,损伤胰头、十二指肠和胆总管的可能性小,可提高患儿的疼痛缓解率,避免术后并发症。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为李军、刘百慧, 论文调查设计为李军、陈功、董岿然,数据收集与分析李军、陈功,论文结果撰写为李军,论文讨论分析为李军、陈功、董岿然、郑珊、肖现民
| [1] |
徐兵, 余溪洋, 孙传成. 小儿慢性胰腺炎12例[J]. 临床小儿外科杂志, 2016, 15(3): 303-305. Xu B, Yu XY, Sun CC. Clinical diagnosis and treatment of chronic pancreatitis in children[J]. J Chin Ped Sur, 2016, 15(3): 303-305. DOI:10.3969/j.issn.1671-6353.2016.03.027 |
| [2] |
Whitcomb DC. Genetic risk factors for pancreatic disorders[J]. Gastroenterology, 2013, 144(6): 1292-1302. DOI:10.1053/j.gastro.2013.01.069 |
| [3] |
中华医学会外科学分会胰腺外科学组. 慢性胰腺炎诊治指南(2014)[J]. 中华外科杂志, 2015, 53(4): 241-246. DOI: 10.3760/cma.j.issn.0529-5815.2015.04.001. Group of Pancreatic Surgery, Branch of Surgery, Chinese Medical Association Guidelines for Diagnosing & Treating Chronic Pancreatitis (2014)[J]. Chin J Pediatr Surg, 2015, 53(4): 241-246. DOI: 10.3760/cma.j.issn.0529-5815.2015.04.001. |
| [4] |
Tamura R, Ishibashi T, Takahashi S. Chronic pancreatitis: MRCP versus ERCP for quantitative caliber measurement and qualitative evaluation[J]. Radiology, 2006, 238(3): 920-928. DOI:10.1148/radiol.2382041527 |
| [5] |
Whitcomb DC, Shimosegawa T, Chari ST, et al. International consensus statements on early chronic pancreatitis.recommendations from the working group for the international consensus guidelines for chronic pancreatitis in collaboration with the International Association of Pancreatology, American Pancreatic Association, Japan Pancreas Society, Pancreasfest Working Group and European Pancreatic Club[J]. Pancreatology, 2018, 18(5): 516-527. DOI:10.1016/j.pan.2018.05.008 |
| [6] |
Nealon WH, Thompson JC. Progressive loss of pancreatic function in chronic pancreatitis is delayed by main pancreatic duct decompression.A longitudinal prospective analysis of the modified puestow procedure[J]. Ann Surg, 1993, 217(5): 458-468. DOI:10.1097/00000658-199305010-00005 |
| [7] |
Ceyhan GO, Bergmann F, Kadihasanoglu M, et al. Pancreatic neuropathy and neuropathic pain-a comprehensive pathomorphological study of 546 cases[J]. Gastroenterology, 2009, 136(1): 177-186. DOI:10.1053/j.gastro.2008.09.029 |
| [8] |
Issa Y, van Santvoort HC, van Goor H, et al. Surgical and endoscopic treatment of pain in chronic pancreatitis: a multidisciplinary update[J]. Dig Surg, 2013, 30(1): 35-50. DOI:10.1159/000350153 |
| [9] |
Bachmann K, Kutup A, Mann O, et al. Surgical treatment in chronic pancreatitis timing and type of procedure[J]. Best Pract Res Clin Gastroenterol, 2010, 24(3): 299-310. DOI:10.1016/j.bpg.2010.03.003 |
| [10] |
Muniraj T, Aslanian HR, Farrell J, et al. Chronic pancreatitis, a comprehensive review and update.Part II: Diagnosis, complications, and management[J]. Dis Mon, 2015, 61(1): 5-37. DOI:10.1016/j.disamonth.2014.12.003 |
| [11] |
张傲然, 杨尹默. 《慢性胰腺炎外科治疗时机国际共识》评介[J]. 中国实用外科杂志, 2020, 40(8): 909-912. Zhang AR, Yang YM. A review of International Consensus Guidelines for Surgery and the Timing of Intervention in Chronic Pancreatitis[J]. Chinese Journal of Practical Surgery, 2020, 40(8): 909-912. DOI:10.19538/j.cjps.issn1005-2208.2020.08.03 |
| [12] |
Dumonceau JM, Delhaye M, Tringali A, et al. Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline[J]. Endoscopy, 2012, 44(8): 784-800. DOI:10.1055/s-0032-1309840 |
| [13] |
Cahen DL, Gouma DJ, Laramée P, et al. Long-term outcomes of endoscopic vs surgical drainage of the pancreatic duct in patients with chronic pancreatitis[J]. Gastroenterology, 2011, 141(5): 1690-1695. DOI:10.1053/j.gastro.2011.07.049 |
| [14] |
Rollins MD, Meyers RL. Frey procedure for surgical management of chronic pancreatitis in children[J]. J Pediatr Surg, 2004, 39(6): 817-820. DOI:10.1016/j.jpedsurg.2004.02.021 |
| [15] |
Ray S, Sanyal S, Ghatak S, et al. Frey procedure for chronic pancreatitis in children: A single center experience[J]. J Pediatr Surg, 2015, 50(11): 1850-1853. DOI:10.1016/j.jpedsurg.2015.07.012 |
| [16] |
Sah DN, Bhandari RS, Singh YP, et al. Early outcome of Frey's procedure for chronic pancreatitis: Nepalese tertiary center experience[J]. BMC Surg, 2019, 19(1): 139. DOI:10.1186/s12893-019-0592-7 |
| [17] |
Schlosser W, Poch B, Beger HG. Duodenum-preserving pancreatic head resection leads to relief of common bile duct stenosis[J]. Am J Surg, 2002, 183(1): 37-41. DOI:10.1016/s0002-9610(01)00713-9 |
 2022, Vol. 21
2022, Vol. 21


