2. 湖南省儿童医院肝病中心,长沙 410007;
3. 湖南省儿童医院普外科,长沙 410007;
4. 湖南省儿童医院病理科,长沙 410007
2. Liver Disease Center of Hunan Children's Hospital, Changsha, 410007;
3. Department of General Surgery, Hunan Children's Hospital, Changsha, 410007;
4. Department of Pathology, Hunan Children's Hospital, Changsha, 410007
抗体介导的排斥反应(antibody mediated rejection, AMR)是导致晚期移植物功能丧失的主要原因之一。肝移植是儿童肝病终末期常规治疗手段,肝脏作为一个免疫器官,既往认为较少发生排斥反应。随着肝移植数量的增加,移植后出现急性排斥反应的病例数也越来越多,但多为细胞介导的排斥反应,急性AMR发病率很低,对AMR诊断和治疗的认识也相对不足,目前缺乏明确的治疗方案,常规抗排斥反应治疗的效果不太理想,可导致移植肝功能衰竭或二次肝移植[1]。本研究回顾性分析湖南省儿童医院利用血浆置换救治成功的1例儿童亲属活体肝移植、术后发生AMR受者的临床资料,结合相关文献复习探讨AMR的更有效诊治方案。
材料与方法 一、一般资料研究对象为2017年12月湖南省儿童医院收治的1例行亲属活体肝移植术后出现AMR的男性患儿,手术时年龄为7个月,原发病为胆道闭锁(biliary atresia, BA)、胆汁性肝硬化。由湖南省儿童医院儿童肝移植团队和中南大学湘雅二医院器官移植中心合作完成活体肝脏移植手术,供肝者为患儿母亲,移植肝为供肝的左外叶,手术方式为背驮式肝移植。胆道重建采取Roux-en-Y胆肠吻合,手术过程顺利,术后第3天由湘雅二医院器官移植中心转入湖南省儿童医院重症监护室。本研究经湖南省儿童医院伦理委员会审查批准(HCHLL - 2020 - 54)
二、治疗方法1. 常规治疗:包括抗感染、免疫抑制。①抗感染:术后先后予亚胺培南、万古霉素、甲硝唑和更昔洛韦联合抗感染;术后第8天出现发热,停用甲硝唑,加用头孢哌酮舒巴坦钠抗感染。术后第13天患儿出现严重肺部感染、右侧脓气胸,胸腔积液培养检出肺炎克雷伯菌,停万古霉素改阿米卡星抗感染,并加用卡泊芬净抗真菌。②免疫抑制:术后一直口服他克莫司+泼尼松二联抗排斥治疗,他克莫司目标浓度维持在6~8 ng/mL,术后第13天因严重肺部感染,间断停用他克莫司。术后第14天出现以胆红素升高为主的肝功能损害,术后第24天总胆红素升至196 μmol/L,直接胆红素96.10 μmol/L,间接胆红素100.03 μmol/L。完善血液人类白细胞抗原(human lymphocyte antigen, HLA)等检查,HLA-Ⅰ阴性,HLA-Ⅱ类特异性抗体阳性;供体的HLA血液检测结果为阳性。经与供体HLA配型比对后发现存在供体特异性抗体(donor specific antibody, DSA),为HLA-DQ抗体,平均荧光强度(mean fluorescence intensity, MFI)为10 705,血液PRAⅠ类阴性,PRAⅡ类阳性;行移植肝组织穿刺活检显示中- 重度急性排斥反应,C4d染色阳性。结合临床表现,考虑存在抗体介导排斥反应,予甲强龙静脉冲击+静脉丙种球蛋白(intravenous immunoglobulin, IVIG)+吗替麦考酚脂加强抗排斥反应,后调整相关免疫抑制药物剂量。
2. 血浆置换治疗:术后第29天开始使用血浆置换治疗,每2天1次,共置换5次。采用金宝Prismaflex血液净化机,采用旭化成Plasmaflo OP-02W-膜式血浆分离器,经左股静脉置入双腔透析导管(管径6.5F),每次置换新鲜冰冻血浆量为50~100 mL/kg,设置血流速度为5~10 mL·kg-1·min-1,血浆置换速度为血流速度的20% ~25%,以肝素盐水预充管路,持续泵人普通肝素10 U·kg-1·h-1,每次床旁治疗时间2~3 h。术后24 h内监测肝功能、血常规、凝血功能等指标。
3. 抗体介导的急性排斥反应诊断标准:①与急性AMR一致的组织病理学表现;②血清DSA阳性;③C4d弥漫性沉浸于微血管或门脉基质;④排除其他可引起类似病理改变的疾病[2]。
结果 一、血浆置换治疗1周后相关指标情况第1次血浆置换治疗后总胆红素(total bilirubin, TBIL)、间接胆红素(indirect bilirubin, IBIL)、直接胆红素(direct bilirubin, DBIL)下降,4 h后有所反弹;第2次血浆置换治疗后未出现明显反弹,TBIL、DBIL、IBIL均逐步下降,血清丙氨酸氨基转移酶(alamine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)均有下降;红细胞(red blood cell, RBC)、白细胞(white blood cell, WBC)、血红蛋白(hemoglobin, Hb)指标变化不明显(血浆置换期间有输注红细胞悬液),血小板(platelet, PLT)稍有下降。见表 1。
| 表 1 亲属活体肝移植患儿第1至第5次血浆置换术前及术后部分实验室检查指标变化 Table 1 Changes of some laboratory test parameters before and after plasmapheresis in children |
|
|
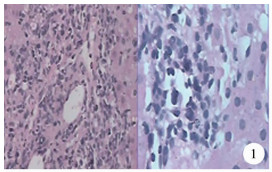
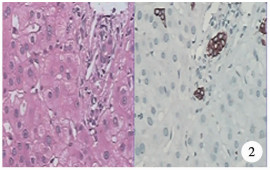
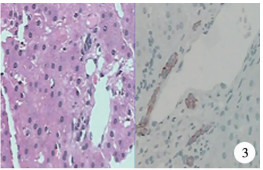
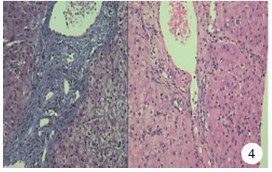
术后第24天第1次完善移植肝穿刺活检病理检查(图 1),镜下见肝脏组织结构紊乱,肝窦索结构欠清楚。大部分肝细胞明显水肿,空泡变性。少数肝细胞坏死、较多肝细胞胞浆可见淤胆。肝细胞核大小不一、可见多核肝细胞。汇管区可见大量混合性炎症细胞浸润,胆管壁可见炎症细胞浸润,血管壁可见血管内皮细胞肿胀,个别坏死。汇管区旁肝细胞间可见散在炎症细胞浸润。特殊染色VG及MASSON染色显示肝组织内纤维组织轻度增生,示中-重度急性排斥反应。术后第37天第2次复查移植肝活检(图 2),肝细胞内明显胆汁淤积,C4d在肝血窦内皮细胞可见弱阳性表达。免疫组化结果:Vim(-)、CK(+)、CK19(+)、CMV(-)、C4d(弱+)、Ki-67(-)。分别于术后第47天(图 3)、术后第4个月(图 4)、术后第10个月(图 5)、术后第16个月(图 6)4次复查移植肝穿刺活检病理检查,提示排斥反应逐步减轻,未出现AMR复发。
|
图 1 肝移植术后24天第1次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 肝细胞明显水肿,空泡变性,少数坏死;汇管区见混合性炎症细胞浸润;胆管壁炎症细胞浸润;血管壁血管内皮细胞肿胀,个别坏死 Fig.1 Histopathological features and immunohistological staining of initially transplanted liver at Day 24 after liver transplantation (HE, ×400) |
|
图 2 肝移植术后37天第2次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 肝细胞轻度水肿;肝细胞内明显胆汁淤积,C4d在肝血窦内皮细胞可见弱阳性表达;汇管区可见少量混合性炎症细胞浸润 Fig.2 Histopathological features and immunohistological staining of a second liver transplantation at Day 37 after liver transplantation (HE, ×400) |
|
图 3 肝移植术后47天第3次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 部分肝细胞水肿,空泡变性;肝细胞胞浆及肝窦内可见淤胆;汇管区可见少量淋巴细胞浸润 Fig.3 Histopathological features and immunohistological staining of the third transplanted liver at Day 47 after liver transplantation (HE, ×400) |
|
图 4 肝移植术后4个月第4次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 少数肝细胞水肿,空泡变性;肝细胞胞浆及肝窦内可见淤胆;汇管区及肝细胞间见少量淋巴细胞浸润 Fig.4 Histopathological features and immunohistological staining of the fourth transplanted liver at Month 4 after liver transplantation (HE, ×400) |
|
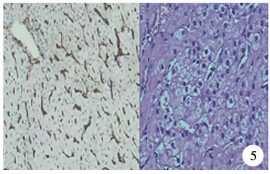
图 5 肝移植术后10个月第5次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 大部分肝细胞水肿,胞浆浑浊至空泡变性;胆管上皮细胞胞浆空泡变性;汇管区及肝细胞间见少量淋巴细胞浸润;胆管壁、血管壁均见少量炎症细胞浸润 Fig.5 Histopathological features and immunohistological staining of the fifth transplanted liver at Month 10 after liver transplantation (HE, ×400) |
|
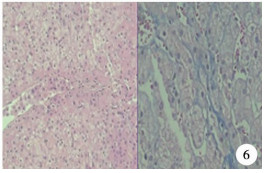
图 6 肝移植术后16个月第6次移植肝组织病理学特征及免疫组织学染色(HE染色,×400) 大部分肝细胞水肿,胞浆浑浊至空泡变性;汇管区有坏死,结构欠清,可见个别管壁不完整胆小管;中央静脉血管壁结构破坏;汇管区及肝细胞间见少量淋巴细胞浸润 Fig.6 Histopathological features and immunohistological staining of the 6th transplanted liver at Month 16 after liver transplantation (HE, ×400) |
患儿经血浆置换治疗后,继续予口服他克莫司和泼尼松抑制免疫反应,总胆红素在30~100 μmol/L波动,持续近1个月后恢复正常,未出现明显出血、呕吐等异常表现。截至2021年12月已随访3年,复查过程中行移植肝穿刺活检5次,发现排斥反应逐步减轻,肝功能基本维持正常,未出现AMR复发。
讨论器官移植术后排斥反应的发生情况是影响移植物长期存活的一个重要因素。经典免疫学理论认为,移植术后T细胞介导的排斥反应(T cell-mediated rejection, TCMR)是其主要致病原因,目前临床应用的免疫抑制剂也主要是针对T细胞活化、增殖、分化的环节发挥作用,有效改善了大部分患儿的预后,但仍有部分患儿服用该类药后仍出现移植物损伤,甚至是难以治疗的损伤。随着研究的深入,学者们逐渐认识到抗体介导的排斥反应(antibody mediated rejection, MR)是造成该部分移植物损害的重要因素之一。肝脏具有特殊的固有免疫系统,过去一直认为肝移植术后出现AMR的风险很低,但随着肝移植的快速发展,肝移植术后发生AMR的概率也随之增加,但尚未被充分认识。
AMR作为肝移植术后并不常见的一类难治性严重并发症,早期诊断是早期获得治疗的前提,也是获得良好预后的关键。但AMR无明显特征性临床表现,也缺乏特异性指标,使得早期诊断存在一定的难度。AMR在ABO血型不合的肝脏移植受者中相对常见,但在ABO血型相合的肝脏移植受者中也可发生,其发生与受者易感性密切相关,AMR的易感性取决于抗体效价、特异性、时间、类别、浓度及靶抗原分布等,也有研究表明低度易感性可导致AMR的发生[3-4]。
供体抗原特异性抗体(donor special antibody, DSA)被认为是导致AMR发生、发展的重要危险因素。儿童肝移植术后出现DSA的概率较成人高,有研究报道儿童肝移植术后DSA阳性率高达54%[5]。DSA大部分出现在肝移植术后的早期,但术后早期(<90 d)在出现肝功能衰竭的患者中仅占1%,而在DSA阳性患者中出现早期肝功能衰竭的比例则达到10%[6]。另一项对儿童肝移植术后10年的随访研究中发现,24例肝功能正常的受者中,DSA阳性率高达33%[7]。肝移植术后出现DSA的危险因素很多,包括使用环孢素而非他克莫司、低免疫抑制水平、术前终末期肝病评分(model for end-stage liver disease, MELD)<15分、低年龄等,但使用环孢素是否为高危因素目前存在分歧[8]。宁禹等[9]报道了3例儿童亲体肝移植术后成功撤除免疫抑制剂的病例,全部使用环孢素抑制免疫反应被认为是此3例患儿的共同特征之一,但缺乏病理学和免疫学指标方面的证据支持。有研究人员认为受者年龄偏小(<3岁)和钙调神经酶抑制剂浓度过低(环孢素<30 ng/mL或他克莫司<3 ng/mL)与DSA的发生相关度很高[10]。也有研究发现HLA-Ⅱ类抗体错配及之前发生过细胞排斥反应是诱发DSA的危险因素[11]。DSA与肝移植术后AMR的发生密切相关,但并非所有DSA都会诱发AMR,具体的发病机制尚不明确,有研究人员认为重点需关注T细胞对B细胞增殖的关键辅助作用[12-13]。在儿童肝移植术后DSA导致的AMR中,还有一个显著特征就是抗体位点集中于HLA-Ⅱ类抗体,主要是DQ、DR位点,且表达强度较高。国外研究发现,在27例儿童肝移植术后DSA阳性的受者中,DSA主要针对HLA-Ⅱ类抗原,所占比例HLA-DR为41%、HLA-DQ为53%,其中DQ DSA的比例在非耐受组患者高达61%,明显高于稳定组的20%和耐受组的29%。而在非耐受患者中,DQ DSA的平均荧光强度可达13 000以上[14-15]。也有研究人员认为移植术前DSA平均荧光强度大于5 000即有临床意义,且提示预后不良[16]。
本例患儿虽为ABO血型相合的亲属活体肝脏移植患者,但手术时年龄仅7个月,病程中因合并严重肺部感染,曾多次停用他克莫司抑制免疫反应,当出现肝功能异常时考虑到发生排斥反应的可能,并及时完善了血液HLA和移植肝活检等检查。供体HLA血液检测提示阳性,经与供体HLA配型比对后发现存在DSA,且为HLA-DQ抗体,MFI为10705。第1次移植肝活检提示:肝细胞明显水肿,空泡变性,少数坏死;肝细胞胞浆可见淤胆;汇管区见混合性炎症细胞浸润;胆管壁炎症细胞浸润;血管壁血管内皮细胞肿胀,个别坏死,符合肝移植后中-重度急性排斥反应。遗憾的是该患儿第1次病检时未进行C4d染色,但根据临床表现和血清DSA阳性以及病检情况,经科室讨论后还是重点考虑肝移植术后AMR。在随后进行的第2次移植肝活检病理结果中,C4d在肝血窦内皮细胞可见弱阳性表达,证实了我们之前的判断。参照目前诊断AMR的Baff国际会议标准,肝移植术后DSA介导AMR的诊断是明确的[2]。但应注意的是在肝移植患者中,C4d作为一个严格反映AMR的标志物仍存在争议,肝活检C4d染色阴性并不能完全排除急性AMR。本例患儿能在早期得到确诊,在于本研究团队对肝移植术后可能发生AMR有警惕意识,当患儿肝功能出现异常时,能意识到发生AMR的可能并及时完善血清DSA和移植肝活检等检查是我们早期正确诊断的关键。
肝移植术后急性AMR一旦诊断明确后应及时治疗,尽量避免二次肝移植。目前国际上尚无肝移植术后AMR的标准治疗方案[17]。治疗的原则主要是降低DSA活性、减少DSA产生,减轻排斥反应的发生。常用的方式包括有:①清除体内各种抗体,如血浆置换或免疫吸附等;②抑制B淋巴细胞分化,如利妥昔单抗、他克莫司以及硼替佐米等;③应用免疫抑制剂,如IVIG和激素冲击疗法等。血浆置换能有效清除外周血中的DSA,改善肝功能,特别是对于伴有高胆红素血症的肝功能异常患者,可发挥较好的疗效;而IVIG可中和抗体、抑制补体、竞争性抑制自身IgG、抑制某些涉及免疫反应的细胞、阻断γ-干扰素(γ-interferon,IFN-γ)信号、扩增调节性细胞等。血浆置换和IVIG是目前急性AMR治疗最常用的一种联合治疗方案。吗替麦考酚酸酯是一种干扰细胞代谢的免疫抑制剂,可同时抑制T细胞、B细胞的增殖以及T细胞间单磷酸鸟苷(guanosine monophosphate, GMP)的转运,从而起到抑制AMR的作用。利妥昔单抗可通过清除记忆性B细胞、减少浆细胞的生成,进而减少DSA的产生,适用于治疗顽固性AMR。硼替唑米是一种蛋白酶抑制剂,其作用机制是减少DSA的生成,从而控制AMR的发生。巩颖等[18]采用血浆置换治疗肝移植术后急性AMR,亦获得良好的治疗效果。王凯等[19]研究发现交替予以血浆置换和IVIG等治疗儿童ABO血型不合肝移植术后AMR,可有效清除体内DSA,减弱DSA的作用,阻止排斥反应进展,随后再应用清除B细胞药物,可彻底消除DSA、治愈AMR。
本例患儿在诊断AMR明确后,我们立即予以甲泼尼龙静脉冲击+静脉丙种球蛋白+吗替麦考酚脂口服治疗,当效果不理想时,及时予血浆置换治疗,在使用血浆置换过程中,患儿肝功能逐步改善,除血小板和血红蛋白轻度下降外,无其他不良反应发生,后续逐步调整免疫抑制剂的剂量,患儿病情得到好转,未使用利妥昔单抗和硼替唑米。
总之,AMR是儿童肝移植术后一种少见的并发症,其后果严重,预后较差,且缺乏特征性临床表现,因此提高对肝移植术后发生AMR的重视程度,对于预防AMR的发生尤为重要。密切监测病情、维持免疫抑制剂的正常浓度,是预防AMR发生的有效方法。术前检测DSA,术后定期监测其浓度,有利于判断肝移植受者的状态,及时完善移植肝活检,有利于早期明确诊断。AMR一经诊断,应积极给予血浆置换和IVIG输入等联合治疗方案,可避免移植物功能丧失,使其恢复正常功能。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为袁远宏、张慧,论文调查设计为袁远宏、肖政辉、张慧,数据收集与分析袁远宏、尹强、陈卫坚、贺杰、张慧,论文结果撰写为袁远宏、张新萍、卢秀兰,论文讨论分析为袁远宏、肖政辉、张慧、卢秀兰
| [1] |
Valenzuela NM, Reed EF. Antibody-mediated rejection across solid organ transplants: manifestations, mechanisms, and therapies[J]. J Clin Invest, 2017, 127(7): 2492-2504. DOI:10.1172/JCI90597 |
| [2] |
Demetris AJ, Zeevi A, O'Leary JG. ABO-compatible liver allograft antibody-mediated rejection: an update[J]. Curr Opin Organ Transplant, 2015, 20(3): 314-324. DOI:10.1097/MOT.0000000000000194 |
| [3] |
Demetris AJ, Bellamy C, Hübscher SG, et al. 2016 Comprehensive Update of the Banff Working Group on Liver Allograft Pathology: Introduction of Antibody-Mediated Rejection[J]. Am J Transplant, 2016, 16(10): 2816-2835. DOI:10.1111/ajt.13909 |
| [4] |
Kim PT, Demetris AJ, O'Leary JG, et al. Prevention and treatment of liver allograft antibody-mediated rejection and the role of the 'two-hit hypothesis'[J]. Curr Opin Organ Transplant, 2016, 21(2): 209-218. DOI:10.1097/MOT.0000000000000275 |
| [5] |
Wozniak LJ, Hickey MJ, Venick RS, et al. Donor-specific HLA antibodies are associated with late allograft dysfunction after pediatric liver transplantation[J]. Transplantation, 2015, 99(7): 1416-1422. DOI:10.1097/TP.0000000000000796 |
| [6] |
O'Leary JG, Kaneku H, Demetris AJ, et al. Antibody-mediated rejection as a contributor to previously unexplained early liver allograft loss[J]. Liver Transpl, 2014, 20(2): 218-227. DOI:10.1002/lt.23788 |
| [7] |
Grabhorn E, Binder TM, Obrecht D, et al. Long-term clinical relevance of de novo donor-specific antibodies after pediatric liver transplantation[J]. Transplantation, 2015, 99(9): 1876-1881. DOI:10.1097/TP.0000000000000638 |
| [8] |
Tokodai K, Miyagi S, Nakanishi C, et al. Effect of recipient age at liver transplantation on prevalence of post-transplant donor-specific hla antibody[J]. Ann Transplant, 2017, 22: 333-337. DOI:10.12659/aot.903926 |
| [9] |
宁禹, 张明满, 郭春宝, 等. 肝移植术后完全停用免疫抑制剂三例儿童临床特点分析[J]. 中华小儿外科杂志, 2017, 38(8): 572-574. Ning Y, Zhang MM, Guo CB, et al. Clinical characteristics of complete immunosuppression withdrawal in pediatric recipients: a report of 3 cases[J]. Chin J Pediatr Surg, 2017, 38(8): 572-574. DOI:10.3760/cma.j.issn.0253-3006.2017.08.004 |
| [10] |
Tokodai K, Miyagi S, Nakanishi C, et al. Impact of the trough level of calcineurin inhibitor on the prevalence of donor-specific human leukocyte antigen antibodies during long-term follow-up after pediatric liver transplantation: antibody strength and complement-binding ability[J]. Transplant Direct, 2017, 3(8): e196. DOI:10.1097/TXD.0000000000000713 |
| [11] |
Arias M, Rush DN, Wiebe C, et al. Antibody-mediated rejection: analyzing the risk, proposing solutions[J]. Transplantation, 2014, 98(Suppl 3): S3-S21. DOI:10.1097/TP.0000000000000218 |
| [12] |
Cuadrado A, San Segundo D, López-Hoyos M, et al. Clinical significance of donor-specific human leukocyte antigen antibodies in liver transplantation[J]. World J Gastroenterol, 2015, 21(39): 11016-11026. DOI:10.3748/wjg.v21.i39.11016 |
| [13] |
王祥慧. 2019ATC器官移植国际前沿热点及新进展概述[J]. 器官移植, 2020, 11(2): 222-233. Wang XH. Overview of international forefront hotspots and new progress on organ transplantation in 2019 ATC[J]. Organ Transplantation, 2020, 11(2): 222-233. DOI:10.3969/j.issn.1674-7445.2020.02.007 |
| [14] |
Valenzuela NM, Hickey MJ, Reed EF. Antibody subclass repertoire and graft outcome following solid organ transplantation[J]. Front Immunol, 2016, 7: 433. DOI:10.3389/fimmu.2016.00433 |
| [15] |
Wozniak LJ, Hickey MJ, Venick RS, et al. Donor-specific hla antibodies are associated with late allograft dysfunction after pediatric liver transplantation[J]. Transplantation, 2015, 99(7): 1416-1422. DOI:10.1097/TP.0000000000000796 |
| [16] |
Tambur AR, Herrera ND, Haarberg KM, et al. Assessing antibody strength: comparison of mfi, c1q, and titer information[J]. Am J Transplant, 2015, 15(9): 2421-2430. DOI:10.1111/ajt.13295 |
| [17] |
Hogen R, DiNorcia J, Dhanireddy K. Antibody-mediated rejection: what is the clinical relevance?[J]. Curr Opin Organ Transplant, 2017, 22(2): 97-104. DOI:10.1097/MOT.0000000000000391 |
| [18] |
巩颖, 郭晖, 钟自彪, 等. 肝移植后急性抗体介导的排斥反应一例诊断和治疗[J]. 中华器官移植杂志, 2018, 39(8): 479-481. Gong Y, Guo H, Zhong ZB, et al. Diagnosis and treatment of antibody-mediated rejection after liver transplantation[J]. Chinese Journal of Organ Transplantation, 2018, 39(8): 479-481. DOI:10.3760/cma.j.issn.0254-1785.2018.08.007 |
| [19] |
王凯, 王政禄, 孙超, 等. 儿童ABO血型不合肝移植术后抗体介导的排斥反应的诊治经验分析[J]. 实用器官移植电子杂志, 2019, 7(1): 58-61. Wang K, Wang ZL, Sun C, et al. Experience in the diagnosis and treatment of antibody-mediated rejection after ABO blood group incompatibility liver transplantation in children[J]. Practical Journal of Organ Transplantation (Electronic Version), 2019, 7(1): 58-61. DOI:10.3969/j.issn.2095-5332.2019.01.015 |
 2022, Vol. 21
2022, Vol. 21


