急性细胞排斥反应是肝移植受者的常见并发症,尤其是在移植术后的前12个月内,其发病率达30% ~70%[1-3]。移植后排斥反应是影响移植物存活的关键因素之一,对此必须确保患儿得到及时有效的治疗[4]。肝移植后急性排斥反应的早期预测和识别对于减少术后并发症和维持良好的肝功能至关重要。目前肝穿刺活检仍然是诊断急性排斥反应的金标准,但其具有侵入性,在临床上的应用有限[5]。亚临床排斥反应的诊断或抗排斥反应治疗有效性的评估需要重复穿刺活检,且器官移植多发生在年龄不超过1岁的患儿中,更易因侵入性操作而导致感染等并发症[6]。因此,迫切需要特异的、敏感的无创生物标志物来早期预测急性排斥反应的发生。外周血嗜酸性粒细胞预测肝移植术后排斥反应已有广泛研究,有文献报道强调了嗜酸性粒细胞在移植排斥反应中的预测作用[7]。然而,这些研究大多以成人为研究对象,因儿童的免疫抑制机制和药代动力学特点与成人存在显著差异,同时需要接受肝移植的患儿生长发育个体差异较大,故本研究旨在初步探讨嗜酸性粒细胞百分比对不同年龄儿童肝移植术后急性排斥反应发生中的预测价值[8]。
材料与方法 一、研究对象以2019年1月至2020年12月于天津市第一中心医院行肝移植手术的396例儿童肝移植受者为研究对象,年龄均不超过14周岁,排除6个月内死亡、再移植以及关键信息缺失的病例。患儿年龄分布:0~1岁282例(0~1岁组),1~6岁92例(1~6岁组),>6岁22例(>6岁组)。
根据病理结果按Banff评分进行分组,评分大于等于3分者归入急性排斥组(n=71),小于3分者归入非排斥组(n=325)[9-10]。因穿刺活检仅在临床怀疑有移植物排斥反应时进行,即当肝移植术后肝功能异常时(大部分表现为血清转氨酶、碱性磷酸酶或谷氨酰转肽酶突然上升)应进行肝穿刺活检以明确是否存在急性排斥反应,而无相应的临床表现时则不考虑急性排斥,所以未行肝穿刺活检者也归入非排斥组。本研究正式开始前经天津市第一医院伦理委员会审核批准,审批编号为2021N162KY。
二、标本采集连续收集术后1~7 d所有患儿外周血嗜酸性粒细胞百分比值。所有肝移植受者每日于口服免疫抑制剂前留取外周血2 mL,置于抗凝管中,4℃环境下保存,并于3 h内完成检测。
三、免疫抑制方案年龄≤6岁的移植受者应用甲强龙+他克莫司两联方案,年龄>6岁的移植受者采用甲强龙+他克莫司+吗替麦考酚酯三联方案。他克莫司起始剂量为每日0.1~0.3 mg/kg,血药浓度维持量为:术后1~3个月7~10 ng/mL,术后4~6个月5~8 ng/mL。吗替麦考酚酯剂量为10 mg·kg-1·d-1,每日分两次服用,术后6个月停用。
四、统计学处理运用SPSS 21.0进行统计学分析。符合正态分布的计量资料以x±s描述,计数资料以频数和百分比表示。运用独立样本t检验比较急性排斥组和非排斥组嗜酸性粒细胞百分比均值的差异。绘制轮廓图以直观比较急性排斥组和非排斥组整体变化曲线,并对两组术后1~7 d的嗜酸性粒细胞百分比值进行重复测量方差分析。绘制ROC曲线以确定嗜酸性粒细胞百分比对发生急性排斥反应的预测价值。P<0.05为差异有统计学意义。
结果 一、不同年龄组受者嗜酸性粒细胞百分比均值的比较急性排斥反应总体发生率为17.93%(71/396),0~1岁组急性排斥反应发生率为16.31%(46/282),1~6岁组急性排斥反应发生率为21.73%(20/92),>6岁组急性排斥反应发生率为22.73%(5/22)。急性排斥组嗜酸性粒细胞百分比均值显著高于非排斥组(t=-4.380,P<0.001);但按年龄分层后,只有0~1岁儿童肝移植受者中两组间嗜酸性粒细胞百分比均值的差异具有统计学意义(t=-4.850,P<0.001);而在1~6岁和>6岁的儿童肝移植受者中,两组均值的差异均不具有统计学意义(P>0.05);故下文仅针对0~1岁儿童肝移植受者进行进一步分析。详见表 1。
| 表 1 两组不同年龄肝移植患儿术后嗜酸性粒细胞百分比均值比较(x±s, %) Table 1 Comparison of mean percentages of eosinophils stratified by recipient age(x±s, %) |
|
|
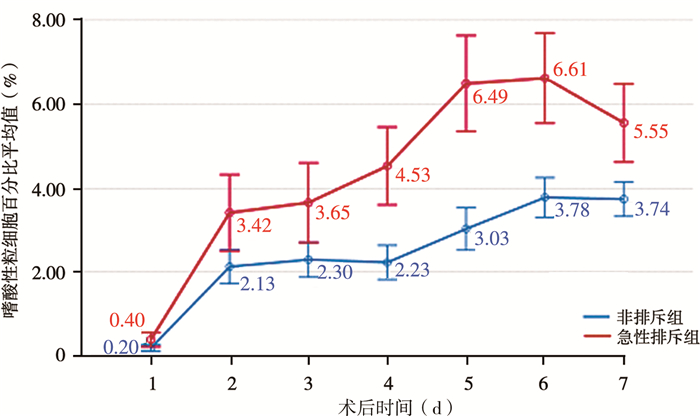
急性排斥组和非排斥组术后1~7 d连续测量的嗜酸性粒细胞百分比值变化趋势见图 1,经重复测量方差分析,组间比较结果显示F=25.380,P < 0.001,表明术后1~7 d内,急性排斥组与非排斥组嗜酸性粒细胞百分比值存在显著差异,急性排斥组显著高于非排斥组(P<0.05)。
|
图 1 0~1岁儿童术后1~7 d嗜酸性粒细胞百分比变化趋势轮廓图 Fig.1 Profile of eosinophil percentage changes at Day 1-7 post-operation among children aged 0~1 |
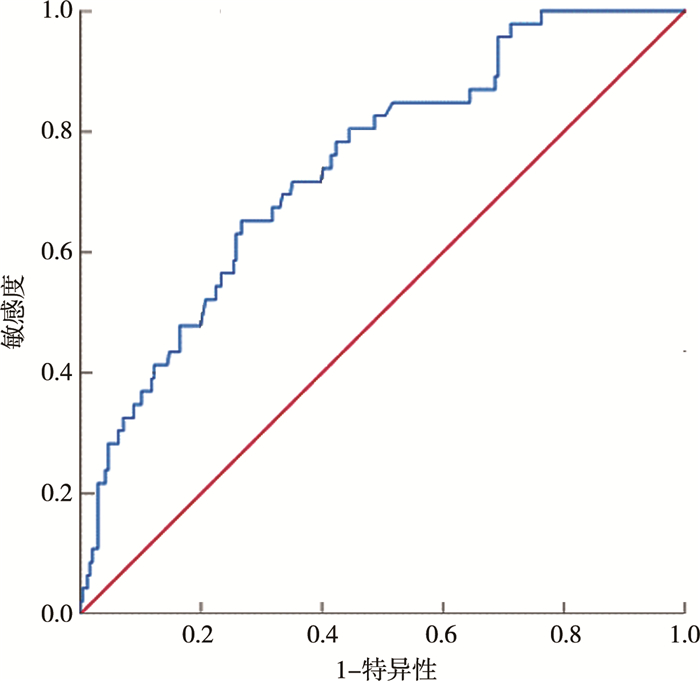
以术后肝穿刺活检的病理结果作为诊断排斥反应的金标准绘制ROC曲线,结果如图 2所示,可见术后1~7 d连续测量的嗜酸性粒细胞百分比均值对急性排斥反应的发生具有一定的预测作用(P<0.001),其曲线下面积为0.743(95%CI:0.668~0.817),灵敏度为63%(29/46),特异度为73% (173/236),临界值为3.23%,阳性预测值为31.18%(29/93),阴性预测值为91.05%(173/190)。
|
图 2 0~1岁肝移植儿童术后1~7 d嗜酸性粒细胞百分比均值预测急性排斥反应的受试者操作特征曲线 Fig.2 ROC curves of mean percentage of eosinophil for acute rejection prediction at Day 1-7 after transplantation among children aged 0~1 |
本研究结果显示,儿童肝移植术后早期急性排斥反应的发生率为17.93%,术后早期嗜酸性粒细胞百分比升高与0~1岁儿童急性排斥反应的发生显著相关。在0~1岁儿童肝移植受者中,术后7 d嗜酸性粒细胞百分比越高的患儿发生排斥反应的概率越高。嗜酸性粒细胞在炎症反应和过敏反应中发挥着潜在作用[11]。肝移植术后导致急性排斥反应的免疫机制与抗原呈递细胞表面表达的同种异体抗原的活化有关,尤其是主要组织相容性复合体(major histocompatibility complex, MHC) Ⅱ类分子对CD4+T淋巴细胞的活化。效应细胞范围包括CD8细胞毒性T细胞、巨噬细胞/单核细胞、中性粒细胞和嗜酸性粒细胞,而免疫抑制剂的应用与这些效应细胞的产生和消亡密切相关[12]。本研究中,只有0~1岁儿童肝移植受者的嗜酸性粒细胞百分比均值与急性排斥反应的发生存在相关性,可能与临床医生根据患儿年龄及生长发育状况调整免疫抑制剂方案有关。嗜酸性粒细胞相关指标与排斥反应的发生密切相关[13]。随后也有研究者发现,在肺移植和心脏移植中嗜酸性粒细胞相关指标依然与排斥反应发生显著相关[7, 14]。近期一项评估使用无创标志物诊断肝移植术后同种异体排斥反应的Meta分析显示,外周血嗜酸性粒细胞计数是在多个研究中提及的预测排斥反应发生的唯一无创指标[5, 15]。然而,以往的研究群体大部分为成人,很少关注儿童群体。在接受肝移植的低龄儿童群体中,我们发现嗜酸性粒细胞百分比值与排斥反应的发生高度相关,这与国外的一项回顾性研究结果一致,该报道指出在超过35%的急性细胞排斥反应中,血液和移植物中的嗜酸性粒细胞增多与排斥反应发生相关[16-18]。
在移植术后早期,嗜酸性粒细胞百分比值持续较高的儿童肝移植受者出现排斥反应的可能性更高。既往文献表明,嗜酸性粒细胞增多比急性排斥反应发生早2~4 d,比其他排斥反应相关生化参数升高早2~3 d[17]。因此,多数研究均以肝穿刺活检前2 d或活检当天的嗜酸性粒细胞值作为排斥反应发生的预测因子。然而,这些研究重点关注已经发生急性排斥反应时嗜酸性粒细胞计数的急性上升,削弱了嗜酸性粒细胞值对于急性排斥反应的早期预测价值。本研究更关注早期嗜酸性粒细胞百分比值对于急性排斥反应发生的预测作用,以提醒医生提早预防排斥反应的发生。
此外,早期嗜酸性粒细胞百分比均值水平对于急性排斥反应发生的诊断试验中,特异度为73%,以3.23%作为临界值时,其阳性预测值偏低,但阴性预测值达91.05%,说明早期嗜酸性粒细胞百分比均值水平低于3.23%的肝移植术后儿童出现急性排斥反应的概率较小。当临床怀疑急性排斥反应时,结合早期嗜酸性粒细胞百分比水平,可以避免对某些小月龄患儿行肝穿活检,从而有效降低移植术后儿童的感染风险。
综上所述,我们认为0~1岁儿童术后早期嗜酸性粒细胞百分比水平对术后急性排斥反应的发生具有一定的预测价值。术后早期嗜酸性粒细胞百分比水平可作为临床急性排斥反应发生的风险筛查指标,同时也可避免不必要的肝穿刺活检,有效避免不可逆损伤以及由侵入性操作引起的并发症。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为魏新哲,论文调查设计为魏新哲、高伟,数据收集与分析为魏新哲、张复波、杨洋、覃虹、韩潮、张国锋、徐敏、焦利俊,论文结果撰写为魏新哲、孙超,论文讨论分析为魏新哲、高伟、董冲、王凯、郑卫萍
| [1] |
Kobayashi S, Nagano H, Marubashi S, et al. Guanylate-binding protein 2 mRNA in peripheral blood leukocytes of liver transplant recipients as a marker for acute cellular rejection[J]. Transpl Int, 2010, 23(4): 390-396. DOI:10.1111/j.1432-2277.2009.00991.x |
| [2] |
Rodríguez-Perálvarez M, Rico-Juri JM, Tsochatzis E, et al. Biopsy-proven acute cellular rejection as an efficacy endpoint of randomized trials in liver transplantation: a systematic review and critical appraisal[J]. Transpl Int, 2016, 29(9): 961-973. DOI:10.1111/tri.12737 |
| [3] |
Ye Z, Jia J, Lv Z, et al. Identification of high-mobility group box 1 (HMGB1) expression as a potential predictor of rejection and poor prognosis after liver transplantation[J]. Ann Transplant, 2021, 26: e931625. DOI:10.12659/AOT.931625 |
| [4] |
Kohut TJ, Barandiaran JF, Keating BJ. Genomics and liver transplantation: genomic biomarkers for the diagnosis of acute cellular rejection[J]. Liver Transpl, 2020, 26(10): 1337-1350. DOI:10.1002/lt.25812 |
| [5] |
Krenzien F, Keshi E, Splith K, et al. Diagnostic biomarkers to diagnose acute allograft rejection after liver transplantation: systematic review and meta-analysis of diagnostic accuracy studies[J]. Front Immunol, 2019, 10: 758. DOI:10.3389/fimmu.2019.00758 |
| [6] |
张菁, 董念国, 孙永丰, 等. 4例婴儿心脏移植的单中心经验总结[J]. 临床小儿外科杂志, 2021, 20(6): 532-537. Zhang J, Dong NG, Sun YF, et al. Infantile heart transplantation: a report of four cases from a single center[J]. J Clin Ped Sur, 2021, 20(6): 532-537. DOI:10.3969/j.issn.1671-6353.2021.06.006 |
| [7] |
Darley DR, Ma J, Huszti E, et al. Eosinophils in transbronchial biopsies: a predictor of chronic lung allograft dysfunction and reduced survival after lung transplantation-a retrospective single-center cohort study[J]. Transpl Int, 2021, 34(1): 62-75. DOI:10.1111/tri.13760 |
| [8] |
Gabardi S, Tullius SG, Krenzien F. Understanding alterations in drug handling with aging: a focus on the pharmacokinetics of maintenance immunosuppressants in the elderly[J]. Curr Opin Organ Transplant, 2015, 20(4): 424-430. DOI:10.1097/MOT.0000000000000220 |
| [9] |
中华医学会器官移植学分会. 器官移植病理学临床技术操作规范(2019版)——肝移植[J]. 器官移植, 2019, 10(3): 267-277. Society of Organ Transplantation, Chinese Medical Association. Clinical Technique Handling Standards (2019 Edition)[J]. Organ Transplantation, 2019, 10(3): 267-277. DOI:10.3969/j.issn.1674-7445.2019.03.008 |
| [10] |
Roufosse C, Simmonds N, Clahsen-van Groningen M, et al. A 2018 reference guide to the banff classification of renal allograft pathology[J]. Transplantation, 2018, 102(11): 1795-1814. DOI:10.1097/TP.0000000000002366 |
| [11] |
Onyema OO, Guo Y, Hata A, et al. Deciphering the role of eosinophils in solid organ transplantation[J]. Am J Transplant, 2020, 20(4): 924-930. DOI:10.1111/ajt.15660 |
| [12] |
Harper IG, Gjorgjimajkoska O, Siu J, et al. Prolongation of allograft survival by passenger donor regulatory T cells[J]. Am J Transplant, 2019, 19(5): 1371-1379. DOI:10.1111/ajt.15212 |
| [13] |
Hällgren R, Bohman SO, Fredens K. Activated eosinophil infiltration and deposits of eosinophil cationic protein in renal allograft rejection[J]. Nephron, 1991, 59(2): 266-270. DOI:10.1159/000186563 |
| [14] |
Arbon KS, Albers E, Kemna M, et al. Eosinophil count, allergies, and rejection in pediatric heart transplant recipients[J]. J Heart Lung Transplant, 2015, 34(8): 1103-1111. DOI:10.1016/j.healun.2015.03.014 |
| [15] |
Barnes EJ, Abdel-Rehim MM, Goulis Y, et al. Applications and limitations of blood eosinophilia for the diagnosis of acute cellular rejection in liver transplantation[J]. Am J Transplant, 2003, 3(4): 432-438. DOI:10.1034/j.1600-6143.2003.00083.x |
| [16] |
郑善銮, 丁振若, 皇海, 等. 外周血反应性嗜酸细胞诊断器官移植术后急性排斥反应的价值[J]. 第四军医大学学报, 2005, 26(5): 425-427. Zhen SL, Ding ZR, Huang H, et al. Value of responsive acidophil in peripheral blood in the diagnosis of acute graft rejection[J]. Journal of Fourth Military Medical University, 2005, 26(5): 425-427. DOI:10.3321/j.issn:1000-2790.2005.05.013 |
| [17] |
Nagral A, Quaglia A, Sabin CA, et al. Blood and graft eosinophils in acute cellular rejection of liver allografts[J]. Transplant Proc, 2001, 33(4): 2588-2593. DOI:10.1016/s0041-1345(01)02105-4 |
| [18] |
Rodríguez-Perálvarez M, García-Caparrós C, Tsochatzis E, et al. Lack of agreement for defining 'clinical suspicion of rejection' in liver transplantation: a model to select candidates for liver biopsy[J]. Transpl Int, 2015, 28(4): 455-464. DOI:10.1111/tri.12514 |
 2022, Vol. 21
2022, Vol. 21


