2. 郑州大学附属儿童医院 河南省儿童医院小儿血液肿瘤科, 郑州 450000
2. Department of Hematological Oncology, Affiliated Children's Hospital, Zhengzhou University, Children's Hospital of Henan Province, Zhengzhou, Henan Province 450000, China
大咯血是呼吸系统的急危重症,发病率低,在所有咯血患者中占比5%左右,儿童更为罕见[1]。大咯血起病急,出血部位和出血原因难以及时明确,给诊断和治疗带来巨大挑战,病死率为6.5% ~38%[2-4]。传统治疗手段包括纤维支气管镜检查、支气管动脉栓塞、手术等。少数情况下大咯血患儿病情危急,体外膜肺氧合技术(extracorporeal membrane oxygenation, ECMO)可为其救治提供新的手段。然而,在全世界范围内,ECMO在咯血病例(尤其是儿童大咯血病例)中的应用很少,国内尚无ECMO治疗儿童大咯血的报道。郑州大学附属儿童医院/河南省儿童医院利用ECMO技术成功救治1例11岁大咯血患儿,现结合国内外关于ECMO治疗儿童大咯血的文献进行复习,以总结经验,提高此类患者的救治效果和生存率。
病例资料 一、病例介绍患儿男,11岁,因“咳嗽4 d、间断咯血2 d、机械通气19 h”入院。病初为轻咳,后出现暗红色血痰,量少。外院胸片及血常规检查无异常。病初自行口服云南白药,咯血进行性加重,遂住院,予吸氧、头孢美唑、氨甲环酸等对症治疗,期间行纤维支气管镜检查,因咯血量大而无法探查。入院前19 h咯血后出现胸闷、呼吸困难,经皮氧饱和度(SpO2)低,予气管插管。病程中出现发热1次,热峰38.1℃,无明确异物呛咳史。患儿6岁之后有反复鼻衄病史,每年约3~4次。查体:体温37.6℃,脉搏117次/min,呼吸34次/min,血压101/52 mmHg(1 mmHg=0.133 kPa),SpO2 88%。嗜睡,口周发绀,双肺呼吸音粗,右中下肺呼吸音低,闻及少量痰鸣音。双侧瞳孔等大等圆,直径2 mm,对光反射迟钝。外院CT提示双肺炎症。心脏彩超无异常。入院诊断:咯血原因待查,急性呼吸衰竭。入院查胸片提示右肺炎症,右肺实变、肺不张。血常规提示血红蛋白88 g/L。肝肾功能、凝血及感染指标无异常。血气分析提示:吸氧浓度80.0%, 酸碱度7.256, 二氧化碳分压44.1 mmHg, 氧分压73.5 mmHg, 标准碱剩余-7.5 mmol/L, 实际碱剩余-6.9 mmol/L。予止血、抗感染,机械通气采取压控模式:吸氧浓度1.0,呼吸频率30次/min;呼气末正压15 cmH2O,气道峰压29 cmH2O。患儿口鼻腔及气管插管内可见大量鲜血,SpO2下降至70%,心率170次/min左右,在反复扩容及大剂量肾上腺素、去甲肾上腺素维持下BP 140/35 mmHg,吸氧量100.0%,二氧化碳分压51.9 mmHg, 氧分压42.9 mmHg,OI指数46.6。
于入院19 h后行ECMO治疗,采取静脉- 静脉(V - V)模式,右侧颈内静脉17 Fr;右侧股静脉19 Fr。ECMO参数:转速2 465转/分,流量3.33 L/min;氧浓度1.0,气流量2 L/min。上机20 h后行肺部CTA检查,未见异常血管畸形,进一步行纤维支气管镜治疗,并于上机48 h行血管造影术,发现支气管动脉肺动脉瘘畸形(图 1),行封堵治疗后患儿肺部未再出血。术后因呼吸衰竭无法停机,反复行硬性支气管镜及纤维支气管镜治疗,于上机第7天撤ECMO。转机期间予小剂量肝素[1~10 U/(kg·h)]抗凝,每3~6 h复查ACT、凝血功能,维持ACT 140~180 s,APTT 40~80 s。转机期间共输注悬浮红细胞630 mL,转机第3天SpO2 94% ~96%,ECMO膜前与膜后管道中血液颜色相近,膜后血气氧分压降低至63.8 mmHg,凝血全套检查中D-二聚体升高至8.78 mg/L,考虑氧合器内血栓可能,予更换氧合器及管道,后血气指标好转。撤离ECMO 6 h后顺利撤除呼吸机,次日转心内科普通病房。出院后随访3年无神经系统并发症,咯血无复发。
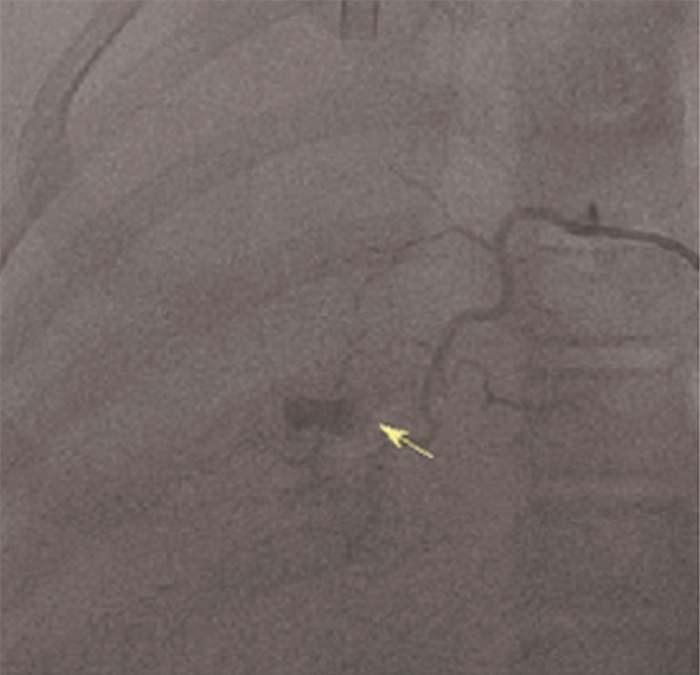
|
图 1 1例支气管动脉肺动脉瘘畸形患儿DSA检查,见支气管动脉肺动脉瘘破裂出血 Fig.1 DSA examination revealed bronchial artery-pulmonary artery fistula rupture and hemorrhage |
以“massive hemoptysis; extracorporeal membrane oxygenation”或“hemoptysis; ECMO”为检索词检索PubMed、SCI、Embase数据库,以“大咯血,体外膜肺氧合”为检索词,检索万方数据库及中国知网、中国生物医学文献服务系统,检索时间截至2021年6月,排除成人病例及重复文献等,共检索到6篇描述儿童肺部大咯血应用ECMO治疗的文献(表 1)。国内尚未见儿童大咯血应用ECMO治疗的相关报道。对检索到的6篇文献中13例患儿结合本文报道1例共14例进行汇总分析。本例为男性,11岁,以咳嗽、咯血为主要症状,咯血原因为支气管动脉- 肺动脉瘘破裂,予以动脉栓塞治疗。ECMO上机时间7 d,上机期间给予肝素抗凝,ACT维持在140~180 s。14例中,男6例,女8例,年龄35 d至15岁,平均年龄8.9岁。病因包括:脓毒血症2例,自身免疫性疾病8例,真菌感染1例,血管畸形2例,肺含铁血黄素沉积症1例,均因大咯血、呼吸衰竭而行ECMO治疗。平均上机时间约6.4 d。1例因心脏骤停行V - A模式;13例行V - V模式;2例因运行过程中出现循环不稳定,由V - V模式改为VV - A模式。抗凝管理:13例应用肝素抗凝,1例未提及是否抗凝;止血治疗:应用氨甲环酸止血1例,未用止血药11例,另外2例未明确指出是否应用止血药。手术治疗4例,其中肺叶切除术2例,血管内支架置入+病变血管栓塞治疗1例,血管栓塞治疗1例;10例未行手术治疗。14例患儿ECMO运行中未见出血增加。
| 表 1 儿童大咯血采取ECMO治疗的相关文献报道及预后汇总 Table 1 Summary of clinical and prognostic data of patients with massive hemoptysis in literature reports |
|
|
咯血在临床中发病率不高,新生儿患病率在1‰ ~4‰,主要发生于早产儿[11]。儿童咯血发病率更低,病因多样,包括肺炎、支气管炎、肺结核、支气管扩张症、呼吸道异物和肺含铁血黄素沉着症(idiopathic pulmonary hemosiderosis, IPH)、肺血管畸形等[12]。关于大咯血,过去被定义为24 h内咯血量达100~1 000 mL不等[13]。临床对于咯血量的精确评估存在一定困难,常被高估或低估[14-15]。实际上相对于咯血量而言,其他一些因素如出血速度、患者咳血和维持气道通畅的能力、治疗手段与速度,以及患儿潜在的生理储备等,更为重要。因此有学者认为,任何引起严重临床不良结局的咯血量,如呼吸道阻塞或低血压引起呼吸循环衰竭,都被认为是危及生命的咯血,这一定义侧重于咯血所致的临床后果,即咯血可导致血液吸入对侧肺、阻塞气道、需要机械通气的低氧血症、大失血和死亡[2, 16-17]。大咯血如未获得及时治疗,死亡率超过50%,介入和外科手术干预可使这一比例下降至7% ~18%[18]。大咯血患儿死亡原因常常不是失血性休克,而多为出血及凝血块堵塞气道,导致窒息、心跳骤停、呼吸循环衰竭[19]。
一、肺血管畸形的影像学诊断本例患儿发生大咯血的原因是肺血管畸形,该病在临床上并不常见,但却是儿童大咯血或反复咯血的主要原因[20]。患儿最终诊断为支气管动脉- 肺动脉瘘,该病作为肺血管畸形的一种,在咯血中尤为常见,有文献称90%的严重咯血都与支气管动脉有关,其来源、数量和解剖变异各不相同[21]。支气管动脉畸形患儿可无任何临床表现,或通常以突发性咯血为首发症状,可伴有胸闷、气促、心悸及胸痛等症状[22]。该病可引起大量咯血,严重者可出现休克甚至死亡,或由于不能及时将血凝块咳出而导致阻塞性肺不张、呼吸道梗阻等,属于临床急症,需要紧急救治。针对包括该类疾病在内的肺血管畸形的诊断主要是通过影像学检查,包括胸片、多排螺旋CT -血管造影技术(multi director computed tomography-computed tomography angiography,MDCT-CTA)、血管造影和支气管镜等。这些检查从肺实质、气管、支气管树、肺动脉、支气管动脉和其他体循环动脉等方面寻找咯血原因。其中,胸片最为快捷和简便,它可以定位33% ~82%的咯血位置,但无法明确具体出血部位或咯血是否累及对侧肺[23]。因此,若病情允许,可直接采用CT检查,其诊断咯血部位的敏感性可高达92%[24]。CTA检查可鉴别肺实质出血或肺血管出血,但其对于支气管黏膜浅表病变的诊断具有局限性,且与诊断性支气管镜相比,它无法提供组织学诊断。因此,CT和支气管镜可相互补充[13]。MDCT-CTA可以较精确地显示支气管动脉影像,包括其起源、形态、分布及走行,但也有其局限性,即重建后的图像分辨率较低,如果病变部位较隐蔽或血管管径较细,就很难出现阳性结果[22, 25]。此外,CTA检查中对于管径相对较细的动脉需更精细的检查过程,要求受检者较长时间屏气,但儿童患者通常难以配合,所以该检查有时并不能很好地显示支气管动脉的形态[26]。
二、大咯血的治疗及ECMO的应用大咯血的治疗涉及多个干预措施的同时或序贯进行。所有该类患者都应优先维持血流动力学稳定并保护气道,必要时需胸外、心内、介入、重症等多学科协同诊治[13]。笔者报道的该例患者在经ECMO治疗稳定病情后即请多学科会诊,行CTA检查寻找病因,随后又经数字减影血管造影(digital subtraction angiography, DSA)发现病变血管并给予栓塞治疗。介入治疗极大降低了大咯血患者的死亡率。然而,对于介入操作实施困难、呼吸或血流动力学不稳定、栓塞后出现早期复发或反复咯血的复杂动静脉畸形(arteriovenous malformations, AVMS)、创伤、真菌瘤、支气管血管瘘及医源性肺动脉破裂等患者,手术仍然是最有价值的干预手段[27-29]。文献复习中包含一例14岁系统性红斑狼疮大咯血患者,DSA检查发现脊髓前动脉分支于出血的支气管动脉,栓塞治疗有截瘫风险,故最终在ECMO支持下行肺叶切除术治疗[7]。ECMO在儿童大咯血治疗中的应用并不常见,其原因主要在于:在ECMO运行过程中需要全身肝素化抗凝,而出血性疾病通常被认为是全身肝素化抗凝的相对禁忌证。然而,有文献回顾了体外生命支持数据库中的所有肺出血病例,发现其中病例也支持ECMO在儿童肺出血中的应用[5]。在笔者所总结的文献中未见ECMO治疗中肺出血增加的情况,且有文献报道肺出血患者在ECMO上机24 h内其出血有减轻[5]。故笔者推荐在传统治疗方法难以控制急性肺出血和严重呼吸衰竭的情况下可以应用ECMO治疗,早期启动ECMO可以改善患者氧合,为诊断争取时间,进而行栓塞治疗或手术治疗以根治原发病[29]。不建议长时间呼吸机治疗后行ECMO治疗,因为如果在呼吸机相关性肺损伤发生后启动ECMO将不利于患者的恢复[5]。
(一) ECMO的插管选择ECMO治疗的第一步是快速有效地建立循环通道,包括插管型号、插管位置、插管方式的选择。年龄较小的患儿通常选择颈部插管,特别是静脉- 动脉(V - A)模式。股动静脉插管易导致远端肢体缺血,达不到流量要求,故不适合5岁以下儿童[30, 31]。插管方式可以通过切开血管插管以及经皮血管穿刺插管。切开血管插管相对安全有效,但创伤大、切口长;经皮穿刺插管创伤小且瘢痕小,但存在血肿以及假性动脉瘤的风险,且病情紧急时穿刺操作相对困难[32]。现在很多机构采取半切开血管插管,该方法可综合两者优点。本例患者年龄较大,选择穿刺插管创伤较小,撤离ECMO无需吻合血管,但需严格压迫止血。
(二) ECMO的抗凝管理ECMO治疗期间,应警惕出血和血栓形成的风险[33]。笔者总结的案例在肺出血治疗中仅有1例明确指出应用氨甲环酸止血,该类患者中肝素的应用通常需在出血控制后,事实上已有文献证实ECMO在没有全身抗凝的情况下可以短期运行[34-35]。但出血一旦稳定,应立即开始抗凝,以防止ECMO管路和氧合器内血栓形成。Kolovos等[5]报道的8例肺出血呼吸衰竭患者在ECMO治疗中均连续滴注肝素,目标ACT为160~180 s。目前儿童肺出血患者抗凝治疗的理想水平尚不清楚,但在咯血治疗中多数病例都使用肝素维持,且未见出血相关并发症的报道。Mongero等[36]报道一例ECMO治疗成人肺出血病例,在未使用肝素维持的情况下上机36 h后因出现管道内血栓而更换管道。
随着ECMO的发展,其在临床的应用也越来越广泛,出血倾向已不再是其绝对禁忌证。在一项关于先心病术后因残余梗阻无法停止体外循环而行ECMO治疗的研究中,患者ACT均维持在160~180 s,APTT维持在50~70 s,且治疗期间进行侵入性检查及手术治疗均未增加出血风险[37]。另外一项应用ECMO治疗不同气道疾病的可行性研究中,评估了ECMO在气道梗阻治疗中的作用,并制定了气道梗阻患者的ECMO使用指南[38]。该文献指出气道梗阻患者在手术期间插管困难时,ECMO可作为第二选择;或在围手术期有心脏骤停风险时可选择性使用ECMO;但急诊ECMO对突发呼吸骤停者抢救效果差,故推荐在心肺复苏40 min内行ECMO治疗。
综上所述,尽管目前ECMO并没有广泛应用于大咯血的治疗,但我们的实践及文献复习提示,对于威胁生命的大咯血患者,ECMO提供了潜在的治疗手段。对于该类患者的治疗,控制出血、稳定气道是关键,而ECMO的应用使得在治疗咯血原发病时无需考虑气道梗阻问题,且全身肝素化下运行ECMO并未增加出血风险。然而,ECMO技术应用于大咯血患者的救治还需要更多的临床实践和临床研究来评价。
利益冲突 作者声明不存在利益冲突
作者贡献声明 文献检索为王艳君、孔艳霞,论文调查与设计为王艳君、全雪丽,数据收集与分析为全雪丽、原艳丽、王风、王洁,论文结果撰写为王艳君、段勇涛,论文讨论分析为段勇涛、王风、王洁
| [1] |
Hurt K, Bilton D. Haemoptysis: diagnosis and treatment[J]. Acute Med, 2012, 11(1): 39-45. |
| [2] |
Fartoukh M, Khoshnood B, Parrot A, et al. Early prediction of in-hospital mortality of patients with hemoptysis: an approach to defining severe hemoptysis[J]. Respiration, 2012, 83(2): 106-114. DOI:10.1159/000331501 |
| [3] |
Lee TW, Wan S, Choy DK, et al. Management of massive hemoptysis: a single institution experience[J]. Ann Thorac Cardiovasc Surg, 2000, 6(4): 232-235. |
| [4] |
Radchenko C, Alraiyes AH, Shojaee S. A systematic approach to the management of massive hemoptysis[J]. J Thorac Dis, 2017, 9(Suppl 10): S1069-S1086. DOI:10.21037/jtd.2017.06.41 |
| [5] |
Kolovos NS, Schuerer DJ, Moler FW, et al. Extracorporal life support for pulmonary hemorrhage in children: a case series[J]. Crit Care Med, 2002, 30(3): 577-580. DOI:10.1097/00003246-200203000-00014 |
| [6] |
Gutierrez S, Shaw S, Huseni S, et al. Extracorporeal life support for a 5-week-old infant with idiopathic pulmonary hemosiderosis[J]. Eur J Pediatr, 2014, 173(12): 1573-1576. DOI:10.1007/s00431-013-2130-4 |
| [7] |
Kimura D, Shah S, Briceno-Medina M, et al. Management of massive diffuse alveolar hemorrhage in a child with systemic lupus erythematosus[J]. J Intensive Care, 2015, 3: 10. DOI:10.1186/s40560-015-0076-5 |
| [8] |
Chien YS, Chao YC, Lee KS, et al. Successful rescue of a ruptured tracheoinnominate fistula with extracorporeal membrane oxygenation, endovascular stents, and debranching surgical bypass[J]. Ann Thorac Cardiovasc Surg, 2020, 26(3): 166-169. DOI:10.5761/atcs.cr.18-00022 |
| [9] |
Nunez D, Rao R, Gray BW, et al. Massive hemoptysis from pulmonary histoplasmosis requiring emergency lung resection and extracorporeal membrane oxygenation[J]. Journal of Pediatric Surgery Case Reports, 2019, 48: 101260. DOI:10.1016/j.epsc.2019.101260 |
| [10] |
Ali C, Mathews N. Renal failure following an acute gastrointestinal illness: a case of P-Anca vasculitis[J]. Journal of Investigative Medicine, 2020, 68: 448-449. |
| [11] |
Behrman RE, Kliegman RM, Jenson HB. Nelson Textbook of Pediatrics[M]. 2000: 2638-2639.
|
| [12] |
Gaude GS. Hemoptysis in children[J]. Indian Pediatr, 2010, 47(3): 245-254. DOI:10.1007/s13312-010-0044-z |
| [13] |
Deshwal H, Sinha A, Mehta AC. Life-Threatening Hemoptysis[J]. Semin Respir Crit Care Med, 2021, 42(1): 145-159. DOI:10.1055/s-0040-1714386 |
| [14] |
Amirana M, Frater R, Tirschwell P, et al. An aggressive surgical approach to significant hemoptysis in patients with pulmonary tuberculosis[J]. Am Rev Respir Dis, 1968, 97(2): 187-192. DOI:10.1164/arrd.1968.97.2.187 |
| [15] |
Corey R, Hla KM. Major and massive hemoptysis: reassessment of conservative management[J]. Am J Med Sci, 1987, 294(5): 301-309. DOI:10.1097/00000441-198711000-00003 |
| [16] |
Ibrahim WH. Massive haemoptysis: the definition should be revised[J]. Eur Respir J, 2008, 32(4): 1131-1132. DOI:10.1183/09031936.00080108 |
| [17] |
Dweik RA, Stoller JK. Role of bronchoscopy in massive hemoptysis[J]. Clin Chest Med, 1999, 20(1): 89-105. DOI:10.1016/s0272-5231(05)70129-5 |
| [18] |
Sismanlar T, Aslan AT, Akkan K, et al. Successful embolization in childhood hemoptysis due to abnormal systemic arterial bleeding of the lung and review of the literature[J]. Clin Respir J, 2016, 10(6): 693-697. DOI:10.1111/crj.12289 |
| [19] |
Davidson K, Shojaee S. Managing massive hemoptysis[J]. Chest, 2020, 157(1): 77-88. DOI:10.1016/j.chest.2019.07.012 |
| [20] |
Cordovilla R, Bollo de Miguel E, Nuñez Ares A, et al. Diagnosis and treatment of hemoptysis[J]. Arch Bronconeumol, 2016, 52(7): 368-377. DOI:10.1016/j.arbres.2015.12.002 |
| [21] |
Larici AR, Franchi P, Occhipinti M, et al. Diagnosis and management of hemoptysis[J]. Diagn Interv Radiol, 2014, 20(4): 299-309. DOI:10.5152/dir.2014.13426 |
| [22] |
Uchiyama D, Fujimoto K, Uchida M, et al. Bronchial arteriovenous malformation: MDCT angiography findings[J]. AJR Am J Roentgenol, 2007, 188(5): W409-W411. DOI:10.2214/AJR.05.0631 |
| [23] |
Mal H, Rullon I, Mellot F, et al. Immediate and long-term results of bronchial artery embolization for life-threatening hemoptysis[J]. Chest, 1999, 115(4): 996-1001. DOI:10.1378/chest.115.4.996 |
| [24] |
Nielsen K, Gottlieb M, Colella S, et al. Bronchoscopy as a supplement to computed tomography in patients with haemoptysis may be unnecessary[J]. Eur Clin Respir J, 2016, 3: 31802. DOI:10.3402/ecrj.v3.31802 |
| [25] |
Remy-Jardin M, Dumont P, Brillet PY, et al. Pulmonary arteriovenous malformations treated with embolotherapy: helical CT evaluation of long-term effectiveness after 2-21-year follow-up[J]. Radiology, 2006, 239(2): 576-585. DOI:10.1148/radiol.2391050333 |
| [26] |
Yoon YC, Lee KS, Jeong YJ, et al. Hemoptysis: bronchial and nonbronchial systemic arteries at 16-detector row CT[J]. Radiology, 2005, 234(1): 292-298. DOI:10.1148/radiol.2341032079 |
| [27] |
Fartoukh M, Khalil A, Louis L, et al. An integrated approach to diagnosis and management of severe haemoptysis in patients admitted to the intensive care unit: a case series from a referral centre[J]. Respir Res, 2007, 8(1): 11. DOI:10.1186/1465-9921-8-11 |
| [28] |
Jean-Baptiste E. Clinical assessment and management of massive hemoptysis[J]. Crit Care Med, 2000, 28(5): 1642-1647. DOI:10.1097/00003246-200005000-00066 |
| [29] |
Sakr L, Dutau H. Massive hemoptysis: an update on the role of bronchoscopy in diagnosis and management[J]. Respiration, 2010, 80(1): 38-58. DOI:10.1159/000274492 |
| [30] |
Garcia AV, Jeyaraju M, Ladd MR, et al. Survey of the American Pediatric Surgical Association on Cannulation Practices in Pediatric ECMO[J]. J Pediatr Surg, 2018, 53(9): 1843-1848. DOI:10.1016/j.jpedsurg.2017.11.046 |
| [31] |
Kurkluoglu M, Hynes CF, Alfares FA, et al. Choice of peripheral venoarterial extra-corporeal membrane oxygenation cannulation site in patients above 15 kilograms[J]. J Card Surg, 2015, 30(5): 461-465. DOI:10.1111/jocs.12538 |
| [32] |
应力阳, 齐建川, 刘喜旺, 等. 颈部插管在重症患儿体外膜肺氧合治疗中的应用价值[J]. 临床小儿外科杂志, 2020, 19(10): 926-929. Ying LY, Qi JC, Liu XW, et al. Application of cervical intubation for severe diseases by extracorporeal membrane oxygenation in children[J]. J Clin Ped Sur, 2020, 19(10): 926-929. DOI:10.3969/j.issn.1671-6353.2020.10.012 |
| [33] |
Swaniker F, Kolla S, Moler F, et al. Extracorporeal life support outcome for 128 pediatric patients with respiratory failure[J]. J Pediatr Surg, 2000, 35(2): 197-202. DOI:10.1016/s0022-3468(00)90009-5 |
| [34] |
Ahmed SH, Aziz T, Cochran J, et al. Use of extracorporeal membrane oxygenation in a patient with diffuse alveolar hemorrhage[J]. Chest, 2004, 126(1): 305-309. DOI:10.1378/chest.126.1.305 |
| [35] |
Alexander GR. A retrospective review comparing the treatment outcomes of emergency lung resection for massive haemoptysis with and without preoperative bronchial artery embolization[J]. Eur J Cardiothorac Surg, 2014, 45(2): 251-255. DOI:10.1093/ejcts/ezt336 |
| [36] |
Mongero LB, Brodie D, Cunningham J, et al. Extracorporeal membrane oxygenation for diffuse alveolar hemorrhage and severe hypoxemic respiratory failure from silicone embolism[J]. Perfusion, 2010, 25(4): 249-254. DOI:10.1177/0267659110375327 |
| [37] |
刘明璐, 杨寅愉, 张蔚, 等. 先天性心脏病手术后残余解剖畸形患者体外膜肺氧合支持的效果分析[J]. 临床小儿外科杂志, 2021, 20(6): 518-524. Liu ML, Yang YY, Zhang W, et al. ECMO in patients with residual lesions after cardiac surgery[J]. J Clin Ped Sur, 2021, 20(6): 518-524. DOI:10.12260/lcxewkzz.2021.06.004 |
| [38] |
Kim CW, Kim DH, Son BS, et al. The feasibility of extracorporeal membrane oxygenation in the variant airway problems[J]. Ann Thorac Cardiovasc Surg, 2015, 21(6): 517-522. DOI:10.5761/atcs.oa.15-00073 |
 2022, Vol. 21
2022, Vol. 21


