目前,新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)的诊断及手术时机决策仍然是临床难题。当NEC进入进展期,医生需要在早期干预治疗、挽救缺血肠管和避免过度医疗之间进行权衡。超声检查对于NEC的诊断价值自20世纪80年代首次报道以来,经过多年实践,其诊断优势逐渐显现[1-2]。有专家提出将超声检查作为NEC的首选影像学检查手段[3]。亦有专家认为,超声检查适用于辅助诊断临床可疑而X线检查无阳性发现的NEC病例[4]。但目前我国超声医师对于NEC的诊断水平参差不齐,国内尚无统一的NEC超声诊断标准,且即使在医疗技术相对发达的欧美国家,也仅有58%的医疗机构通过超声检查来评估NEC[4]。本中心多年开展NEC超声检查,在超声诊断NEC方面积累了一定的经验,目前已将超声作为一种常规手段用于NEC的早期诊断和辅助决策手术时机。因此,本研究旨在探讨NEC患儿的腹部超声声像图特征,以及超声对于早期识别NEC重症患儿和手术决策的指导意义。
材料与方法 一、一般资料选取2017年9月至2020年3月首都儿科研究所收治并接受超声检查的45例NEC患儿为研究对象,病例入选标准:NEC诊断明确,Bell分期Ⅱ期及以上。排除合并先天性消化道畸形,如肠闭锁、先天性巨结肠患儿。收集患儿超声声像描述及临床资料(包括一般临床信息、母亲孕期合并症、出生史及相关实验室检查结果)。将患儿按照治疗方式分为保守治疗组和手术治疗组,保守治疗组以首次超声检查结果分析,手术治疗组以手术前超声检查结果分析。本研究已通过首都儿科研究所伦理委员会审批(编号:SHERRLLM2022001),并签署患儿监护人知情同意书。
二、超声扫查和图像分析方法所用仪器为Philips iU22型彩色多普勒超声诊断仪:C5-1凸阵探头,频率1~5 MHz;L12-5线阵探头,频率5~12 MHz;GE Logic E9彩色多普勒超声诊断仪,C1-6凸阵探头,频率1~6 MHz;ML6-15线阵探头,频率6~15 MHz。
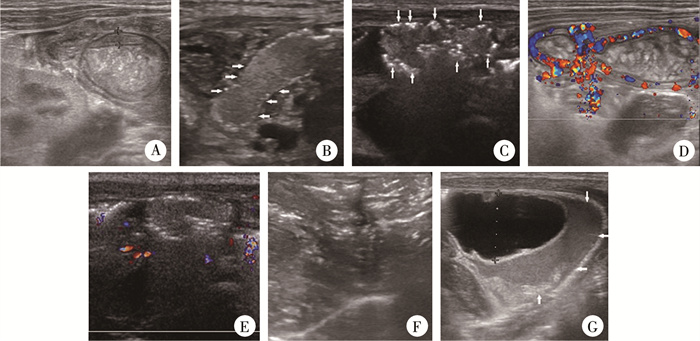
超声征象(图 1)判断依据:①肠壁增厚:肠壁厚度≥2.7 mm[5];②肠壁变薄:肠壁厚度≤1 mm[5];③肠壁积气:肠壁内有点状或簇状气体强回声;④肠壁血供评估:使用线阵探头,速度量程设置为8.6 cm/s,如血流信号>9个血流信号/cm2,定义为血流信号丰富;如未探及血流信号,则将速度量程降低至2.9 cm/s,如仍未探及血流信号,则定义为血流信号消失[3];⑤门脉积气:门脉主干及分支管腔内点状或线状分布强回声;⑥肠管蠕动:动态观察1 min,记录肠管有无蠕动;⑦透声差的积液:腹腔积液伴有较多絮状或点状沉积物或伴有分隔。超声医师在检查过程中对NEC患儿的临床分期均不知情。
|
图 1 坏死性小肠结肠炎超声征象示例 A:肠壁增厚(测量键之间);B:肠壁变薄(箭头);C:肠壁积气(箭头);D:肠壁血流信号增多;E:肠壁血流信号消失;F:门脉积气;G:透声差的积液(箭头) Fig.1 Ultrasonic signs of NEC |
采用SPSS 20.0进行数据整理和统计分析,计量资料进行Kolmogorov-Smirnov正态性检验,对于符合正态分布的资料以x±s表示,组间比较采用t检验。计数资料以例数和百分比表示,组间比较采用χ2检验;采用Kappa值对各个超声征象判断NEC病情程度与诊断性腹腔穿刺结果的一致性进行检验,
45例患儿中,男27例(27/45,60%),女18例(18/45,40%);年龄(17±12)d(1~45 d);早产儿38例(38/45, 84.4%),足月儿7例(7/45,15.6%);体重(1 677±500)g(1 090~3 850 g)。保守治疗组30例(66.7%),手术治疗组15例(33.3%)。手术治疗组患儿C-反应蛋白较保守治疗组高[(69.76±63.02 mg/L vs.(31.85±38.45)mg/L)],差异有统计学意义(P = 0.045)。两组在性别、年龄、体重、白细胞最高值、白细胞最低值、血小板最低值、血红蛋白最低值、生后窒息史以及母孕期合并症方面比较,差异均无统计学意义(P>0.05),详见表 1。
| 表 1 新生儿NEC保守治疗组与手术治疗组一般比较资料 Table 1 Clinical characteristics of non-surgical and surgical groups |
|
|
手术治疗组超声声像中,肠壁变薄(53.3%比0%)、肠壁分层消失(100%比16.7%)、肠壁血流信号消失(73.3%比0%)、肠管蠕动消失(93.3%比33.3%)、肠管扩张(46.7%比3.3%)、透声差的积液(80%比0%)阳性率高于保守治疗组,差异均有统计学意义(P<0.05);而两组肠壁增厚(86.7%比60%)、肠壁积气(73.3%比70%)、肠壁血流信号丰富(20%比13.3%)、门脉积气(13.3%比20%)、肠管狭窄(20%比0%)的阳性率差异无统计学意义(P>0.05)。组间结果比较详见表 2,表 3。
| 表 2 新生儿NEC保守治疗组与手术治疗组超声特点分析(例,%) Table 2 Sonographic features of non-surgical and surgical groups(n, %) |
|
|
| 表 3 超声检查征像对坏死性小肠结肠炎手术治疗的判断价值(%) Table 3 The diagnostic value of sonographic features in surgical decision making(%) |
|
|
对26例患儿进行诊断性腹腔穿刺以间接判断肠管活力。将诊断性腹腔穿刺评判结果与超声声像评判结果比较发现,超声声像中透声差的积液(Kappa值 = 0.69,P<0.001)、肠壁血流信号消失(Kappa值 = 0.62,P = 0.01)与诊断性腹腔穿刺结果有较好的一致性。
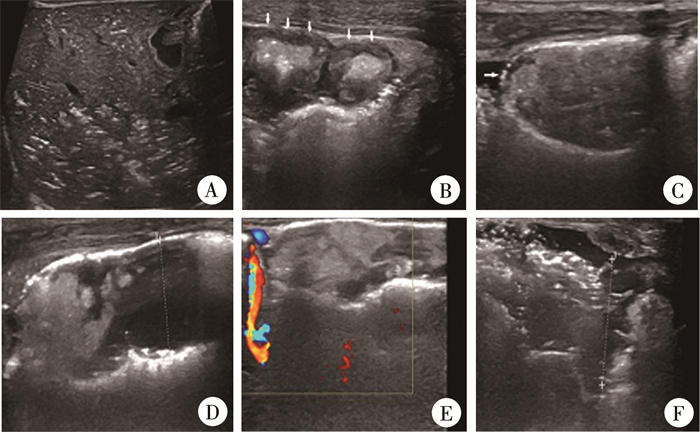
对差异有统计学意义的超声征象如肠壁变薄、肠壁分层消失、肠壁血流信号消失、病变肠管蠕动消失、肠管扩张、透声差的积液,进行两两组合分析,发现肠管蠕动消失与肠壁分层消失组合对NEC危重症患儿的识别可获得较高的敏感度(93.3%)和特异度(93.3%)。典型病例超声图像见图 2。
|
图 2 1例孕31周早产儿坏死性小肠结肠炎超声声像图 A:门脉积气;B:肠壁增厚,分层不清(箭头);C:局部肠壁变薄伴点状肠壁积气(箭头);D:局部肠管扩张(测量键);E:肠壁血流信号消失;F:透声差的积液(测量键) Fig.2 A preterm boy of Gestational Week 31 presented with abdominal distention and feeding intolerance at Day 12 after admission |
NEC是威胁新生儿生命的常见疾病之一,约1/3的患儿需要接受手术治疗。一项涉及26个国家、由173名内科及外科医生开展的调查显示,临床医生对于NEC诊断和治疗的认识尚存在较大差异,目前尚无准确、客观、可量化的诊治标准[6]。评估NEC病情的常用指标包括:临床表现、影像学特点、实验室检查结果等[7]。X线片提示气腹是目前公认的NEC绝对手术指征,但临床上有50%以上的患儿发生肠穿孔或坏死,而X线检查无气腹征象,这给手术时机的判断带来困难[8]。其他非特异性相对手术指征包括持续腹胀、非渗出性腹水、腹部可扪及包块、低血压、腹部X线提示固定肠袢等[9]。
一、肠壁积气与门脉积气对于NEC病情判断的价值肠壁积气和门脉积气与肠黏膜损伤相关,肠内气体或产气微生物产生的气体通过受损黏膜进入肠壁静脉系统,再进入门静脉,导致肠壁积气和门脉积气,但二者并非NEC的独有征象,还可出现于食物蛋白性小肠结肠炎综合征、十二指肠梗阻、紫绀型先心病[10-12]。不少学者研究了肠壁积气与门脉积气对于NEC病情判断的价值,但结果差异较大,结论尚存在争议。有研究提示,肠壁积气(OR:1.265,95%CI:1.172~2.778)和门脉积气(OR:1.824,95%CI:1.472~3.394)的出现均与不良预后相关[13]。而另一些学者认为,是否存在肠壁积气和门脉积气以及积气的程度与临床严重程度不一定相关,门脉积气的消失也不代表病情好转[14-15]。一项纳入了11篇文献、748例NEC患儿的Meta分析表明,肠壁积气、门脉积气与不良预后不相关[16]。本研究也发现肠壁积气与门脉积气还常出现在轻型病例中,并未发现肠壁积气、门脉积气与病情严重程度存在关联。因此,门脉积气和肠壁积气的临床意义需要重新审视,对存在门脉积气与肠壁积气的患儿在判断病情和手术指征时需要谨慎,防止过度检查或过早手术干预。
二、NEC不同病程中超声声像特点NEC不同病程中的肠道改变可表现在声像图上[17]。早期肠壁充血、水肿、渗出,声像图表现为肠壁增厚,黏膜及黏膜下水肿,肠壁血流信号增多。随着病情进展,肠壁发生缺血、坏死、脱落,肠穿孔风险增加,声像图表现为肠壁血流信号减少、肠壁分层消失、肠壁变薄。当病情进展至缺血坏死阶段时,肠管蠕动可消失,腹部X线片出现固定肠袢,而超声实时动态扫查是评估肠管蠕动情况的较便利手段。
NEC病理过程与超声声像图关联的分析为超声检查识别危重患儿、指导手术决策提供了理论基础。本研究也为这一过程提供了佐证,手术治疗组肠壁变薄、分层消失、肠壁血流信号消失和肠蠕动消失的比例较保守治疗组更高,而手术治疗组与保守治疗组在肠壁增厚、血流信号丰富2项声像特征上比较,差异并无统计学意义。一项Meta分析显示,肠管蠕动消失、肠壁血流信号消失与手术治疗相关,而肠壁增厚、肠壁变薄、肠壁的高灌注与手术治疗不相关[18]。另一项Meta分析表明,肠管蠕动消失、肠壁增厚、肠壁变薄与不良预后相关,其中肠蠕动消失是肠管直接征象中相关性最强的征象(OR:10.68,95%CI:1.65~69.02),而肠壁血供增多与不良预后不相关[16]。本研究中,手术治疗组肠壁增厚的阳性比例较保守治疗组稍高,但差异无统计学意义。临床各项研究结果的差异可能和疾病分期、检查时机和病例数有关,一项单中心研究中,内科治疗组和手术治疗组的肠壁增厚阳性率分别为41.3%、71.4%(P = 0.048),此研究选用了起病7 d和8~14 d的超声结果[19]。为了反映医生对于手术时机判断的诊断思路(手术时机的判断多是基于手术前超声检查结果),本研究中保守治疗组选用首次超声检查结果,手术治疗组选用术前超声结果,检查时机的差异可能造成了结果的不一致。因此,肠壁增厚的临床提示意义还需要进一步验证。以往鲜有研究将肠壁分层不清这一征象纳入分析,本研究发现所有手术患儿均出现了肠壁分层不清的特征,提示肠壁分层能反映病理过程的进展,当出现肠壁分层不清时,需要进一步收集其他参数综合判断是否有手术干预指征。尽管肠壁变薄、血流信号消失对不良预后的判断有较高的特异度(均为100%),但敏感度略低(分别为53.3%、73.3%),原因可能在于NEC患儿常伴有肠管胀气,因肠气干扰使病变严重段肠壁难以清晰显示;也可能是由于在缺血早期使用现有设备条件无法探测出病变肠道血液循环的细微改变。鉴于此,有学者提出应用超声造影技术提供的细微血流识别能力和可量化参数,可以减少设备和技术因素导致的误判,提高诊断的准确性[20]。
肠壁增厚或变薄、肠壁积气、肠壁分层、肠壁血供、肠管扩张、肠管蠕动、腹腔积液、门脉积气等单一征象的出现都不足以对病情的轻重进行准确评估。影像学检查手段对于肠管活力的判断往往基于对许多征象的综合分析。本研究表明,肠管蠕动消失和肠壁分层消失组合对于提示肠壁缺血的敏感度和特异度较高。前者提示肠管活力变化,后者反映肠管结构破坏。虽然蠕动对肠管活力有提示意义,但针对蠕动本来就偏弱的结肠而言,仅仅依靠蠕动这一指标容易造成假阳性,因此需要纳入肠壁结构等其他参数来提高诊断的准确性。
三、研究的局限性本研究为回顾性研究,且病例数较少,限制了统计检验效能,例如腹腔游离气体、肠管狭窄均为手术指征,但由于例数太少而导致组间差异无统计学意义,因此,其结论还需要后续更多样本量的前瞻性研究来验证。
综上所述,超声检查操作简便、无辐射、可以床边反复使用。运用超声检查综合评估NEC患儿肠道形态、血流分布、肠蠕动情况等以及肠外间接征象,对NEC患儿手术时机的评估有一定的参考价值。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为马亚、刘琴,论文调查设计为马亚、王峥嵘、张薇薇、任红雁,数据收集与分析为马亚、刘琴、张薇薇、任红雁,论文结果撰写为马亚,论文讨论分析为马亚、王峥嵘
| [1] |
Silverman NH. Echogenic microbubbles in necrotizing enterocolitis[J]. J Pediatr, 1984, 104(4): 639-640. DOI:10.1016/s0022-3476(84)80572-7 |
| [2] |
Tracy SA, Lazow SP, Castro-Aragon IM, et al. Is abdominal son-ography a useful adjunct to abdominal radiography in evaluating neonates with suspected necrotizing enterocolitis?[J]. J Am Coll Surg, 2020, 230(6): 903-911. DOI:10.1016/j.jamcollsurg.2020.01.027 |
| [3] |
Deeg KH. Sonographic and Doppler sonographic diagnosis of necrotizing enterocolitis in preterm infants and newborns[J]. Ultraschall Med, 2019, 40(3): 292-318. DOI:10.1055/a-0879-8110 |
| [4] |
Ahle M, Ringertz HG, Rubesova E. The role of imaging in the management of necrotising enterocolitis:a multispecialist survey and a review of the literature[J]. Eur Radiol, 2018, 28(9): 3621-3631. DOI:10.1007/s00330-018-5362-x |
| [5] |
Muchantef K, Epelman M, Darge K, et al. Sonographic and radiographic imaging features of the neonate with necrotizing enterocolitis:correlating findings with outcomes[J]. Pediatr Radiol, 2013, 43(11): 1444-1452. DOI:10.1007/s00247-013-2725-y |
| [6] |
Valpacos M, Arni D, Keir A, et al. Diagnosis and management of necrotizing enterocolitis:an international survey of neonatologists and pediatric surgeons[J]. Neonatology, 2018, 113(2): 170-176. DOI:10.1159/000484197 |
| [7] |
吕志宝, 盛庆丰. 新生儿坏死性小肠结肠炎的病因与诊治研究进展[J]. 临床小儿外科杂志, 2019, 18(5): 352-355. Lü ZB, Sheng QF. Advances in the etiology, diagnosis and treatment of neonatal necrotizing enterocolitis[J]. J Clin Ped Sur, 2019, 18(5): 352-355. DOI:10.3969/j.issn.1671-6353.2019.05.003 |
| [8] |
Robinson JR, Rellinger EJ, Hatch LD, et al. Surgical necrotizing enterocolitis[J]. Semin Perinatol, 2017, 41(1): 70-79. DOI:10.1053/j.semperi.2016.09.020 |
| [9] |
杜京斌, 陈永卫, 郭卫红, 等. 新生儿坏死性小肠结肠炎手术干预指征的回顾性研究[J]. 临床小儿外科杂志, 2019, 18(5): 368-371. Du JB, Chen YW, Guo WH, et al. Retrospective study of indications for surgical intervention inneonatal necrotizingenterocolitis[J]. J Clin Ped Sur, 2019, 18(5): 368-371. DOI:10.3969/j.issn.1671-6353.2019.05.006 |
| [10] |
Guo Y, Si S, Jia Z, et al. Differentiation of food protein-induced enterocolitis syndrome and necrotizing enterocolitis in neonates by abdominal sonography[J]. J Pediatr (Rio J), 2021, 97(2): 219-224. DOI:10.1016/j.jped.2020.03.001 |
| [11] |
Wettasinghe MC, Rosairo S, Kiriwattuduwa S, et al. Gastroduodenal emphysema with portal venous air due to congenital duodenal web in a child:a case report and review of literature[J]. Case Rep Pediatr, 2020, 2020: 9897208. DOI:10.1155/2020/9897208 |
| [12] |
Chew SJ, Victor RS, Gopagondanahalli KR, et al. Pneumatosis intestinalis in a preterm infant:should we treat all intestinal pneumatosis as necrotising enterocolitis?[J]. BMJ Case Rep, 2018, 2018: bcr2018224356. DOI:10.1136/bcr-2018-224356 |
| [13] |
Chen S, Hu Y, Liu Q, et al. Comparison of abdominal radiographs and sonography in prognostic prediction of infants with necrotizing enterocolitis[J]. Pediatr Surg Int, 2018, 34(5): 535-541. DOI:10.1007/s00383-018-4256-y |
| [14] |
Epelman M, Daneman A, Navarro OM, et al. Necrotizing enterocolitis:review of state-of-the-art imaging findings with pathologic correlation[J]. Radiographics, 2007, 27(2): 285-305. DOI:10.1148/rg.272055098 |
| [15] |
李禄全, 郭露, 张忠垚, 等. 新生儿坏死性小肠结肠炎诊断及内科治疗进展[J]. 中华实用儿科临床杂志, 2020, 35(11): 810-814. Li LQ, Guo L, Zhang ZY, et al. Recent advances of diagnostics and medical treatment for neonatal necrotizing enterocolitis[J]. Chin J Appl clin Pediatr, 2020, 35(11): 810-814. DOI:10.3760/cma.j.cn101070-20200225-00246 |
| [16] |
Cuna AC, Reddy N, Robinson AL, et al. Bowel ultrasound for predicting surgical management of necrotizing enterocolitis:a systematic review and Meta-analysis[J]. Pediatr Radiol, 2018, 48(5): 658-666. DOI:10.1007/s00247-017-4056-x |
| [17] |
Aliev MM, Dekhqonboev AA, Yuldashev RZ. Advantages of abdominal ultrasound in the management of infants with necrotizing enterocolitis[J]. Pediatr Surg Int, 2017, 33(2): 213-216. DOI:10.1007/s00383-016-4017-8 |
| [18] |
Janssen Lok M, Miyake H, Hock A, et al. Value of abdominal ultrasound in management of necrotizing enterocolitis:a systematic review and Meta-analysis[J]. Pediatr Surg Int, 2018, 34(6): 589-612. DOI:10.1007/s00383-018-4259-8 |
| [19] |
陈仁慧, 石永言, 富建华, 等. 腹部超声在新生儿坏死性小肠结肠炎诊断中的价值[J]. 中华新生儿科杂志(中英文), 2019, 34(5): 367-371. Chen RH, Shi YY, Fu JH, et al. Diagnostic value of abdominal ultrasonography for neonatal necrotizing enterocolitis[J]. Chin J Neonatol, 2019, 34(5): 367-371. DOI:10.3760/cma.j.issn.2096-2932.2019.05.010 |
| [20] |
Al-Hamad S, Hackam DJ, Goldstein SD, et al. Contrast-enhanced ultrasound and near-infrared spectroscopy of the neonatal bowel:novel, bedside, noninvasive, and radiation-free imaging for early detection of necrotizing enterocolitis[J]. Am J Perinatol, 2018, 35(14): 1358-1365. DOI:10.1055/s-0038-1655768 |
 2022, Vol. 21
2022, Vol. 21


