新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是早产儿最常见的胃肠道急症,30% ~50%的患儿需要手术干预[1-2]。目前,多数患儿采取剖腹探查、坏死肠管切除和暂时性小肠造瘘术治疗[3]。但肠造瘘术后并发症的发生率很高,可达20% ~40%[4]。由于肠道连续性中断、肠吸收面积减少,术后造口高流量腹泻(high-output stoma, HOS)成为常见并发症之一。既往研究表明,术后腹泻导致的脱水、电解质紊乱是小肠造瘘术患儿再次入院的最常见原因[5-6];也是导致患儿体重不增长,严重者出现短肠综合征,住院期间感染发生率更高、住院时间延长等的原因[7-10]。因此,NEC小肠造瘘术后造口高流量腹泻的监测极其重要,但目前NEC小肠造瘘术后造口高流量腹泻的相关文献报道罕见。本文回顾性分析广州市妇女儿童医疗中心新生儿外科监护室近5年来因NEC行小肠造瘘术患儿的临床资料,分析NEC患儿术后出现造口高流量腹泻的相关因素,以指导临床工作。
材料与方法 一、一般资料收集2017年7月至2021年6月在广州市妇女儿童医疗中心新生儿外科监护室因NEC行小肠造瘘术患儿的临床资料进行回顾性分析。入选标准:新生儿期(足月儿出生28 d内,早产儿校正胎龄44周内)因NEC行小肠造瘘术的患儿,手术方式包括小肠(空、回肠)双腔或单腔造瘘术。排除标准:①小肠造瘘术后并发严重肠道或其他部位感染、死亡或放弃治疗;②因NEC后肠狭窄行小肠造瘘术;③有影响生长发育的染色体异常及先天性遗传代谢性疾病;④合并肠道以外畸形。研究期间共有94例患儿行小肠造瘘术,其中18例不符合纳入标准,最终76例纳入研究,根据术后是否发生造口高流量腹泻分为腹泻组(n = 25)和非腹泻组(n = 51)。本研究经广州市妇女儿童医疗中心医学伦理委员会批准。
二、资料收集方法从病历系统中提取入围患儿信息,包括性别、出生胎龄、出生体重、分娩方式、术前是否需呼吸支持、术前是否需使用血管活性药物、手术时矫正胎龄及体重、NEC分期及分型、造瘘近端小肠剩余长度、造瘘术后达全肠内营养时间、造瘘术后住院时间、再入院发生率等。
三、相关定义1. NEC分期及分型:参考改良Bell分期诊断标准,所有纳入研究的患儿均在NEC IIB期及以上;根据病变范围,将NEC分为局灶型、多病灶型及广泛病变型3种类型[1,3]。
2.造瘘手术时矫正胎龄:指出生胎龄加上手术时日龄,以周为单位。
3.造瘘近端小肠剩余长度:指从屈氏韧带到造口近端肠管的测量长度,以cm为单位。
4.造口高流量腹泻:指造瘘口排出大便为稀水样,量超过40 mL·kg-1·d-1,且伴有中度以上脱水需急诊留观超过24 h或需入院治疗者[8-9,11]。
四、统计学处理应用SPSS 23.0统计软件进行数据分析。正态分布的计量资料以x ±s表示,组间比较采用t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验;计数资料以例(%)表示,组间比较采用χ2检验,频数<5时采用Fisher精确概率法。单因素分析得到具有统计学意义的变量,采用二分类Logistic回归分析,获得NEC小肠造瘘术后患儿发生造口高流量腹泻的独立危险因素,并计算比值比(odds ratio, OR)与95%置信区间(confidence interval, CI)。绘制ROC曲线,分析独立相关因素对NEC小肠造瘘术后患儿发生造口高流量腹泻的预测能力。以P<0.05为差异有统计学意义。
结果 一、两组患儿基本资料比较76例纳入研究的患儿中,男61例,女15例,早产儿64例,足月儿12例,中位出生胎龄33+4周(27+2~41周),中位出生体重1 855 g(830~3 520 g);25例(32.9%)发生造口高流量腹泻。如表 1所示,腹泻组和非腹泻组在出生体重、出生胎龄、术前需呼吸支持等方面比较,差异有统计学意义(P<0.05)。
| 表 1 NEC小肠造瘘术后腹泻组和非腹泻组患儿基本资料比较 Table 1 Comparison of basic profiles between two groups |
|
|
如表 2所示,两组手术时矫正胎龄及体重、NEC分期及分型、造瘘近端小肠剩余长度等情况比较,差异有统计学意义(P<0.05)。另外,与非腹泻组相比,腹泻组患儿造瘘术后达全肠内营养时间更长、住院时间更长、再入院发生率更高,差异均具有统计学意义(P<0.05)。
| 表 2 NEC小肠造瘘术后腹泻组和非腹泻组患儿手术及预后情况比较 Table 2 Comparison of operation and prognosis between two groups |
|
|
对单因素分析中差异有统计学意义的指标进行二分类Logistic回归分析,造瘘近端小肠剩余长度(OR = 1.220, 95%CI:1.108~1.343)是NEC小肠造瘘术后发生造口HOS的独立危险因素(P<0.05),近端剩余小肠长度每减少0.2 cm,发生HOS的风险增加1.22倍。
四、造瘘近端小肠剩余长度对NEC患儿小肠造瘘术后发生造口HOS的预测价值将造瘘近端小肠剩余长度作为连续变量进行ROC曲线分析,如图 1所示,ROC曲线下面积(area under curve, AUC) = 0.926(95%CI:0.849~1.000, P<0.05), 灵敏度为92%,特异度为74%。约登指数取最大值时对应的近端剩余小肠长度为86.5 cm,其对应的灵敏度为84%,特异度为96%。
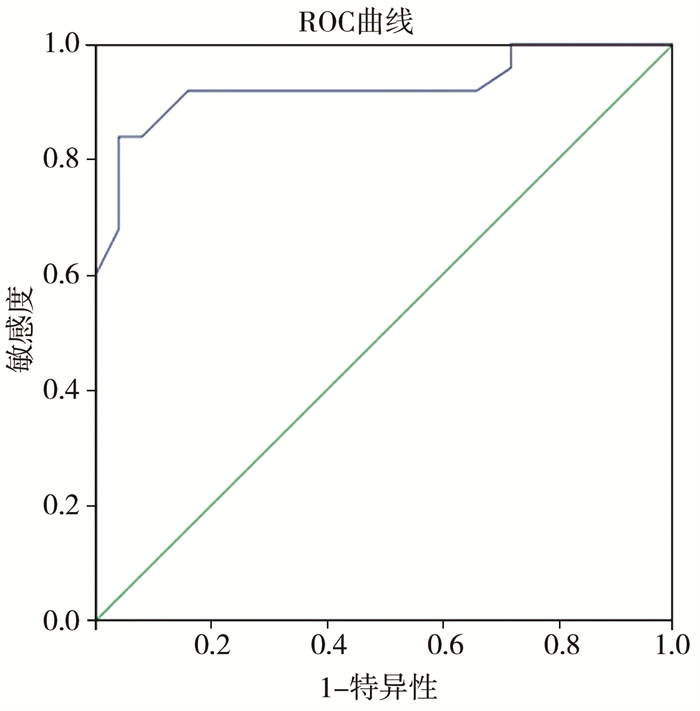
|
图 1 NEC小肠造瘘术后造瘘近端剩余小肠长度预测造口HOS的ROC曲线 Fig.1 ROC curve of residual length of proximal enterostomy |
NEC是新生儿期最常见的胃肠道急症,也是早产、低出生体重儿较严重的并发症之一,常需进行小肠造瘘术[12-13]。但小肠造瘘术后容易出现造口高流量腹泻,导致患儿术后再次入院及营养不良,增加疾病负担。然而,目前NEC小肠造瘘术后造口高流量腹泻的相关研究较少。本中心采用回顾性分析方法,对NEC小肠造瘘术患儿的基本资料、手术情况及预后资料进行分析,结果显示,造瘘近端小肠剩余长度是NEC患儿小肠造瘘术后发生造口HOS的独立相关因素,有32.9%的患儿在肠造瘘闭合术前曾发生高流量腹泻。既往在关于NEC术后并发症的研究中,仅有少数研究关注HOS的发生,发生率为5% ~10%[14-15]。本中心此前一项关于NEC小肠造瘘术的研究提示,NEC小肠造瘘术后HOS的发生率约为21.4%[16]。既往有研究表明,出生体重越低,小肠造瘘术后并发症的发生率越高,但出生体重对HOS的具体影响不详[11]。
本研究中,NEC小肠造瘘术后腹泻组患儿出生体重比非腹泻组更低,手术时体重也更轻,单因素分析显示差异有统计学意义(P<0.05)。但在多因素分析中,出生体重和手术时体重均不是HOS发生的独立相关因素。此外,腹泻组患儿出生胎龄更低,手术时纠正胎龄更低,手术前更多需要使用呼吸机辅助通气,分期及分型的等级更差,差异均有统计学意义。但在多因素分析中,以上因素均不是HOS发生的独立相关因素。这可能是因为低体重、低胎龄、术前需使用呼吸机辅助通气以及分型、分期更差的患儿病情相对较重,对手术的耐受相对较差所致。但是,NEC小肠造瘘术后发生造口HOS除受以上因素影响外,可能更多受到造瘘近端剩余小肠长度的影响。
既往研究显示,最有可能导致NEC小肠造瘘术发生短肠综合征的因素是造瘘近端小肠剩余长度过短[9]。而短肠综合征的基础是反复造口高流量腹泻,不能在一定时间内建立良好的全肠内营养。但是,关于造口高流量腹泻与造瘘近端小肠剩余长度的相关性如何,以及是否存在必然联系,目前暂无相关研究。本研究中,造瘘近端剩余小肠越短的患儿发生造口高流量腹泻的风险越高,且是NEC患儿术后造口高流量腹泻的独立相关因素(OR = 1.220,P<0.05)。造瘘近端剩余小肠长度每减少0.2 cm,发生造口HOS的风险将会增加1.22倍。因此,我们认为造瘘近端小肠剩余长度可以用于评估NEC患儿术后是否发生造口高流量腹泻。
迄今为止,尚未见NEC造瘘术后发生造口高流量腹泻相关因素预测的相关报道。因此,本研究进一步对造成NEC患儿术后造口高流量腹泻的因素进行ROC曲线分析,结果显示,将造瘘近端小肠剩余长度作为连续变量绘制ROC曲线,曲线下面积(area under curve, AUC)为0.926(95%CI:0.849~1.000,P<0.001), 灵敏度为92%,特异度为74%。当近端剩余小肠长度为86.5 cm时,对应的灵敏度为84%,特异度为96%(P<0.05),说明造瘘近端小肠剩余长度对NEC小肠造瘘术后发生造口HOS具有良好的预测能力。对于此类患儿,临床医生应高度警惕造口HOS的发生,尽可能加以避免并及时干预。
Messaris等[5]通过分析20年间小肠造瘘患儿的资料,发现该群患儿术后60 d内再入院率为16.9%,而其中43.1%的患者住院是因为腹泻导致脱水。Hayden等[6]同样分析了一群回肠造瘘术后再次入院的患儿资料,发现近20%的患儿因造口高流量腹泻而再入院。而在本研究中,76例患儿中有13例(15.8%)再次入院,其中12例再入院的原因是造口高流量腹泻。另外,既往研究显示,小肠造瘘术后造口高流量腹泻严重者可出现短肠综合征,致使患儿住院期间感染的发生率更高、住院时间延长[9-10]。在本研究中,我们同样发现,NEC小肠造瘘术后腹泻组患儿术后达全肠内营养的时间及住院时间均明显长于非腹泻组,差异具有统计学意义(P<0.05)。既往的研究发现,行小肠造瘘术的大部分患儿需要使用要素配方喂养,因其可能更有利于提高营养物质的吸收,从而减少造口高流量腹泻[9,18]。本研究纳入的患儿在术后再次建立喂养时,一般使用深度水解配方并使用至瘘口闭合时。其次,喂养方式的选择对小肠造瘘术后患儿HOS的发生也有影响;与间断喂养相比,持续性喂养可以减少造口高流量腹泻的发生,增加喂养耐受性,更好地促进体重增长[9,19]。此外,因造口高流量腹泻患儿不能有效建立全肠内营养,导致营养不良时,可考虑尽早闭合瘘口,恢复肠道的连续性,可以很好改善患儿的营养状态[16]。因此,对于NEC行小肠造瘘术的患儿,我们应准确记录每日造口排便量。对于容易发生造口高流量腹泻的高危患儿,在喂养的配方和方式上可以进行更好地选择,也可选择早期闭合瘘口,尽早改善患儿营养状态。
综上所述,造口HOS是新生儿NEC小肠造瘘术后常见并发症之一,造瘘近端小肠长度是NEC小肠造瘘术后发生造口HOS的独立相关因素,造瘘近端剩余小肠长度能够较好预测造口HOS是否发生。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为林土连,论文设计调查为林土连、吴强、何秋明、钟微,数据收集与分析为林土连、彭艳芬、吕俊健,论文结果撰写为林土连,论文讨论分析为林土连、何秋明、钟微
| [1] |
Neu J, Walker WA. Necrotizing enterocolitis[J]. N Engl J Med, 2011, 364(3): 255-264. DOI:10.1056/NEJMra1005408 |
| [2] |
Carr BD, Gadepalli SK. Does surgical management alter outcome in necrotizing enterocolitis?[J]. Clin Perinatol, 2019, 46(1): 89-100. DOI:10.1016/j.clp.2018.09.008 |
| [3] |
中华医学会小儿外科分会新生儿外科学组. 新生儿坏死性小肠结肠炎外科手术治疗专家共识[J]. 中华小儿外科杂志, 2016, 10(10): 724-728. Group of Neonatal Surgery, Branch of Pediatric Surgery, Chinese Medical Association. Expert Consensus on Surgical Treatment of Neonatal Necrotizing Enterocolitis[J]. Chin J Pediatr Surg, 2016, 10(37): 724-727. DOI:10.3760/cma.j.issn.0253-3006.2016.10.002 |
| [4] |
Bethell G, Kenny S, Corbett H. Enterostomy-related complications and growth following reversal in infants[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(3): F230-F234. DOI:10.1136/archdischild-2016-311126 |
| [5] |
Messaris E, Sehgal R, Deiling S, et al. Dehydration is the most common indication for readmission after diverting ileostomy creation[J]. Dis Colon Rectum, 2012, 55(2): 175-180. DOI:10.1097/DCR.0b013e31823d0ec5 |
| [6] |
Hayden DM, Pinzon MC, Francescatti AB, et al. Hospital readmission for fluid and electrolyte abnormalities following ileostomy construction:preventable or unpredictable?[J]. J Gastrointest Surg, 2013, 17(2): 298-303. DOI:10.1007/s11605-012-2073-5 |
| [7] |
Chong C, van Druten J, Briars G, et al. Neonates living with enterostomy following necrotising enterocolitis are at high risk of becoming severely underweight[J]. Eur J Pediatr, 2019, 178(12): 1875-1881. DOI:10.1007/s00431-019-03440-6 |
| [8] |
彭艳芬, 何秋明, 郑海清, 等. 新生儿小肠造瘘术后营养状态及危险因素分析[J]. 中华新生儿科杂志, 2018, 33(5): 350-353. Peng YF, He QM, Zheng HQ, et al. Nutritional outcomes and risk factors of neonatal enterostomy[J]. Chin J Neonatology, 2018, 33(5): 350-353. DOI:10.3760/cma.j.issn.2096-2932.2018.05.007 |
| [9] |
中华医学会小儿外科学分会新生儿学组. 新生儿坏死性小肠结肠炎小肠造瘘术后临床治疗专家共识[J]. 中华小儿外科杂志, 2016, 37(8): 563-567. Group of Neonatal Surgery, Branch of Pediatric Surgery, Chinese Medical Association. Expert Consensus on Clinical Treatment of Neonatal Necrotizing Enterocolitis after Enterostomy[J]. Chin J Pediatr Surg, 2016, 37(8): 563-567. DOI:10.3760/cma.j.issn.0253-3006.2016.08.002 |
| [10] |
Canada NL, Mullins L, Pearo B, et al. Optimizing perioperative nutrition in pediatric populations[J]. Nutr Clin Pract, 2016, 31(1): 49-58. DOI:10.1177/0884533615622639 |
| [11] |
Crealey M, Walsh M, Awadalla S, et al. Managing newborn ileostomies[J]. Ir Med J, 2014, 107(5): 146-148. |
| [12] |
Samuels N, Ra VDG, Rcj DJ, et al. Risk factors for necrotizing enterocolitis in neonates:a systematic review of prognostic studies[J]. Bmc Pediatrics, 2017, 17(1): 105. DOI:10.1186/sl2887-0l7-0847-3 |
| [13] |
赵绪稳, 胡博, 戴春娟, 等. 新生儿坏死性小肠结肠炎伴发肠穿孔的危险因素研究[J]. 临床小儿外科杂志, 2021, 20(11): 1042-1047. Zhao XW, Hu B, Dai CJ, et al. Risk factors of intestinal perforation in neonatal necrotizing enterocolitis[J]. J Clin Ped Sur, 2021, 20(11): 1042-1047. DOI:10.12260/lcxewkzz.2021.11.009 |
| [14] |
Sparks EA, Khan FA, Fisher JG, et al. Necrotizing enterocolitis is associated with earlier achievement of enteral autonomy in children with short bowel syndrome[J]. J Pediatr Surg, 2016, 51(1): 92-95. DOI:10.1016/j.jpedsurg.2015.10.023 |
| [15] |
Bælum JK, Rasmussen L, Qvist N, et al. Enterostomy complications in necrotizing enterocolitis(NEC)surgery, a retrospective chart review at Odense University Hospital[J]. BMC Pediatr, 2019, 19(1): 110. DOI:10.1186/s12887-019-1488-5 |
| [16] |
彭艳芬, 何秋明, 林土连, 等. 新生儿坏死性小肠结肠炎不同关瘘时机并发症及营养状况分析[J]. 中华新生儿科杂志, 2021, 36(6): 43-46. Peng YF, He QM, Lin TL, et al. Complications and nutritional status following different timings of post-enterostomy stoma reversal in necrotizing enterocolitis[J]. Chin J Neonatology, 2021, 36(6): 43-46. DOI:10.3760/cma.j.issn.2096-2932.2021.06.009 |
| [17] |
Kargl S, Wagner O, Pumberger W, et al. Ileostomy complications in infants less than 1500 grams-frequent but manageable[J]. J Neonatal Surg, 2017, 6(1): 4. DOI:10.21699/jns.v6i1.451 |
| [18] |
王敏, 朱海涛, 沈淳. 新生儿小肠造瘘术后肠内营养制剂作用观察[J]. 中华小儿外科杂志, 2017, 38(9): 660-665. Wang M, Zhu HT, Shen C, et al. Effect of enteral nutrition on intestinal enterostomy in neonates[J]. Chin J Pediatr Surg, 2017, 38(9): 660-665. DOI:10.3760/cma.j.issn.0253-3006.2017.09.004 |
| [19] |
Jiang W, Zhang J, Lü X, et al. Continuous tube feeding versus intermittent oral feeding for intermediate position enterostomy in infants[J]. Asia Pac J Clin Nutr, 2018, 27(2): 313-317. DOI:10.6133/apjcn.032017.21 |
 2022, Vol. 21
2022, Vol. 21


