骨母细胞瘤是一种以骨母细胞增生、排列规整或分化不全的骨样组织沉积为主要特点的成骨性肿瘤,约占原发性骨肿瘤的1%[1-2]。本病多见于10~30岁人群, 男女比例约为2.5 ∶ 1[3]。骨母细胞瘤可见于全身任何骨骼,最常见于脊柱,其次为下肢长骨,足踝部相对少见,而发生于距骨的骨母细胞瘤目前国内尚未见文献报道[3-4]。本文报道1例儿童距骨骨母细胞瘤患儿,并结合相关文献,总结骨母细胞瘤的临床表现、影像学和组织学特点。
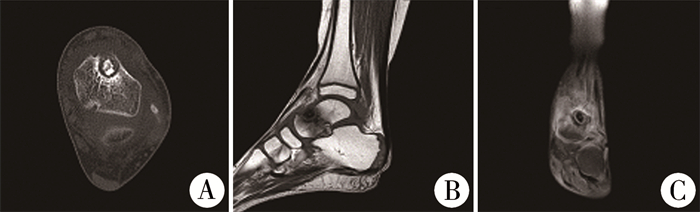
患儿女,5岁7个月,因“左踝间歇性疼痛6个月”于2018年5月11日收入浙江大学医学院附属儿童医院。患儿有6个月前左踝轻微扭伤病史,随之出现左踝部间歇性疼痛,程度较轻,不影响行走及左踝活动。外院X线检查未见明显异常,未予治疗。发病以来无发热、盗汗、消瘦及其他关节疼痛表现,后左踝疼痛加重,口服塞来昔布每日0.2 mg,连续2周,症状无缓解。入院查体:一般情况良好,无跛行,左踝关节前方轻度肿胀,表面皮肤完整,皮肤温度不高,局部未扪及肿块,左距骨前方压痛,左踝关节活动范围正常,左足感觉无减退。血常规、C反应蛋白、红细胞沉降率、前降钙素、碱性磷酸酶、肿瘤标志物检查结果均正常。胸片未见明显异常。左踝X线片提示:左侧距骨类圆形骨质破坏伴周围软组织肿胀;CT平扫提示:左距骨膨胀性骨质破坏,周围可见硬化带,背侧骨皮质变薄,中央可见斑块状钙化,良性骨肿瘤倾向,考虑为骨母细胞瘤或骨样骨瘤可能(图 1A);MRI平扫提示:左距骨颈背侧卵圆形病灶,T1WI和T2WI均呈低信号,内可见点状高信号影,周围可见大片骨髓水肿,考虑左侧距骨骨母细胞瘤可能,感染性病变待排除(图 1B、图 1C)。
|
图 1 距骨骨母细胞瘤患儿术前影像学检查结果 Fig.1 Preoperative imaging results of the child 注 A: CT平扫见左距骨溶骨性病灶,中央可见斑块状钙化, 周围可见硬化带;B: MRI冠状位见距骨背侧卵圆形病灶,在T1WI呈低信号,内见点状高信号;C: 病灶在T2WI呈低信号,周围可见大片骨髓水肿 |
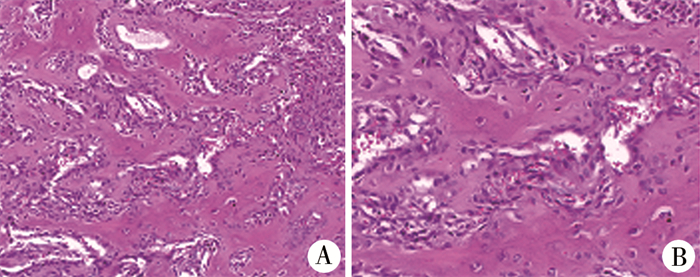
经完善术前检查,排除手术禁忌证后在全身麻醉下行左距骨骨肿瘤刮除植骨术,术中见肿瘤位于左距骨颈部,呈实性,边界清楚,周围骨质破坏,距骨骨皮质完整,骨膜及软组织未见侵犯;术中彻底刮除肿瘤,打磨周围硬化骨,人工骨充填空腔。切除物送病理检查。术后予石膏托固定左踝关节。病理检查结果:镜下见大量骨母细胞增生,伴有丰富骨样组织和骨小梁,基质内富含血管(图 2A、图 2B),确诊为左距骨骨母细胞瘤。
|
图 2 距骨骨母细胞瘤患儿病理检查结果 Fig.2 Pathological examination results of the child 注 A: 肿瘤组织内见增生的骨母细胞、丰富的骨样组织和骨小梁,肿瘤富含血管,可见红细胞外渗(HE,×200);B: 宽大的骨小梁被增生的骨母细胞包绕(HE,×400) |
患儿手术后恢复顺利,无感染、出血等并发症,切口愈合良好;术后1个月拆除石膏负重行走,左踝疼痛症状基本消失,术后6个月按照美国骨科足踝协会(the american orthopaedic foot & ankle society, AOFAS)标准评分为100分。术后12个月及术后18个月复查CT,无肿瘤复发(图 3)。

|
图 3 距骨骨母细胞瘤患儿术后12个月和术后18个月CT检查结果 Fig.3 Follow-up CT images at Months 12 and 18 post-operation 注 A:手术12个月;B:术后18个月 |
讨论 骨母细胞瘤是一种临床少见的骨肿瘤,其病因不明,最早于1932年由Jaffe等[5]报道,1956年Lichtenstein和Jaffe[6-7]将其命名为良性骨母细胞瘤。
Temple等[8]对41例足踝部骨母细胞瘤患者进行回顾性分析,发现97%的患者表现为疼痛,28.6%有关节周围肿胀,约1/3的患者发病前有足踝部外伤史;从出现症状到最终确诊平均时间3个月。本例患儿肿瘤位于左侧距骨颈背侧,有左踝外伤病史,以疼痛为主要表现,从发病到最终确诊间隔6个月,临床表现与既往文献报道基本一致[8-9]。
骨母细胞瘤的影像学表现多样,X线检查典型表现为边界清晰的溶骨性骨质破坏,周围常有硬化带,可伴有不同程度瘤内钙化或骨化[4]。在Temple等[8]报道的41例足踝部骨母细胞瘤中,有23例(23/41,56.1%)伴有瘤内钙化;10例(10/41,24.4%)可见骨膜反应;3例(3/41,7.32%)合并病理性骨折。相比于X线检查,CT扫描能够更好地显示受累部位、骨质破坏程度和瘤内钙化情况[3]。由于含有大量疏松结缔组织和血管基质,骨母细胞瘤在MRI常表现为T1WI低信号或等信号, T2WI呈高信号或等信号。组织学上,骨母细胞瘤主要由大量增殖的骨母细胞、丰富的骨样组织和富含血管的疏松结缔组织构成,骨小梁分化成熟,周围可见单层或多层骨母细胞围绕[10]。本例X线及CT检查见左距骨膨胀性骨质破坏、中央斑块状钙化和周围硬化带;MRI平扫见左距骨卵圆形低T1、低T2病灶,内可见点状高信号影,病灶周围水肿明显;组织学检查见肿瘤由增生的骨母细胞、丰富的骨样基质和富含血管的间质组成,其影像学和组织学特点符合骨母细胞瘤诊断。近年来,骨肿瘤的分子病理学诊断发展迅速,已成为传统诊断的重要补充。2018年Fittall等[11]对6例骨母细胞瘤和骨样骨瘤进行全基因组测序,发现5例(5/6,83.3%)有转录因子FOS重排,1例(1/6,16.7%)有FOSB重排;进一步用荧光原位杂交技术对55例骨母细胞瘤和骨样骨瘤进行研究,发现48例(48/55,87.3%)FOS信号分离,1例(1/55,1.8%)FOSB信号分离。
骨母细胞瘤需与骨样骨瘤、低级别骨肉瘤等相鉴别。骨样骨瘤与骨母细胞瘤极为相似,甚至有学者认为它们是同一种疾病[11]。在肿瘤大小上,骨样骨瘤呈限制性生长,直径多小于1.5 cm;而骨母细胞瘤呈非限制性生长,通常直径超过2 cm[3-4]。在发病部位上,前者最常见于下肢长骨,后者多位于脊柱。临床表现上,前者所致疼痛常能用水杨酸类药物缓解,而后者不能。影像学表现上,前者病灶周围硬化带更为多见,后者膨胀性改变更明显[4, 12]。在组织病理学上,很多学者认为两者几乎无法鉴别[12-13]。但前者中央区可见骨样组织形成的微小瘤巢;后者骨样组织密度更低,骨小梁结构更宽大,间质内血管更为丰富[12]。足踝部骨母细胞瘤需要与低级别骨肉瘤相鉴别,影像学上,足踝部骨肉瘤通常没有Codman三角和“日光射线征”等典型征像,易与骨母细胞瘤混淆[14]。组织学上,骨肉瘤骨小梁间肿瘤细胞密度更高,增生更为明显,可见病理性核分裂,肿瘤常浸润性破坏骨皮质或骨外软组织[15]。对于组织学鉴别困难的骨母细胞瘤和骨肉瘤,Lam和Amary[16-17]报道荧光原位杂交和免疫组织化学法检测肿瘤细胞FOS表达有较高的辅助诊断价值。
手术是骨母细胞瘤的传统治疗方法,主要包括肿瘤完整切除术和刮除术[3, 18]。一些学者认为Enneking分期与预后密切相关,因此建议据此制定手术计划[1, 19]。按照Enneking分期系统,骨母细胞瘤可以分为静止期、活动期和侵袭期[20-21]。Haroop等[19]进行的一项系统评价研究发现,Enneking分期为活动期的骨母细胞瘤手术后复发率为10% ~15%,而Enneking分期为侵袭期者复发率高达50%。因此,他们强烈推荐对Enneking分期为活动期的骨母细胞瘤行肿瘤刮除术,对Enneking分期为侵袭期者行肿瘤完整切除术。但一项截至目前最大样本量的多中心研究显示,用Enneking分期指导治疗并不可靠,这项研究回顾性分析了两组骨母细胞瘤病例,其中一组依据Enneking分期制定手术方案,另一组不按照Enneking分期制定手术方案,结果显示两组术后复发率差异无统计学意义[20]。局部放疗可以使肿瘤停止生长,缩小肿瘤体积,可以作为手术无法切除、不能耐受手术和复发病例的辅助性治疗[19, 22]。
骨肿瘤的介入放射学治疗近年发展迅速,为骨母细胞瘤的治疗提供了新的选择[23]。Arrigoni等[24]采用CT引导下射频消融术治疗11例骨母细胞瘤,所有病例在术后1周内疼痛症状消失,平均随访43.6个月未见复发。为避免RFA对周围组织产生热损伤,2015年Kumasaka等[25]首次报道CT引导下冷冻消融术治疗1例骨母细胞瘤患儿,该患儿疼痛症状在术后1周缓解,术后7个月完全消失,随访14个月未见复发。Cazzato等[26]总结10例CT引导下冷冻消融术治疗的骨母细胞瘤患儿临床资料,所有患儿在术后1个月疼痛完全缓解,在平均12个月的随访中有2例(2/10,20%)疼痛复发。2019年Arrigoni等[27]报道在磁共振引导定位下,用高强度聚焦超声波治疗6例关节内骨母细胞瘤患儿,术后所有患儿疼痛评分和关节功能均得到显著改善,未出现治疗相关并发症,且所有病例影像学随访未见软骨下损伤。这些新的治疗方法都具有创伤小、手术时间短、术后恢复快等优点,但也存在设备要求高、操作难度大等缺陷,因而限制了其临床应用。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为刘建方、邵小波和徐静芳,论文调查设计为吴伟良、陈建松和刘建方,数据收集与分析为邵小波和徐静芳,论文结果撰写为吴伟良,论文讨论分析为吴伟良和陈建松
| [1] |
Wu MH, Xu KK, Xie YL, et al. Diagnostic and management options of osteoblastoma in the spine[J]. Med Sci Monit, 2019, 25: 1362-1372. DOI:10.12659/msm.913666 |
| [2] |
Lucas DR, Unni KK, McLeod RA, et al. Osteoblastoma: clinicopathologic study of 306 cases[J]. Hum Pathol, 1994, 25(2): 117-134. DOI:10.1016/0046-8177(94)90267-4 |
| [3] |
Galgano MA, Goulart CR, Iwenofu H, et al. Osteoblastomas of the spine: a comprehensive review[J]. Neurosurg Focus, 2016, 41(2): E4. DOI:10.3171/2016.5.FOCUS16122 |
| [4] |
Reda B. Cystic bone tumors of the foot and ankle[J]. J Surg Oncol, 2018, 117(8): 1786-1798. DOI:10.1002/jso.25088 |
| [5] |
Jaffe HL, Mayer L. An osteoblastic osteoid tissue-forming tumor of a metacarpal bone[J]. Arch Surg, 1932, 24(4): 550-564. DOI:10.1001/archsurg.1932.01160160022002 |
| [6] |
Jaffe HL. Benign osteoblastoma[J]. Bull Hosp Joint Dis, 1956, 17(2): 141-151. |
| [7] |
Lichtenstein L. Benign osteoblastoma; a category of osteoid-and bone-forming tumors other than classical osteoid osteoma, which may be mistaken for giant-cell tumor or osteogenic sarcoma[J]. Cancer, 1956, 9(5): 1044-1152. DOI:10.1002/1097-0142(195609/10)9:53.0.CO;2-O |
| [8] |
Temple HT, Mizel MS, Murphey MD, et al. Osteoblastoma of the foot and ankle[J]. Foot Ankle Int, 1998, 19(10): 698-704. DOI:10.1177/107110079801901009 |
| [9] |
Elsayed H, Puttaraju A, Cribb G, et al. Osteobastoma of the Talus: A case report and review of the literature[J]. Foot (Edinb), 2017, 30: 59-62. DOI:10.1016/j.foot.2017.01.004 |
| [10] |
靳松, 沈靖南, 王晋, 等. 骨母细胞瘤的临床与病理分析[J]. 中国骨肿瘤骨病, 2006, 5(3): 147-150. Jin S, Shen JN, Wang J, et al. Clinical and pathological character analysis of osteoblastoma[J]. Chin J Bone Tumor & Bone Disease, 2006, 5(3): 147-150. DOI:10.3969/j.issn.2095-252X.2006.03.006 |
| [11] |
Fittall MW, Mifsud W, Pillay N, et al. Recurrent rearrangements of FOS and FOSB define osteoblastoma[J]. Nat Commun, 2018, 9(1): 2150. DOI:10.1038/s41467-018-04530-z |
| [12] |
Atesok KI, Alman BA, Schemitsch EH, et al. Osteoid osteoma and osteoblastoma[J]. J Am Acad Orthop Surg, 2011, 19(11): 678-689. DOI:10.5435/00124635-201111000-00004 |
| [13] |
Franceschini N, Lam SW, Cleton-Jansen AM, et al. What's new in bone forming tumours of the skeleton?[J]. Virchows Arch, 2020, 476(1): 147-157. DOI:10.1007/s00428-019-02683-w |
| [14] |
Anninga JK, Picci P, Fiocco M, et al. Osteosarcoma of the hands and feet: a distinct clinico-pathological subgroup[J]. Virchows Arch, 2013, 462(1): 109-120. DOI:10.1007/s00428-012-1339-3 |
| [15] |
Wu WL, Zhao GQ, Chen JS, et al. Osteoblastoma-like osteosarcoma of the cuboid and skull: a case report and review of the literature[J]. J Foot Ankle Surg, 2020, 59(1): 156-161. DOI:10.1053/j.jfas.2019.05.007 |
| [16] |
Lam SW, Cleven AHG, Kroon HM, et al. Utility of FOS as diagnostic marker for osteoid osteoma and osteoblastoma[J]. Virchows Arch, 2020, 476(3): 455-463. DOI:10.1007/s00428-019-02684-9 |
| [17] |
Amary F, Markert E, Berisha F, et al. FOS expression in osteoid osteoma and osteoblastoma: a valuable ancillary diagnostic tool[J]. Am J Surg Pathol, 2019, 43(12): 1661-1667. DOI:10.1097/PAS.0000000000001355 |
| [18] |
Berry M, Mankin H, Gebhardt M, et al. Osteoblastoma: a 30-year study of 99 cases[J]. J Surg Oncol, 2008, 98(3): 179-183. DOI:10.1002/jso.21105 |
| [19] |
Harrop JS, Schmidt MH, Boriani S, et al. Aggressive "benign" primary spine neoplasms: osteoblastoma, aneurysmal bone cyst, and giant cell tumor[J]. Spine, 2009, 34(22 Suppl): S39-S47. DOI:10.1097/BRS.0b013e3181ba0024 |
| [20] |
Versteeg AL, Dea N, Boriani S, et al. Surgical management of spinal osteoblastomas[J]. J Neurosurg Spine, 2017, 27(3): 321-327. DOI:10.3171/2017.1.Spine16788 |
| [21] |
Enneking WF. A system of staging musculoskeletal neoplasms[J]. Clin Orthop Relat Res, 1986(204): 9-24. |
| [22] |
Jia Q, Liu C, Yang J, et al. Factors affecting prognosis of patients with osteoblastoma of the mobile spine: a long-term follow-up study of 70 patients in a single center[J]. Neurosurgery, 2020, 86(1): 71-79. DOI:10.1093/neuros/nyy570 |
| [23] |
Barile A, Arrigoni F, Bruno F, et al. Present role and future perspectives of interventional radiology in the treatment of painful bone lesions[J]. Future Oncol, 2018, 14(28): 2945-2955. DOI:10.2217/fon-2017-0657 |
| [24] |
Arrigoni F, Barlle A, Zugaro L, et al. CT-guided radiofrequency ablation of spinal osteoblastoma: treatment and long-term follow-up[J]. Int J Hyperthermia, 2018, 34(3): 321-327. DOI:10.1080/02656736.2017.1334168 |
| [25] |
Kumasaka S, Miyazaki M, Tsushima Y. CT-guided percutaneous cryoablation of an aggressive osteoblastoma: a case report[J]. J Vasc Interv Radiol, 2015, 26(11): 1746-1748. DOI:10.1016/j.jvir.2015.08.002 |
| [26] |
Cazzato RL, Auloge P, Dalili D, et al. Percutaneous Image-Guided Cryoablation of Osteoblastoma[J]. AJR Am J Roentgenol, 2019, 213(5): 1157-1162. DOI:10.2214/ajr.19.21390 |
| [27] |
Arrigoni F, Bruno F, Palumbo P, et al. Magnetic resonance-guided focused ultrasound surgery treatment of non-spinal intra-articular osteoblastoma: feasibility, safety, and outcomes in a single-center retrospective analysis[J]. Int J Hyperthermia, 2019, 36(1): 768-775. DOI:10.1080/02656736.2019.1639833 |
 2022, Vol. 21
2022, Vol. 21


