神经源性肿瘤是一类源自神经嵴的胚胎性肿瘤,可按照原始神经外胚层来源进一步分类。神经细胞来源的肿瘤按照分化程度从高到底依次为神经节细胞瘤、神经节母细胞瘤、神经母细胞瘤。儿童神经源性肿瘤行为多样,部分可自发消退,部分可分化成为良性神经节细胞瘤,但更多的是增殖进展成为恶性肿瘤。儿童原发性纵隔肿瘤较少见,约40%的小儿纵隔肿瘤起源于后纵隔,其中以神经源性肿瘤较多见[1-3]。儿童胸腔容积小,手术难度大,麻醉风险高,而纵隔肿瘤的典型症状较少,术前诊断困难,往往难以被早期发现。本研究旨在初步分析儿童纵隔神经源性肿瘤行手术治疗患者的临床特征、治疗方法及预后。
材料与方法 一、研究对象以中国医科大学附属盛京医院小儿外科2012年1月至2021年12月收治的30例纵隔神经源性肿瘤患儿为研究对象。病例纳入标准:经CT、MRI确诊纵隔占位性病变,术后病理检查结果为神经源性肿瘤;排除仅行活检以及未手术的病例。统计所有患儿临床症状、影像学表现、治疗方法、病理类型及预后资料。本研究经中国医科大学附属盛京医院伦理委员会审核同意。
30例患儿中男20例,女10例。年龄1~13岁,平均年龄4.7岁。8例无特异性症状(8/30, 26.7%),其中7例为检查过程中意外发现,1例为肾上腺节细胞神经母细胞瘤术后随诊发现;18例因呼吸道症状就诊(18/30, 60.0%),表现为咳嗽、咳痰、喘息等;2例胸背痛(2/30, 6.7%);2例锁骨上淋巴结肿大(2/30, 6.7%);12例伴发热(12/30, 40.0%)。
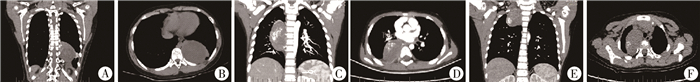
二、影像学表现30例CT或MRI检查诊断为纵隔肿物。其中26例CT提示为软组织密度包块,9例可见瘤内散在钙化影;22例行增强CT检查,13例可见明显强化,4例可见肿物与椎间孔关系密切,1例与椎管内相连,2例存在锁骨上淋巴结转移。4例外院CT提示胸腔占位性病变,本院MRI提示长T1长T2信号影,4例均未见椎间孔侵犯。肿瘤位于左纵隔17例(左上纵隔7例,左下纵隔10例),右纵隔13例(右上纵隔5例,右下纵隔8例),左前纵隔1例。肿瘤最大径最大8 cm,最小2.5 cm(图 1)。
|
图 1 儿童纵隔神经源性肿瘤典型影像学表现 A、B:左肺下叶纵隔旁软组织密度影,大小约6.1 cm×6.2 cm×7.9 cm,增强扫描呈不均匀明显强化,其内见血管影,与降主动脉相连,术后病理为节细胞神经瘤;C、D:右后纵隔包块,大小约6.8 cm×5.0 cm×3.2 cm,伴钙化,增强扫描呈不均匀中度强化,第6、7肋肋间距增大,相应椎间孔内见软组织影,术后病理为节细胞神经母细胞瘤;E、F:右上纵隔软组织高密度团块,大小约5.1 cm×3.7 cm×3.7 cm,边界欠清,可见钙化影,增强扫描呈明显强化,纵隔及颈部可见多发增大淋巴结,术后病理为神经母细胞瘤,分化型,颈部淋巴结转移瘤 Fig.1 Typical imaging findings of mediastinal neurogenic tumors in children |
患儿均取侧卧位,在全麻气管插管下手术,部分予以单肺通气。胸腔镜手术者于第7至第9肋间置入5 mm Trocar作为观察孔,根据肿瘤位置于腋前线及腋后线置入5 mm Trocar作为操作孔,探查肿瘤大小(>6 cm)及位置(累及T9~T12肋膈角);胸腔镜下切除困难者,于Trocar切口向两侧沿肋间延长开口至5~10 cm中转开胸手术。开胸手术者采取第4至第9肋间5~10 cm切口。术中小心分离肿瘤与周围组织,保护邻近的重要神经、血管以及肺组织,如术中证实存在椎间孔侵犯时,仔细分离肿瘤至椎间孔层面,谨慎使用电刀,避免神经组织电灼伤;如术中证实存在胸壁浸润生长则仅行肿瘤部分切除。术后常规放置胸腔闭式引流管以便观察创面引流及出血情况。术前均未行新辅助化疗。
四、统计学处理采用SPSS 24.0进行数据处理,计量资料以中位数(最小值,最大值)表示,计数资料以频数、率表示。
结果30例中位手术时间99.5(40~212)min,肿瘤位于上纵隔者手术中位时间119 (35~200)min,中位出血量15(0~120)mL,留置胸腔闭式引流中位时间5(1~17)d,术后中位出院时间10(5~17)d。术后发生并发症4例,1例术后第3天出现乳糜胸,予无脂肪饮食后18 d拔除胸腔引流管;2例出现面部无汗,1例出现眼睑下垂。
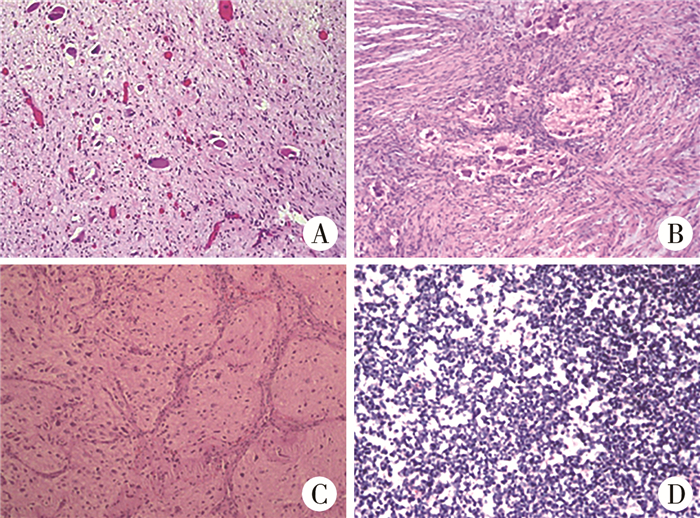
30例中良性16例(16/30,53.3%),恶性14例(14/30,46.7%)。术后病理类型:神经母细胞瘤4例(4/30,13.3%),神经节母细胞瘤8例(8/30,26.7%),节细胞神经瘤16例(16/30,53.3%),神经鞘瘤1例(1/30,3.3%),原始神经外胚层肿瘤(primitive neurotodermal tumour,PNET)2例(2/30,6.7%)。术前9例CT可见瘤内钙化灶,术后病理证实4例为神经母细胞瘤,2例为神经节母细胞瘤,3例为节细胞神经瘤。术前增强CT中13例明显强化,病理显示1例为神经母细胞瘤,4例为神经节母细胞瘤,6例为节细胞神经瘤,2例为PNET(图 2)。
|
图 2 儿童纵隔神经源性肿瘤典型病理学表现(HE染色,×20) A:节细胞神经瘤:神经纤维束状,旋涡状排列,其间散在呈蔟状神经节细胞;B:节细胞神经母细胞瘤,瘤细胞梭型,束状、片状排列,内见散在及蔟状神经节细胞,并见一些神经毡结构;C:神经母细胞瘤,分化型,瘤细胞核圆形,核仁明显呈疏松分布,漂浮于神经毡背景下,呈结节状,间质局灶钙化;D:原始神经外胚层肿瘤: 瘤细胞圆形,大小一致,弥漫片状排列,漫润性生长,部分区域星条索状排列 Fig.2 Typical pathological manifestations of pediatric mediastinal neurogenic tumor |
30例中共27例获得随访,失访3例,随访时间1个月至9年,中位随访时间5年,其中25例术后恢复良好,未见肿瘤复发及其他相关症状。4例神经母细胞瘤患儿中,3例术后辅助化疗(包括1例肾上腺节神经母细胞瘤术后患儿),1例预后良好型未化疗,随访无复发转移。8例神经节母细胞瘤患儿中,6例术后辅助化疗,2例预后良好型未化疗,其中1例节神经母细胞瘤肿瘤侵及胸膜顶及胸壁,行部分切除后出现颈部转移。其余均无复发转移。2例PNET术后辅助化疗,1例侵及胸壁术中部分切除,术后随访3年未见残余肿瘤增大,1例PNET术后化疗、放疗、靶向治疗后出现肝转移、骨转移,随访1年后失访。
讨论儿童后纵隔肿瘤约占全部纵隔肿瘤的1/3,约60%为恶性,其中神经母细胞瘤占大多数[4]。胸腔来源的神经母细胞瘤较其他部位预后要好[5]。本组除1例起源于前纵隔外,均为后纵隔来源肿瘤。纵隔神经源性肿瘤可以发生于任何神经组织,但大多位于后纵隔肋脊沟处,表现为一个宽基底的后纵隔脊柱旁包块。部分神经源性肿瘤可能与神经孔关系紧密,甚至向神经孔内生长,表现为“哑铃型”肿块,约10%的纵隔肿瘤存在神经孔侵犯[6]。本研究中4例术前经CT发现肿物与椎间孔关系密切,术中证实椎间孔侵犯,与文献报道相符。
后纵隔神经源性肿瘤早期通常无特征性症状,多数患儿于体检时意外发现无痛性肿块,少数因肿块压迫肺造成胸痛、咳嗽、呼吸困难等就诊,还有部分患儿肿瘤较大或压迫交感神经,可引起霍纳氏综合征(病灶同侧上睑下垂、瞳孔缩小和无汗症)或压迫上腔静脉致上腔静脉综合征(颈静脉怒张、面颈和上胸部水肿)[7]。总体来说,患儿就诊时症状并不能提示预后,但严重的气道阻塞症状对手术麻醉造成了较高风险[12]。
纵隔肿瘤的诊断主要依靠胸部CT及MR,CT有助于显示肿瘤位置、大小、与周围重要组织器官之间的关系以及是否存在淋巴结转移,增强CT可初步判断肿物性质以及是否有大血管的包绕,为判定肿物能否一期手术切除提供证据。CT显示良性肿瘤通常边缘较清晰,与周围组织分界明显,肿瘤生长较缓慢,钙化少见。部分恶性程度较高的神经母细胞瘤对周围组织侵袭及压迫较重,可表现为肋骨侵袭、椎间孔扩大,CT可见80% ~90%的神经母细胞瘤出现钙化[8]。本组4例神经母细胞瘤CT均可见散在钙化。神经节母细胞瘤的增强CT表现变化较大,可表现为与良性肿瘤相似的边缘清晰、均匀强化的软组织密度包块,也可表现为与恶性肿瘤相似的不均匀强化、内部钙化灶、局部浸润的包块[9]。如发现椎间孔扩大,则应行MR检查以明确椎间孔内浸润程度[10]。近年来胸部超声技术逐渐成熟,在超声下,神经母细胞瘤及节神经母细胞瘤存在一定异质性,表现为一高回声团块伴有包块内钙化及出血,节细胞神经瘤表现为一回声均匀的低回声团块。
小儿胸腔容积小,代偿能力差,胸腔内肿瘤(尤其是恶性肿瘤)因生长速度快,易侵袭周围组织,早期无典型症状,一经发现可能已经进展至较严重阶段。2岁以下患儿自我表达能力差,常因气道受压导致呼吸困难或反复发作的呼吸道感染而就诊。因此,当患儿出现与呼吸道感染程度不相符的气急、喘憋等症状时,应及时完善胸部CT检查,对于纵隔占位性病变做到早发现、早手术、早治疗[11]。术前穿刺活检的必要性尚有待商榷,因其结果的良恶性并不能决定手术方式及外科治疗决策,穿刺活检也不能提供神经源性肿瘤分型的确定诊断,不必要的穿刺活检可能造成肿瘤播散,术中冰冻切片及切除肿瘤活检对于治疗方式的选择有决定性作用[12]。
后纵隔肿瘤的手术入路可选择开胸手术或胸腔镜手术,文献报道肿瘤直径小于5 cm或肿瘤与胸腔直径比小于1/3、良性肿瘤、无明显周围血管包绕者更适合胸腔镜手术,而肿瘤与胸腔直径比大于1/2的巨大肿瘤在胸腔镜下操作存在一定困难,不宜选择胸腔镜手术。另外,在肿物与胸腔大血管关系密切、患儿存在严重心肺功能障碍不能耐受气胸、凝血异常以及不能进行完整切除的恶性肿瘤的情况下不宜选择胸腔镜手术[13-15]。胸腔镜手术具有住院时间短、胸壁损伤小、疼痛时间短、后纵隔术区视野暴露好、对于小的神经及血管处理更确切等优势,逐渐成为更多医生的首选。然而对于巨大肿瘤(直径>6 cm)、胸腔顶部肿瘤以及存在神经管侵犯的肿瘤仍部分需要开胸手术[16]。本院早期开展胸腔镜下纵膈肿物切除共6例,由于肿物巨大实施手术困难而中转开胸,后期随着胸腔镜技术的不断完善,仍有部分巨大肿物可经胸腔镜下切除,因此对于手术方式的选择也应根据术者经验,在保证手术安全的前提下有所调整。有报道指出,对于直径6 cm以上的实性肿瘤,手术时间、术中失血量以及中转开放手术的概率均有增加[16]。近年来,随着手术技术及器械的发展,机器人辅助下胸腔镜手术成为新的选择,对于普通胸腔镜难以操作的位置,机器人手术可以更好地暴露术野,增加手术安全性,减少创伤,但机器人辅助下纵隔肿物切除术发展较晚,小儿外科领域尚未见大宗病例报道[17]。
由于临床表现以及预后的多样性,儿童纵隔肿瘤的治疗需根据肿瘤的分期、病理分型以及肿瘤标志物来决定。良性肿瘤通常选择一期手术切除,恶性肿瘤Ⅰ期、Ⅱ期建议一期手术,Ⅲ期在行新辅助化疗后进行手术,Ⅳ期是否手术仍存在争议。
纵隔神经源性肿瘤相较于腹腔肿瘤预后更佳,有报道提出,存在椎间孔浸润的患儿中,手术切除只分离至椎间孔水平,结合适当的术后放、化疗,仍能将术后患儿的5年生存率维持在100%。试图完整切除反而可能造成失血、脑脊液瘘甚至截瘫等术后并发症,而保留部分椎旁肿瘤对于患儿的生存率并无影响[18]。本研究中4例椎间孔侵犯患儿术前均未发现神经系统症状,术中未对椎间孔及椎管内肿瘤进行过多分离,除1例节细胞神经母细胞瘤患儿术后予辅助化疗外,其他3例节细胞神经瘤患儿均未进行特殊处理,随访至今无脊髓及神经压迫症状出现,亦无肿瘤复发及增大。胸腔神经母细胞瘤相较其他部位预后较好,可能与其易被早期发现、生长局限、MYCN基因扩增率低以及肿瘤生物学行为良好有关[19]。
综上所述,儿童纵膈神经源性肿瘤较为少见,症状无明显特异性,起病隐匿,难以被早期诊断。对于纵膈肿物,一经发现应尽早完善影像学检查,制定手术方案。手术完整切除是纵膈神经源性肿瘤最有效的治疗手段,术后应通过病理检查明确分型,必要时完善基因检测,予以适当治疗,总体预后尚佳。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为曹正浓、王雅楠,病例资料提供为曹正浓、刘丹,论文讨论分析为曹正浓、刘丹、王雅楠、贾慧敏,论文撰写为曹正浓
| [1] |
Chen CH, Wu KH, Chao YH, et al. Clinical manifestation of pediatric mediastinal tumors, a single center experience[J]. Medicine (Baltimore), 2019, 98(32): e16732. DOI:10.1097/MD.0000000000016732 |
| [2] |
Franco A, Mody NS, Meza MP. Imaging evaluation of pediatric mediastinal masses[J]. Radiol Clin North Am, 2005, 43(2): 325-353. DOI:10.1016/j.rcl.2005.01.002 |
| [3] |
Rodriguez EF, Jones R, Miller D, et al. Neurogenic Tumors of the Mediastinum[J]. Semin Diagn Pathol, 2020, 37(4): 179-186. DOI:10.1053/j.semdp.2020.04.004 |
| [4] |
Fraga JC, Aydogdu B, Aufieri R, et al. Surgical treatment for pediatric mediastinal neurogenic tumors[J]. Ann Thorac Surg, 2010, 90(2): 413-418. DOI:10.1016/j.athoracsur.2010.04.086 |
| [5] |
Suita S, Tajiri T, Sera Y, et al. The characteristics of mediastinal neuroblastoma[J]. Eur J Pediatr Surg, 2000, 10(6): 353-359. DOI:10.1055/s-2008-1072390 |
| [6] |
Lacquet M, Moons J, Ceulemans LJ, et al. Surgery for mediastinal neurogenic tumours: a 25-year single-centre retrospective study[J]. Interact Cardiovasc Thorac Surg, 2021, 32(5): 737-743. DOI:10.1093/icvts/ivab002 |
| [7] |
Chen X, Ma Q, Wang S, et al. Surgical treatment of posterior mediastinal neurogenic tumors[J]. J Surg Oncol, 2019, 119(6): 807-813. DOI:10.1002/jso.25381 |
| [8] |
Lonergan GJ, Schwab CM, Suarez ES, et al. Neuroblastoma, ganglioneuroblastoma, and ganglioneuroma: radiologic-pathologic correlation[J]. Radiographics, 2002, 22(4): 911-934. DOI:10.1148/radiographics.22.4.g02jl15911 |
| [9] |
Pavlus JD, Carter BW, Tolley MD, et al. Imaging of thoracic neurogenic tumors[J]. AJR Am J Roentgenol, 2016, 207(3): 552-561. DOI:10.2214/AJR.16.16018 |
| [10] |
Swift CC, Eklund MJ, Kraveka JM, et al. Updates in Diagnosis, Management, and Treatment of Neuroblastoma[J]. Radiographics, 2018, 38(2): 566-580. DOI:10.1148/rg.2018170132 |
| [11] |
Liu HP, Yim AP, Wan J, et al. Thoracoscopic removal of intrathoracic neurogenic tumors: a combined Chinese experience[J]. Ann Surg, 2000, 232(2): 187-190. DOI:10.1097/00000658-200008000-00006 |
| [12] |
Lacquet M, Moons J, Ceulemans LJ, et al. Surgery for mediastinal neurogenic tumours: a 25-year single-centre retrospective study[J]. Interact Cardiovasc Thorac Surg, 2021, 32(5): 737-743. DOI:10.1093/icvts/ivab002 |
| [13] |
Kocaturk CI, Sezen CB, Aker C, et al. Surgical approach to posterior mediastinal lesions and long-term outcomes[J]. Asian Cardiovasc Thorac Ann, 2017, 25(4): 287-291. DOI:10.1177/0218492317705040 |
| [14] |
段贤伦, 商子寅, 章鹏, 等. 胸腔镜在小儿纵膈肿物治疗中的应用[J]. 临床小儿外科杂志, 2016, 15(2): 135-136. Duan XL, Shang ZY, Zhang P, et al. The application of video-assisted thoracic surgery in the treatment of mediastinal tumors in children[J]. J Clin Ped Sur, 2016, 15(2): 135-136. DOI:10.3969/j.issn.1671-6353.2016.02.010 |
| [15] |
Sato T, Kazama T, Fukuzawa T, et al. Mediastinal tumor resection via open or video-assisted surgery in 31 pediatric cases: Experiences at a single institution[J]. J Pediatr Surg, 2016, 51(4): 530-533. DOI:10.1016/j.jpedsurg.2015.09.021 |
| [16] |
Li Y, Wang J. Experience of video-assisted thoracoscopic resection for posterior mediastinal neurogenic tumours: a retrospective analysis of 58 patients[J]. ANZ J Surg, 2013, 83(9): 664-668. DOI:10.1111/j.1445-2197.2012.06174.x |
| [17] |
Li XK, Cong ZZ, Xu Y, et al. Clinical efficacy of robot-assisted thoracoscopic surgery for posterior mediastinal neurogenic tumors[J]. J Thorac Dis, 2020, 12(6): 3065-3072. DOI:10.21037/jtd-20-286 |
| [18] |
Horiuchi A, Muraji T, Tsugawa C, et al. Thoracic neuroblastoma: outcome of incomplete resection[J]. Pediatr Surg Int, 2004, 20(9): 714-718. DOI:10.1007/s00383-003-1049-7 |
| [19] |
李海艟, 陈诚豪, 曾骐. 儿童纵隔神经母细胞瘤的外科诊疗进展[J]. 中华小儿外科杂志, 2021, 42(11): 1046-1052. Li HT, Chen CH, Zeng Q, et al. Surgical advances of mediastinal neuroblastoma in children[J]. Chin J Pediatr Surg, 2021, 42(11): 1046-1052. DOI:10.3760/cma.j.cn.421158-20200428-00296 |
 2022, Vol. 21
2022, Vol. 21


