畸胎瘤(teratoma)是儿童最常见的生殖细胞肿瘤,由原始生殖细胞或多能胚胎干细胞衍生而来,多位于躯体中线或中线旁区,以骶尾部最多见,其次为性腺(卵巢、睾丸)、腹膜后、纵隔、颅内和椎管等[1]。按组织病理学分类可将畸胎瘤分为成熟畸胎瘤(mature teratoma)、未成熟畸胎瘤(immature teratoma)。纵隔畸胎瘤(mediastinal teratoma)临床相对少见,占原发性纵隔肿瘤的15.0% ~21.5%,多为良性肿瘤,但儿童纵隔畸胎瘤临床表现多样、解剖关系复杂,麻醉和手术的风险均较大[2]。首都医科大学附属北京儿童医院自2012年1月至2021年12月共收治纵隔畸胎瘤患儿156例,均经手术及病理检查确诊,现将其临床特征、外科诊治情况总结如下。
材料与方法 一、一般资料156例中,男74例,女82例;年龄17天至16岁7个月,平均年龄6岁3个月。临床表现:咳嗽发热79例,胸痛45例,胸闷气促40例,无症状10例,产前检查发现6例,下肢无力或瘫痪4例,咯血2例,胸壁畸形2例,咳出异物1例,心脏杂音1例,腹痛1例(表 1)。所有患儿术前均行甲胎蛋白(alpha-fetoprotein, AFP)、人绒毛膜促性腺激素(β-human chorionic gonadotropin, β-HCG)检测以及纵隔超声、胸部CT或MRI检查。肿瘤位于前纵隔129例(左侧61例,右侧67例,居中1例),后纵隔22例(合并椎管内畸胎瘤10例),中纵隔(心包)2例,肺2例,食管1例;详见表 2。6例产前检查发现患儿中,2例为孕24周发现胸腔占位;2例为孕32周发现占位;1例为孕38周发现胸腔异常回声;1例为孕40周发现胸腔异常占位。本研究经首都医科大学附属北京儿童医院伦理委员会审核同意。
| 表 1 156例纵隔畸胎瘤患儿临床表现 Table 1 Clinical manifestations and distributions of children with mediastinal teratoma |
|
|
| 表 2 156例纵隔畸胎瘤解剖位置分布情况 Table 2 Anatomic distributions in children with mediastinal teratoma |
|
|
156例患儿影像学检查结果提示,实性占位2例,囊性占位1例,囊实性占位153例。其中囊性畸胎瘤表现为囊状液性密度影,边界清晰,病理结果提示为单胚层畸胎瘤。实性、囊实性肿瘤影像学表现多为混杂密度团块影,解剖层次混乱。瘤体内可见脂肪密度影、钙化或骨骼影,部分病例伴有“脂液平”“多囊”或“囊中囊”特征[3-4]。未成熟畸胎瘤影像学表现复杂,边界欠规则,可无完整包膜,与周围组织界限不清,甚至呈浸润性生长[5]。本组合并钙化或骨骼密度109例,合并脂肪密度96例,多囊89例,单囊5例。详见图 1至图 3。
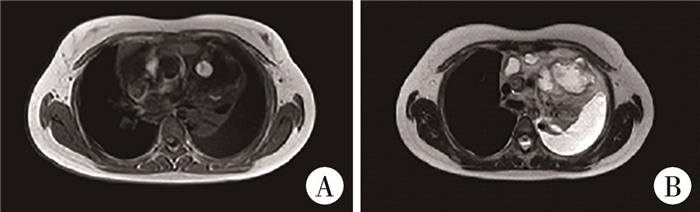
|
图 1 纵隔畸胎瘤影像学表现(病例1) A: 左前上纵隔内见不规则高低混杂信号影,病灶边界欠清楚,范围约7.3 cm×8.6 cm×8.0 cm; B: 占位内见结节状短T1长T2信号影,DWI为部分高信号,T1高信号压脂像上信号减低 Fig.1 Preoperative radiological images of mediastinal teratoma (Case 1) |
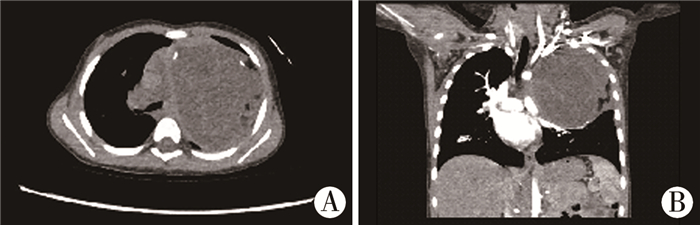
|
图 2 纵隔畸胎瘤影像学表现(病例2) A:胸部CT平扫显示:左前上纵隔巨大囊实性占位,边界尚清,范围约8.1 cm×7.6 cm×9.2 cm,实性区以脂肪组织为主,病灶边缘可见斑片状钙化,病灶与胸腺关系密切; B:胸部增强CT扫描显示:纵隔占位内分隔可见轻度强化,左上肺受压,气管及左主支气管受压右移,管径变细(50%),相邻纵隔大血管受压,纵隔内未见明显肿大淋巴结 Fig.2 Preoperative radiological images of mediastinal teratoma (Case 2) |
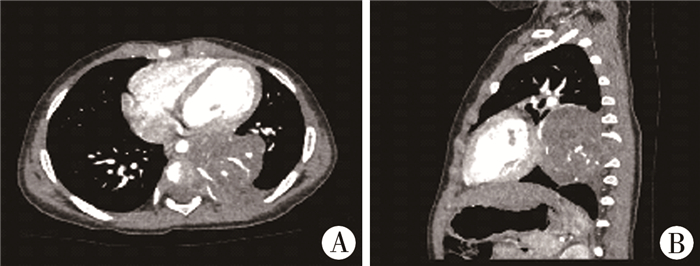
|
图 3 纵隔畸胎瘤影像学表现(病例3) A:胸部增强CT显示:左后纵隔脊柱旁囊实性肿物,边界欠清,范围约3.9 cm×4.0 cm×5.3 cm,CT值18~22 HU,其内可见多发斑点状及弧形条状钙化,增强后病变轻度不均匀强化;B:胸部增强CT矢状位显示:肿瘤致相邻胸主动脉、左下肺静脉受压变扁前移,部分病变经左侧第7~8椎间孔略向椎管内突出,左侧第7~8后肋受压变扁,周围肺野受压含气不良 Fig.3 Preoperative radiological images of mediastinal teratoma (Case 3) |
本组部分患儿由于影像学表现不典型,合并肿瘤破裂、出血、脓胸等,早期诊断有一定困难,16例前期被误诊误治(16/156,10.3%),其中误诊为呼吸道感染、肺炎8例;误诊为脓胸3例;误诊为结核感染1例;误诊为鸡胸1例;误诊为肺囊性病1例;误诊为支气管囊肿1例;误诊为神经肌肉病1例。
三、手术方法156例均在气管插管全身麻醉下行肿瘤切除术,其中机器人手术3例,胸腔镜手术65例,胸腔镜中转开胸手术16例(其中胸腔镜辅助小切口手术9例),开胸手术72例。154例患儿完整切除肿瘤,其中2例因合并脓胸,胸腔粘连严重,暴露困难,而行清创后二期手术切除;1例为椎管合并双侧后纵隔肿瘤,先行椎管内肿瘤切除术(病理结果为未成熟畸胎瘤),二期行双侧后纵隔肿瘤切除术(病理结果为成熟畸胎瘤)。同期行心包部分切除8例,其中6例为肿瘤浸润心包,2例为心包内肿瘤;行肺切除46例,其中肺叶切除7例,肺楔形切除36例,多肺叶受累切除3例。术中所见:肿瘤侵犯大血管16例(包括上腔静脉、无名静脉、肺动脉、主动脉、锁骨下动静脉);肿瘤破裂出血21例,脓胸7例,肿瘤浸润心包8例、肺组织46例。
四、统计学处理应用SPSS 21.0进行数据整理与分析。对于手术时间、出血量、住院时间等计量资料采用x±s表示,随访时间采用中位数表示。
结果156例患儿手术时间(106.8±13.1)min (40~285 min), 出血(36.7±8.2)mL (2~1 400 mL)。术后病理检查均证实为畸胎瘤,其中142例为成熟畸胎瘤,14例为未成熟畸胎瘤(Ⅰ级7例,Ⅱ级5例,Ⅲ级2例)。无一例手术死亡。住院时间(8.3±0.9)d (5~34 d)。均痊愈出院。
本组患儿瘤体平均直径8.7 cm,最小体积为4.4 cm×4.0 cm×3.5 cm,最大体积为29.0 cm×19.0 cm×18.0 cm;肿瘤致气管受压76例,肺不张71例,胸腔积液49例,心包积液9例。
出院后中位随访时间60个月(1~121个月)。7例未成熟畸胎瘤(Ⅱ级5例;Ⅲ级2例)患儿术后经4~6个疗程CPEB(环磷酰胺+顺铂+依托泊苷+博来霉素)或PEB(顺铂+依托泊苷+博来霉素)方案化疗,定期复查血甲胎蛋白(alpha-fetoprotein, AFP)、纵隔超声、CT或MRI,未见肿瘤复发。1例13岁女性左前纵隔囊实性成熟型畸胎瘤患儿于术后3周因胸痛再次就诊,复查CT及超声心动图见大量心包积液,行心包引流后痊愈出院,定期复查未见复发。1例13岁10个月因右前纵隔成熟型畸胎瘤于外院手术女童,于术后7个月因间断胸闷渐加重4年,伴胸痛、咳黄色块状物5个月于本院就诊,胸腔镜探查见前上纵隔3 cm×2 cm肿瘤,且与右中叶粘连,部分中叶呈囊性改变,切除肿瘤及受浸润肺中叶,术后定期复查未见复发。
术后并发乳糜胸2例,经静脉营养、无脂饮食等保守治疗后好转;膈膨升6例,均无临床症状,未予特殊处理,术后3~6个月复查胸部X线或CT,4例恢复正常,2例继续随访中。
讨论畸胎瘤是儿童最常见的生殖细胞肿瘤,好发于中线区域,如骶尾部、腹膜后、卵巢和睾丸等,少见部位有纵隔、颈部、胃肠道、颅内和椎管等。按组织病理学分类可将儿童畸胎瘤分为:①成熟畸胎瘤,即瘤体为分化良好成熟的组织构成,多有三胚层来源;②未成熟畸胎瘤,即含有不同比例的未成熟胚胎组织,如原始神经组织等,具有一定侵袭性。与成人不同的是,儿童未成熟型畸胎瘤完整切除则预后良好。有学者推荐WHOⅡ级、Ⅲ级未成熟畸胎瘤按照恶性生殖细胞肿瘤方案化疗,以降低复发和转移风险[6]。
一、临床表现及诊断依据纵隔畸胎瘤男女发病率无明显差异,多为良性肿瘤。有学者认为全能干细胞可以产生单克隆肿瘤如未成熟畸胎瘤,但成熟畸胎瘤可能是多克隆、更像是错构瘤而非肿瘤,因此畸胎瘤是不完全孪生的一种形式[7]。另有研究提示,纵隔畸胎瘤为胚胎期胸腺原基(第3对鳃弓)发育时,部分多能干细胞游离随纵隔下降演变而成,多数位于前纵隔,少数位于心包及后纵隔、椎管内,需要与支气管囊肿、神经母细胞瘤相鉴别[8]。
纵隔畸胎瘤早期瘤体较小,可无任何症状,随着体积增大可出现压迫症状、继发感染、破裂出血,或侵入周围组织而产生相应临床表现,如胸痛、喘憋、呼吸困难等,有文献报道巨大纵隔畸胎瘤导致上腔静脉综合征病例[9]。少数患儿咳出皮脂样物或毛发,具有一定临床诊断价值。新生儿及婴幼儿胸壁及心肺发育尚不完善,增大的肿瘤可导致气管、支气管受压,纵隔移位,继发肺不张、肺炎等,表现为发热、咳嗽、呼吸困难等,大龄儿童可自诉胸痛、肩背痛、腹痛等症状,但临床表现不典型,早期诊断极为困难,需注意鉴别[10-11]。本组患儿瘤体平均直径8.7 cm,肿瘤致气管受压76例,肺不张71例,胸腔积液49例,心包积液9例;因呼吸衰竭而行气管插管13例,均予急诊肿瘤切除术。值得注意的是,本组产前检查发现的6例均于早期接受手术治疗,预后良好。
多胚层来源畸胎瘤内可含胰腺、胃腺等消化道组织,继而分泌消化酶作用于瘤体及包膜,导致肿瘤坏死、出血,甚至破裂或与邻近组织器官形成粘连和侵蚀[12]。最常受累肺、心包、胸壁、膈肌、血管等,患儿可出现反复发作的肺炎、肺不张,表现为脓胸、胸腔积液、心包积液等,大大增加了手术难度及中转开胸的概率。本组术中探查见肿瘤破裂出血21例,分期行脓胸手术2例,同期行胸膜剥脱术5例,浸润心包并行部分心包切除术8例,侵犯大血管16例,浸润肺组织并切除46例。
纵隔超声、CT或MRI等影像学评估可清晰显示肿物大小、解剖位置、包膜是否完整及肿物成分等细节。胸部CT或MRI可显示肿物不同密度组成部分,如脂肪、囊变、钙化、骨骼、牙齿等畸胎瘤特征性影像学表现[13]。畸胎瘤影像学上多表现为囊实性混合型占位,其内同时包含脂肪、液体、脂液平、多囊变或单囊变、囊中囊、钙化。本组影像学表现为实性占位2例,囊性占位1例,囊实性占位153例(98.1%,153/156)。另外,部分位于后纵隔的畸胎瘤需与神经母细胞瘤相鉴别,畸胎瘤多为巨大不规则或珊瑚状钙化,而神经母细胞瘤多为散在点状或泥沙样钙化,
二、治疗手术切除是纵隔畸胎瘤安全有效的治疗方案。成熟畸胎瘤单纯行手术完整切除后预后良好,儿童未成熟畸胎瘤的生物学行为与成熟畸胎瘤相似,多数学者主张未成熟畸胎瘤经手术完整切除后,不需要其他辅助治疗[14]。有学者认为,未成熟畸胎瘤(WHOⅡ级、Ⅲ级)有恶性生物学行为,须按照恶性生殖细胞肿瘤处理,手术切除肿瘤后予辅助化疗[15]。手术完整切除肿瘤是改善预后、减少复发的关键,因此对于明确合并感染、胸腔积液、甚至脓胸的病例,建议内科抗炎保守治疗2周以上、待感染控制后再行手术;针对肿瘤浸润心包、肺、膈肌等组织,建议行部分心包切除、肺切除、膈肌切除重建,争取完整切除。另外,手术方式及切口的选择至关重要,术前应精确评估肿瘤大小、位置、毗邻组织及范围,选择不同的手术方式和切口。对于肿物巨大、占位效应明显或合并既往感染、粘连、出血等危险因素者,选择侧开胸手术可建立较好的手术视野;对于肿瘤局限、无明显感染、粘连等,可尝试胸腔镜、机器人手术;对于前纵隔肿瘤包裹心脏、血管或跨越中线者,前正中切口可较好暴露解剖结构,避免大血管损伤及出血。对于纵隔合并椎管内肿瘤,必要时可联合神经外科同期切除[16]。对于前上纵隔心脏大血管、膈神经、食管、气管、胸导管等重要结构交错者,术中需注意充分暴露、小心分离,避免损伤血管、膈神经、胸导管等微细结构。本组6例术后出现膈膨升,均为胸腔肿瘤巨大,侵及膈神经及心包,合并粘连等暴露困难,导致术中剥离牵拉膈神经致膈肌抬高,均无症状、未予特殊处理,术后定期复查部分恢复正常。本组2例术后胸腔引流提示大量乳糜胸,经保守治疗、静脉营养、无脂饮食等好转。因此针对位于左上纵隔及右后下纵膈的肿瘤,术中颈根部静脉角、脊柱旁等危险区域的分离需保护胸导管,如发现可疑淋巴漏征象可缝扎胸导管或Hemolock夹闭漏口。
三、随访术后需定期监测AFP、CT或纵隔超声。AFP是术后复查的重要肿瘤标志物,临床AFP升高多见于内胚窦瘤、混合性生殖细胞瘤肿瘤等,亦可见于部分不成熟畸胎瘤[17-18]。术后AFP明显下降,多提示预后良好,持续不降或下降后反弹,需警惕术后复发、肿瘤残留以及其他转移病灶[19]。本组未成熟畸胎瘤Ⅰ级7例、Ⅱ级5例、Ⅲ级2例,术前AFP明显升高(9.48~19 174 ng/mL),术后经4~6个疗程CPEB(环磷酰胺+顺铂+依托泊苷+博来霉素)或PEB(顺铂+依托泊苷+博来霉素)方案化疗,术后1周AFP明显下降,术后3个月完全恢复正常,定期复查血AFP、纵隔超声、CT或MRI,未见肿瘤复发。
综上所述,儿童纵隔畸胎瘤临床特征不典型,影像学特征复杂多样,早期诊断需结合临床表现及AFP、超声、CT、MRI等辅助检查。成熟畸胎瘤完整切除预后良好;不成熟畸胎瘤需结合术前AFP、手术切除情况、病理分级结果,必要时于辅助性放化疗。如考虑恶性则可能需要术前穿刺活检,以明确病变性质[20]。总之,手术是儿童纵隔畸胎瘤安全有效的治疗方案,早期诊断并根据肿瘤临床特征,选择合理的手术时机和治疗方式是获得良好预后的关键。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为徐长琪、张旭,论文调查设计为徐长琪、曾骐、陈诚豪,数据收集与分析为徐长琪、严冬、刘鼎义、张谦,论文结果撰写为徐长琪、于洁,论文讨论分析为徐长琪、曾骐、张娜、陈诚豪
| [1] |
Omachi N, Kawaguchi T, Shimizu S, et al. Life-threatening and rapidly growing teratoma in the anterior mediastinum[J]. Intern Med, 2015, 54(19): 2487-2489. DOI:10.2169/internalmedicine.54.4622 |
| [2] |
Agha RA, Franchi T, Sohrabi C, et al. The SCARE2020 guideline: updating consensus Surgical Case Report (SCARE) guidelines[J]. Int J Surg, 2020, 84: 226-230. DOI:10.1016/j.ijsu.2020.10.034 |
| [3] |
Bawazir AA, Alrossais NM, BinSaleh Y, et al. A case report of intrapulmonary teratoma in the right upper lung zone in a 35-year-old female patient[J]. Cureus, 2019, 11(1): e3834. DOI:10.7759/cureus.3834 |
| [4] |
Yalagachin GH. Anterior mediastinal teratoma-a case report with review of literature[J]. Indian J Surg, 2013, 75(Suppl 1): 182-184. DOI:10.1007/s12262-012-0569-6 |
| [5] |
Hakiri S, Kawaguchi K, Fukui T, et al. Verification of the diagnostic strategy for anterior mediastinal tumors[J]. Int J Clin Oncol, 2019, 24(4): 385-393. DOI:10.1007/s10147-018-1362-8 |
| [6] |
Scheckel CJ, Kosiorek HE, Butterfield R, et al. Germ cell tumors with malignant somatic transformation: a mayo clinic experience[J]. Oncol Res Treat, 2019, 42(3): 95-100. DOI:10.1159/000495802 |
| [7] |
Lin C, Du Y, Li Y, et al. Superior mediastinal mature cystic teratoma with gastrointestinal adenocarcinoma transformation: Report of a case[J]. Oncotarget, 2016, 7(25): 38392-38397. DOI:10.18632/oncotarget.9532 |
| [8] |
Tu L, Sun L, Zhou Y, et al. Postoperative radiotherapy for residual tumor of primary mediastinal carcinoid teratoma[J]. J Thorac Dis, 2013, 5: E61-E64. DOI:10.3978/j.issn.2072-1439.2012.11.11 |
| [9] |
Tanriverdi O, Ersen A, Cokmert S, et al. The case of an elderly male patient with unknown primary mucinous adenocarcinoma within presacral teratoma (teratoma with malignant transformation)[J]. Case Rep Oncol Med, 2015, 170479. DOI:10.1155/2015/170479 |
| [10] |
Nichols CR. Mediastinal germ cell tumors.Clinical features and biologic correlates[J]. Chest, 1991, 99(2): 472-479. DOI:10.1378/chest.99.2.472 |
| [11] |
杨文萍, 邹音, 黄传生, 等. 儿童未成熟畸胎瘤的临床病理与生物学行为分析[J]. 中华病理学杂志, 2007, 36(10): 666-671. Yang WP, Zou Y, Huang CS, et al. Clinicopathologic and prognostic study of pediatric immature teratoma[J]. Chin J Pathol, 2007, 36(10): 666-671. DOI:10.3760/j.issn:0529-5807.2007.10.004 |
| [12] |
Wick MR, Perlman EJ, Orazi A, et al. Germ cell tumours of the mediastinum.In: tumours of the lung, pleura, thymus and heart[J]. J Thorac Oncol, 2015, 10(1): 01383-1395. DOI:10.1097/JTO.0000000000000654 |
| [13] |
Nicole P, Wilko W, Jürgen H. Life-Threatening mediastinal teratoma of infant requiring emergency surgical removal[J]. Thorac Cardiovasc Surg Rep, 2022, 11(1): e7-e10. DOI:10.1055/s-0041-1726350 |
| [14] |
Nakazono T, Yamaguchi K, Egashira R, et al. Anterior mediastinal lesions: CT and MRI features and differential diagnosis[J]. Jpn J Radiol, 2021, 39(2): 101-117. DOI:10.1007/s11604-020-01031-2 |
| [15] |
姚祥, 王珊, 何小庆, 等. 399例儿童畸胎瘤的单中心临床诊疗分析[J]. 临床小儿外科杂志, 2016, 15(3): 241-245. Yao X, Wang S, He XQ, et al. Clinical diagnosis and therapy of pediatric teratomas: a report of 399 cases at a single center[J]. J Clin Ped Sur, 2016, 15(3): 241-245. DOI:10.3969/j.isn.1671-6353.2016.03.011 |
| [16] |
Gurda GT, VandenBussche CJ, Yonescu R, et al. Sacrococcygeal teratomas: clinic-pathological characteristics and isochromosome 12p status[J]. Mod Pathol, 2014, 27(4): 562-568. DOI:10.1038/modpathol.2013.171 |
| [17] |
Ulbright TM. Gonadal teratomas: a review and speculation[J]. Adv Anat Pathol, 2004, 11(1): 10-23. DOI:10.1097/00125480-200401000-00002 |
| [18] |
Oosterhuis JW, Looijenga LHJ. Human germ cell tumours from a developmental perspective[J]. Nat Rev Cancer, 2019, 19(9): 522-537. DOI:10.1038/s41568-019-0178-9 |
| [19] |
Bonasoni MP, Comitini G, Barbieri V, et al. Fetal Presentation of Mediastinal Immature Teratoma: Ultrasound, Autopsy and Cytogenetic Findings[J]. Diagnostics(Basel), 2021, 11(9): 1543. DOI:10.3390/diagnostics11091543 |
| [20] |
Darouich S, Bellamine H. Fetal mediastinal teratoma: Misinterpretation as congenital cystic lesions of the lung on prenatal ultrasound[J]. J Clin Ultrasound, 2020, 48(5): 287-290. DOI:10.1002/jcu.22808 |
 2022, Vol. 21
2022, Vol. 21


