儿童胸部实体肿瘤包括胸壁(骨骼和软组织)、肺、气道、纵隔脏器、食管、膈肌等部位的实体肿瘤,主要为胚胎组织残余所形成的异常组织或转移性肿瘤;先天性肿瘤约占50%,出生时即存在,临床以胚胎性肿瘤、神经源性肿瘤及肉瘤相对常见。绝大部分儿童胸部实体肿瘤为良性,临床表现多无特异性,患儿常因肿瘤体积增大到一定程度,压迫周围组织器官引起相关症状后前来就诊,或由于肿瘤向胸壁外生长而被发现。临床症状包括:咳嗽、发热、胸闷、胸痛、背痛、胸壁畸形、胸壁包块等,重者可合并有呼吸困难、上腔静脉压迫综合征、咯血、吞咽困难、声嘶、Horner综合征等。
儿童胸部恶性实体肿瘤的发病率较低,约1/10 000,但近年来有增加趋势,已成为仅次于交通事故、创伤性疾病的第三位儿童死亡原因[1-3]。儿童胸部恶性肿瘤多生长迅速,由于肿瘤呈膨胀性生长,往往占据纵隔或一侧胸腔,常压迫或侵犯心包、肺脏、大血管、食管等部位,产生一系列严重症状。还有部分纵隔神经母细胞性肿瘤患儿以Horner综合征或者副肿瘤综合征为首发症状就诊。部分恶性肿瘤具有特殊标志物,可作为诊断和鉴别诊断的主要依据以及预后评估的重要指标,如甲胎蛋白(alpha fetoprotein,AFP)升高有助于恶性生殖细胞瘤的诊断,儿茶酚胺代谢产物香草扁桃酸(vanillymandelic acid,VMA)或高香草酸(homovanillic acid, HVA)可作为神经母细胞瘤的特异性生物标志物[4-7]。
本共识采用国际通用的Delphi程序,检索了Medline、The Cochrane Library、万方等数据库,回顾了国内外自1940年1月至2020年10月儿童胸部实体肿瘤诊疗的相关文献,经相关专家多次会议研讨成文。
一、临床表现及辅助检查 (一) 临床表现根据原发肿瘤或转移瘤灶的部位及范围,儿童胸部实体肿瘤的临床表现有所不同。良性或恶性肿瘤早期多无明显症状,多表现为偶然发现的无痛性肿块。肿瘤压迫症状可成为临床首发症状,极少数肿瘤因副肿瘤综合征而就诊,如神经母细胞瘤引起的共济失调、顽固性腹泻等。恶性肿瘤晚期患儿就诊时一般状况差,通常有发热、乏力、消瘦、纳差、贫血、骨痛、头痛、胸痛、恶心、呕吐、腹泻等症状。
肿瘤浸润及压迫引起的症状包括:①肿瘤侵入骨骼或神经可引起剧烈疼痛;②肿瘤产生的胸腔积液或肿瘤本身压迫肺组织或气道,可诱发咳嗽、喘鸣、呼吸困难等;③肿瘤破溃入气道可产生咯血、咳出瘤体异物;④压迫上腔静脉可引起颈静脉怒张、面颈和上胸部水肿;⑤压迫交感神经可产生Horner综合征(病灶同侧上睑下垂、瞳孔缩小和无汗症)、一侧上肢疼痛、活动及感觉异常等;⑥喉返神经受压或被侵入时则发生声嘶;⑦压迫脊髓时引起运动或感觉障碍、大便失禁和(或)尿潴留;⑧压迫或浸润食管可引起吞咽困难、呕血等[8-10]。
(二) 影像学检查X线可查看肿瘤的部位、形状和大小;评估肋骨、胸廓、脊柱有无骨质破坏,椎间孔有无增大等。畸胎瘤可出现钙化斑点、牙齿或骨性阴影。多普勒超声可检测皮下或深部组织肿块的大小、质地、性质、血流情况,及其与周围组织的关系;还可在超声引导下行穿刺活检,从而获得病理诊断结果。上消化道造影可明确食管有无受压和侵犯。CT是儿童胸部实体肿瘤的重要诊断手段,通过密度及不同强化方式的特点,初步判断肿块的组成成分(如是否存在囊性、脂肪、血管、骨性等成分以及是否存在钙化)和肿瘤类型,进一步明确病变部位、范围、是否存在转移病灶、解剖层次,判断肿瘤与主要血管层次的空间位置关系[11-12]。血管三维重建可以更直观地显示肿瘤的血供以及肿瘤和邻近大血管的空间关系,有助于手术方案的设计[13]。
部分肿瘤有特殊的CT影像学改变,如:①神经源性肿瘤:多位于后纵隔,常紧贴脊柱,可通过椎间孔进入椎管,可伴沙粒状钙化,部分侵犯椎体、肋骨,或出现远处转移;CT有助于了解肿瘤部位、大小以及是否越过中线,有无浸润性生长、淋巴结肿大、血管受累、椎管内侵犯等情况。②畸胎瘤:常发生于前纵隔,多为孤立性包块,CT密度不均,常伴块状钙化、气液平及囊实性改变。③淋巴瘤:前纵隔不规则肿块密度均匀,当出现坏死时可表现为中心型液化,周围大血管受压,常伴有心包积液或胸腔积液。
MRI对静态软组织的分辨率更高,可以同步不同序列的信号强度判断肿块的大小、范围以及可能成分等。MRI没有放射性,是胸部实体肿瘤侵犯椎管生长时术前评估和术后随访的重要无创检查方法。但磁共振检查耗时长,检查时需保持身体静止,部分患儿需在镇静状态下完成。纤维支气管镜可筛查气道肿瘤。间碘苄胍(metaiodoenzylguanidine, MIBG)检查是神经源性肿瘤的重要检查方法,可帮助判断肿块是否为神经源性,检测结果特异性高。PET-CT有助于对肿瘤进行初始分期的评估,可了解是否存在多发性转移病变、骨骼转移等。PET-MRI可以分别收集PET和MR影像,融合了PET对病灶的敏感检测优势和MRI的多序列成像优势,其灵敏度高、准确性好。骨扫描常用于评估骨骼转移的情况。超声常用于胸壁、纵隔等部位转移病灶及淋巴结的评估,对于上纵隔以及后纵隔的病灶,超声可以对其组成成分以及血管包绕情况进行初步判断。
(三) 实验室检查1. 肿瘤标志物检查:AFP、人绒毛膜促性腺激素(human chorionic gonadotrophin, HCG)升高有助于恶性生殖细胞肿瘤、肝母细胞瘤肺转移的诊断;VMA或HVA是神经母细胞瘤的生物学标志物。神经元特异性烯醇化酶(neuron-specific enolase, NSE)有助于神经源性肿瘤的诊断,敏感度高,但特异度低。
2. 血常规检查:血常规可表现为贫血,少数患儿表现为血小板减少,晚期、广泛转移的患儿C反应蛋白往往升高。
3. 血生化检查:肝肾功能、乳酸脱氢酶(lactate dehydrogenase, LDH)、电解质为必查项目,部分患儿可出现血尿酸及LDH水平增高。
4. 凝血功能:包括凝血酶原时间(prothrombin time, PT)、活化部分凝血酶原时间(activated partial prothrombin time, APTT)、纤维蛋白原(fibrinogen, FIB)、D-二聚体等。
5. 结核检查:少数胸部占位是结核感染引起的包块,结核菌素试验(purified protein derivative, PPD)、γ-干扰素测定等检查有助于结核的排除。
6. 血清酸性铁蛋白:近年来证实恶性细胞(胸部如肺癌、霍奇金淋巴瘤等)可合成酸性异铁蛋白,又称癌胚异铁蛋白,是一种肿瘤标志物。血清酸性铁蛋白在淋巴瘤患儿的血清中可显著升高,并随疾病缓解而降低,可用于疾病的诊断与鉴别诊断、动态观察和疗效判断。
(四) 病理检查组织病理学是诊断肿瘤的金标准。除了准确的病理诊断,现代分子病理学还能提供一些分子标志信息,如神经母细胞瘤N-myc是否扩增、淋巴瘤是否存在ALK的融合突变等,这些信息是肿瘤预后判断以及治疗方案选择的重要依据。
1. 常用的病理组织标本获取方法:①骨髓穿刺或活检:怀疑恶性肿瘤时建议常规骨髓穿刺或活检,评估恶性肿瘤有无骨髓浸润,其对微小残留灶的检测更加敏感。②组织活检:巨大肿块(特别是怀疑恶性肿瘤)患儿一般身体状况较差,由于肿瘤浸润性强,如条件允许,可先行超声引导、CT引导或胸腔镜活检。随着影像技术以及细胞学诊断技术的发展,经皮穿刺活检术以其操作方便简单、患儿痛苦少、相关并发症少、诊断准确率高等优点,成为诊断儿童胸部肿瘤的重要方法,逐渐得到广泛应用。肿瘤穿刺活检还有助于排除结核,但需警惕气胸、出血、组织取材不够及针道种植等情况的存在[14-15]。③手术标本:手术切取全部或部分肿瘤组织。部分基因检测项目必须基于新鲜组织标本。④有明显胸腔积液的病例,可以取胸腔积液离心制作细胞块进行病理学检查,对于怀疑淋巴瘤的患儿,如果能通过这样的方法确诊,可使患儿免于穿刺活检及手术活检带来的风险。
2. 常见儿童胸部恶性肿瘤的病理诊断类型:①淋巴瘤:是儿童常见的血液系统恶性肿瘤,好发于前纵隔。常见的病理分型包括霍奇金淋巴瘤和非霍奇金淋巴瘤。组织病理学和免疫表型是重要的确诊依据。②神经母细胞瘤:是儿童最常见的恶性肿瘤之一,起源于原始神经嵴,后纵隔是好发部位。按病理类型可分为神经母细胞瘤、节细胞神经母细胞瘤等;按分化程度可分为未分化型、分化差型和分化型。临床上需综合肿瘤分布范围、组织类型、分化程度、分子标志、年龄等因素进行分组。③恶性生殖细胞肿瘤:纵隔恶性生殖细胞肿瘤常位于前纵隔,常见的病理类型包括未成熟畸胎瘤、卵黄囊瘤、胚胎癌、精原细胞瘤及混合性生殖细胞肿瘤。④软组织恶性肿瘤:胸壁和纵隔均可发生软组织恶性肿瘤,常见的恶性软组织肿瘤类型包括炎性肌纤维母细胞瘤、尤文肉瘤和尤文样肉瘤、横纹肌肉瘤、婴儿型纤维肉瘤等。
(五) 二代测序等基因检测技术可取血液及胸腔积液进行基因检测,尤其对于合并胸腔积液且活检穿刺路径困难的患儿,获取血液及胸腔积液进行肿瘤DNA检测,获取基因信息后进行生物信息学分析,有助于诊断及治疗过程中监测,并有助于及时发现复发[16]。
二、儿童胸部实体肿瘤处置流程 (一) 门诊处置流程良性胸腔肿瘤大多生长速度慢,早期临床症状不明显;恶性胸腔内肿瘤增长速度较快,并侵入纵隔或脊椎引起相应症状。多数儿童胸部实体肿瘤因咳嗽等不适,行胸片或者胸部CT检查时偶然发现。
因怀疑纵隔肿瘤而来门诊首次就诊的患儿,就诊前往往已经通过不同方式发现体内存在肿块,要根据其临床表现及辅助检查结果,首先判断临床症状缓急是否需要马上住院,并尽可能对其良恶性进行粗略判断,如考虑良性且无明显症状,可进一步完善检查后择期手术;如患儿已经存在呼吸困难等紧急情况,考虑肿瘤已压迫气道,则需急诊入院;如怀疑肿瘤为恶性,需限期住院治疗;如有气道狭窄、呼吸困难等症状,需急诊收治入院。常见胸部实体肿瘤计划入院标准:①胸部占位性病变,性质不确定,尤其是不能排除恶性肿瘤者;②考虑良性肿瘤但直径大于2 cm者,或观察过程中病变增大者,或出现压迫症状者;③出现脊髓、气道压迫等影像学改变者;④出现呼吸急促/困难、静脉扩张/循环障碍、吞咽困难等重要脏器受压侵犯及神经症状,需急诊收治入院者;⑤出现其他并发症或者紧急情况者。
(二) 住院处置流程入院后,立即评估患儿的一般情况,平诊患儿可依次完善术前检查。如有压迫心脏大血管、气道或肿瘤浸润等危及生命的体征出现,在完善相关检查的同时,应及时对症处理,必要时进行呼吸、循环支持,甚至急诊手术。术前快速完善检查有助于明确患儿肿瘤性质、肿瘤分期、有无转移、手术切除的可能性等,并制定个体化诊疗方案。可与影像科、麻醉科、病理科、肿瘤科进行多学科协作(multiple disciplinary team, MDT)诊疗、手术风险的评估以及后续治疗方案的确定。肿瘤病变若涉及颈部或腹部,亦需请相应科室参与MDT诊疗。
术前诊断或考虑为良性实体肿瘤者,因其病变范围局限,与周围脏器、组织无明显粘连,可优先选择手术治疗。术中可通过外科探查以及快速病理等方法评估手术安全性和根治可能性。术前怀疑恶性肿瘤者,首先需确定肿瘤有无远处转移,如骨髓穿刺活检利于远处骨髓转移的排除。影像学检查除针对肿瘤发生部位的检查外,还应包括头颅、腹部的检查以排除转移病灶。肿瘤穿刺活检可用于判定肿瘤性质,若病理结果提示良性,则优先手术切除治疗;若病理结果提示恶性,则根据病理结果及肿瘤范围决定是否先行放化疗,后续根据复查结果,经MDT会诊后再评估手术的可能性及时机。
(三) 肿瘤急危重症处置流程患儿就诊时如出现气促、呼吸困难、脊髓压迫甚至合并休克等急危重症,应开通“绿色通道”争取急诊收治入院,优先考虑收至ICU,综合评估患儿生命体征,并及时做出相应的对症处理。
1. 胸腔积液:少量胸腔积液者建议观察;中等量以上胸腔积液时需行胸腔闭式引流;大量胸腔积液影响呼吸时,应注意引流速度,避免复张性肺水肿。同时注意监测患儿是否存在呼吸、心率、血压的改变,因为释放液体引起的胸腔减压可能引起纵隔摆动,从而导致肿瘤压迫状态的改变,甚至加重病情。放置引流管的同时需完善胸水脱落细胞、胸水常规、生化等检验。另外,胸腔积液会影响CT对肿瘤的评估,应在胸腔引流后再次行CT检查,评估肿瘤位置、范围及与重要血管、脏器的关系。
2. 肿瘤破裂出血:伴有巨大瘤灶患儿,容易出现肿瘤破裂出血。肿瘤破裂出血往往紧急、凶险,对于出血量大、危及生命的肿瘤破裂出血患儿,在积极维持生命体征的同时,需要外科手术止血或介入止血,在病情稳定后应积极考虑针对原发病进行治疗。出血量较小患儿可以保守治疗,保持安静,监测生命体征,对症输注红细胞、止血药,根据凝血功能、血小板情况输注血小板、凝血因子、血浆等。有手术切除指征者需尽快完善术前准备,尽早手术。
3. 压迫气道、大血管:肿瘤压迫气道、大血管时,患儿会出现喘息、呼吸困难、端坐呼吸,甚至心跳呼吸骤停,而一旦心跳呼吸骤停则心肺复苏(cardiopulmonary resuscitation,CPR)抢救效果往往欠佳,因此患儿入院后需紧急评估肿瘤压迫情况,出现呼吸道压迫症状或者影像学上存在气道压迫者,需密切观察病情,避免哭闹、过度刺激,同时做好随时气管插管的准备。对于激素敏感性高的肿瘤,可先予诊断性激素冲击疗法:泼尼松60 mg/m2,并24~48 h内获得病理结果。而对激素不敏感的肿瘤,可通过MDT会诊(麻醉、影像、外科、ICU等)探讨麻醉、气管插管和手术的风险及并发症,优先解除压迫,明确病理后确定后续治疗方案。对于气道梗阻或有梗阻危险的患儿,有其特殊的麻醉处理方法:①麻醉医生术前要全面评估患儿气道,CT断层平扫可准确地显示气管受压位置及受压层面、最狭窄处管腔的直径及肿瘤是否包裹气管,这些信息对麻醉医生选择合适气管导管、确定气管导管放置深度、制定麻醉计划至关重要。②了解患儿是否存在体位性呼吸困难,端坐呼吸是危险即将发生的先兆。注意是否有上腔静脉阻塞的体征。术前明确患儿的强迫体位,麻醉诱导期间可通过改变体位改善肿瘤对气道的压迫,减轻呼吸困难等症状。③麻醉诱导期间,镇静及肌松药的使用可引起肌肉松弛,进一步加重呼吸道梗阻,导致面罩通气困难,引发致命性后果。因此术前需依据气管狭窄的位置及严重程度,合理选择气道管理手段,包括面罩、气管导管、喉罩、气管切开、体外循环、体外膜肺氧合等。对于存在严重气道压迫及狭窄的患儿,术前的气道支架植入可能是相对安全、避免气道塌陷的备选方案之一。④术前如果存在气道梗阻风险,麻醉诱导宜采用慢诱导,保留患儿的自主呼吸较为安全。选用合适的加强气管导管来支撑气道,在插管过程中(尤其是通过管腔最狭窄处)时动作要轻柔,避免引起组织水肿,加重气道梗阻。肿瘤有可能压迫上腔静脉时,麻醉诱导前宜局麻下建立有创血压监测,实时反映血流动力学的变化。⑤术中手术医生需评估肿瘤是否引起气管环的破坏及塌陷,为术后拔管时机提供参考。
4. 脊髓压迫:脊髓受压时可出现下肢进行性无力、大小便失禁、感觉异常等,需MDT(麻醉科、影像科、外科各专业、ICU等)会诊,根据脊髓MRI和(或)肌电图结果,对压迫骨髓的严重程度进行评估分析,优先考虑手术解除脊髓压迫,必要时同期行纵隔肿瘤并椎管内肿瘤切除术。对于影像学出现脊髓压迫、但无临床症状的患儿,根据肿瘤位置可选择纵隔肿瘤切除或活检术,术后根据肿瘤类型进行化疗,化疗期间出现神经症状者,尽快考虑手术切除椎管内肿瘤。
三、儿童胸部实体肿瘤的主要治疗原则胸部实体肿瘤应采用综合治疗的原则,根据肿瘤的生物学行为和患儿的身体状况,联合运用多种治疗手段,兼顾局部治疗和全身治疗,以提高疗效和改善患儿的生活质量。根据肿瘤性质、分期、分级等,制定以手术为主的综合治疗方案。儿童胸部外科实体肿瘤诊疗流程详见图 1。
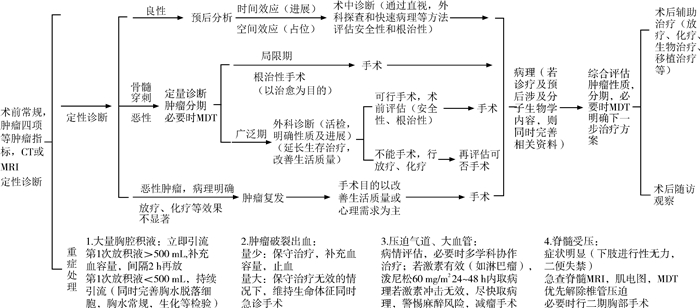
|
图 1 儿童胸部实体肿瘤诊疗路线示意图 Fig.1 Schematic diagram of the diagnosis and treatment route of solid thoracic tumors in children |
一旦诊断为儿童胸部实体肿瘤,不论良性或恶性,除对放、化疗敏感的恶性淋巴瘤外(但有时为了明确诊断也应手术),允许胸部探查者均应及早手术,争取完整切除肿瘤。手术目的不是单纯切除肿瘤,还要通过组织学及分子生物学检查进一步明确肿瘤的性质。病理诊断对患儿术后的进一步治疗和预后起决定性作用,为明确病理类型,获取进一步治疗的依据,穿刺活检已成为儿童胸部实体肿瘤常规的诊断手段。对术前估计难以切除或不能行部分切除的患儿,可采用此方法获取病理诊断,如仍不能确诊者,可考虑开胸探查。对于良性肿瘤,原则上一期切除;而对于恶性肿瘤,整体切除原发瘤灶及区域内转移淋巴结是最好的治疗方法。如果恶性肿瘤侵蚀重要器官、血管,或不可以接受手术并发症,可考虑先行肿瘤穿刺活检,根据病理结果采取化疗或放疗,待肿瘤缩小后,再行手术治疗。术前评估时,手术切除范围要求是达到切缘阴性,如果涉及重要血管、脏器无法完整切除,则需要保护重要血管、脏器的结构及功能完整。
1. 术前麻醉重点:儿童胸腔肿瘤手术建议采用气管插管,如条件具备也可采用单肺通气[17]。非巨大胸腔肿瘤,胸腔镜下微创手术可行单肺通气,有助于手术视野清晰暴露,便于手术操作。在全身麻醉诱导后,特别是在使用肌肉松弛剂后,由于周围组织的张力降低,导致巨大肿瘤压力增加而加重气道、大血管的压迫,导致严重的并发症(如窒息、休克),必要时应采用清醒插管[7]。术者应时刻待命,紧急情况下尽快将肿瘤从胸腔中取出并减压。有些学者主张改变体位以减少肿瘤压迫血管和气管,避免麻醉过程中此类并发症的发生。
2. 手术方式及入路选择:根据肿瘤位置及其与邻近组织的关系决定可否行微创手术治疗。胸壁肿瘤多不进胸,胸腔内的肿瘤优先选择胸腔镜下微创手术。一般肿瘤与胸腔直径比少于1/3且无明显周围血管包绕者多数可行胸腔镜手术,胸腔镜Trocar位置尽量远离肿瘤[18]。条件允许的情况下可在机器人辅助下手术,手术视野清晰,操作更灵活,对周围小血管和神经的保护更好。对于已经确诊及怀疑恶性肿瘤者,术中强调无瘤原则,避免因手术操作造成肿瘤扩散。手术切除技巧包括:①对于包膜完整、未包绕重要血管及神经、未侵犯重要脏器、可清晰显露的肿瘤,应完整切除。②开胸手术切口选择是术野显露好坏、切除顺利与否的关键。如肿瘤巨大充满整个胸腔,手术操作空间有限,暴露困难,建议选择后外侧切口进胸,必要时切换肋间隙位置进胸以充分显露;前纵隔肿瘤常规取胸骨正中切口,如前纵隔肿瘤突向一侧胸腔,建议选择前外侧切口,必要时横断胸骨。③若胸腔肿瘤巨大,视野无法完全暴露,包膜相对完整,无明显外侵、粘连,可沿包膜外侧依次游离,优先探查瘤蒂,完整切除肿瘤。④如果巨大胸部实体肿瘤基底宽泛,邻近组织明显浸润,解剖分辨困难,且不能完全暴露,可从肿瘤薄膜内分块切除,避免损伤重要的脏器、血管及神经等。⑤若恶性肿瘤累及重要心脏大血管,应争取通过手术完整切除。可先切除大部分其他部位肿瘤,再根据术中情况切除累及大血管的部分,无法切除的部分可辅以化疗、放疗。受损的大血管需予以成形,必要时应考虑人工血管置换。⑥对于难以完整切除的肿瘤部位可进行标记,以便于后续治疗定位及复查。⑦肺部肿瘤(炎性肌纤维母细胞瘤、黏液表皮样细胞癌、胸膜肺母细胞瘤等)具有易复发的特点,原则上应尽可能完整切除肿瘤。术中根据肿瘤大小、单发或多发情况,选择肺段切除或肺叶切除。淋巴结清扫有助于肿瘤转移的判断。⑧可行体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)或体外循环支持下肿瘤手术[19]。
(二) 化疗化疗是儿童胸部恶性肿瘤综合治疗的一部分,化疗原则:①良性肿瘤无需化疗;②恶性肿瘤Ⅰ期、Ⅱ期,以手术治疗为主,术后化疗为辅;③Ⅲ期及Ⅳ期恶性肿瘤可采用“术前化疗+手术+术后化疗”方案。依据危险度分期决定化疗的强度和方案[20-21]。
(三) 放射治疗对放疗敏感者需在化疗结束后接受原发肿瘤部位、持续存在的转移灶的放疗[22]。紧急放疗仅在患儿出现威胁生命和器官的症状,且对化疗没有反应的情况下进行。如出现脊髓压迫症状且对化疗无效,或手术无法改善症状的情况,可进行紧急放疗。对于肿瘤晚期或已发生骨骼转移的患儿,局部放疗可暂时控制肿瘤和减轻疼痛。
(四) 生物治疗免疫生物治疗是重要的肿瘤治疗手段,恶性肿瘤免疫生物治疗策略主要包括检查点阻断的免疫治疗、嵌合抗原受体T细胞疗法(chimeric antigen receptor T-cellImmunotherapy,CAR-T)、肿瘤治疗性疫苗等[23-25]。
四、儿童胸部实体肿瘤的预后 (一) 良性肿瘤良性肿瘤可缓慢生长,也可较快生长并侵入纵隔或脊椎引起相应症状,可首选手术切除,总体预后良好。
(二) 恶性肿瘤不同病理类型的胸腔实体恶性肿瘤患儿预后亦有差别。①神经母细胞瘤(neuroblastoma,NB):近年来低龄儿童神经母细胞瘤的预后得到了很大的改善,长期无病生存率达50% ~70%,但大年龄晚期儿童NB仍预后较差,长期无病生存率不足30%。②原始神经外胚叶瘤(primitive neuroectodermal tumor, PNET):儿童PNET临床表现多样,恶性程度高,长期生存率低,5年生存率不到50%,尤其是胸腔肿瘤,其易转移、肿瘤残留等特性往往导致疗效不佳。③淋巴瘤:淋巴瘤首选化疗和(或)放疗,手术目的是获取病理结果,以指导后期化疗。儿童恶性淋巴瘤预后在过去30年间有明显改善,非霍奇金淋巴瘤5年生存率可达85%,霍奇金淋巴瘤5年生存率可达95%。
五、儿童胸部实体肿瘤的随访良性肿瘤可门诊定期复查,每半年复查1次CT,恢复良好者随访周期可相应延长。由于恶性肿瘤是一种全身性疾病,且有其特有的生物学特性(如浸润性、转移性),所以对恶性肿瘤疗效的评价不能仅以临床上能观察到的缓解作为治愈的评价指标,而必须远期评估其长期生存率及复发率,可通过门诊复查、电话等方式随访,门诊复查的内容及周期因病情而异。
利益冲突 所有作者均声明不存在利益冲突
执笔专家(排名不分先后)
莫绪明(南京医科大学附属儿童医院)、彭卫(南京医科大学附属儿童医院)、钱波(南京医科大学附属儿童医院)
指导委员会成员(排名不分先后)
曾骐(首都医科大学附属北京儿童医院)、王焕民(首都医科大学附属北京儿童医院)、舒强(浙江大学附属儿童医院)
共识制定及讨论专家组成员(以单位拼音为序)
安徽省儿童医院(段贤伦)、长春市儿童医院(陶永欣)、成都市妇女儿童中心医院(张利兵)、重庆医科大学附属儿童医院(李勇刚)、大连市儿童医院(文平)、复旦大学附属儿科医院(贾兵)、广东省妇幼保健院(洪淳)、广州市妇女儿童医疗中心(刘威)、广州医科大学附属第三医院(俞钢)、河北医科大学第二医院(李索林)、哈尔滨市儿童医院(李怀宁、戚家峰)、海南省妇女儿童医学中心(陈仁伟)、河北省儿童医院(岳芳)、河南省儿童医院(翟波)、湖南省儿童医院(黄鹏)、华中科技大学同济医学院附属同济医院(冯杰雄)、华中科技大学同济医学院附属协和医院(李帅)、江西省儿童医院(明腾)、南京医科大学附属儿童医院(莫绪明、彭卫、李涛、钱波)、青岛市妇女儿童医院(邢泉生、陈瑞)、山东大学齐鲁医院(李爱武)、山西省儿童医院(刘彩霞)、上海儿童医学中心(刘锦纷、孙彦隽)、上海市儿童医院(张儒舫)、上海交通大学医学院附属新华医院(吴晔明)、首都儿科研究所附属儿童医院(张晓伦、武玉睿),首都医科大学附属北京儿童医院(曾骐、王焕民、张娜)、四川大学华西医院(徐畅)、电子科技大学附属医院四川省人民医院(刘文英)、深圳市儿童医院(王元祥)、苏州市儿童医院(李炘)、武汉儿童医院(皮名安)、西安交通大学第二附属医院(李鹏)、西安市儿童医院(施伟栋)、香港大学深圳医院(黄格元)、新疆维吾尔自治区儿童医院(李水学)、徐州市儿童医院(崔传玉)、浙江大学附属儿童医院(舒强、李建华、谭征)、中国医科大学附属盛京医院(贾慧敏)
| [1] |
Siegel DA, King J, Tai E, et al. Cancer incidence rates and trends among children and adolescents in the United States, 2001-2009[J]. Pediatrics, 2014, 134(4): e945-e955. DOI:10.1542/peds.2013-3926 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Lam CG, Howard SC, Bouffet E, et al. Science and health for all children with cancer[J]. Science, 2019, 363(6432): 1182-1186. DOI:10.1126/science.aaw4892 |
| [4] |
Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patient[J]. Semin Pediatr Surg, 2021, 30(4): 151079. DOI:10.1016/j.sempedsurg.2021.151079 |
| [5] |
Verly IR, van Kuilenburg AB, Abeling NG, et al. Catecholamines profiles at diagnosis: Increased diagnostic sensitivity and correlation with biological and clinical features in neuroblastoma patients[J]. Eur J Cancer, 2017, 72: 235-243. DOI:10.1016/j.ejca.2016.12.002 |
| [6] |
Kang NM, Xiao N, Sun XJ, et al. Analysis of ICU treatment on resection of giant tumors in the mediastinum of the thoracic cavity[J]. Asian Pac J Cancer Prev, 2013, 14(6): 3843-3846. DOI:10.7314/apjcp.2013.14.6.3843 |
| [7] |
Guo N, Yu C, Liu Y, et al. Analysis of 50 cases of operated giant thoracic tumors[J]. J BUON, 2015, 20(5): 1360-1367. |
| [8] |
Liu B, Liu L, Li Y. Giant solitary fibrous tumor of the pleura: A case report[J]. Thorac Cancer, 2015, 6(3): 368-371. DOI:10.1016/j.ijscr.2021.106224 |
| [9] |
Chen F, Muranishi Y, Minakata K, et al. Complete resection of a giant mediastinal leiomyosarcoma[J]. Ann Thorac Surg, 2015, 99(3): e69-e71. DOI:10.1016/j.athoracsur.2014.12.024 |
| [10] |
Acharya M, Jamali A, Rao J. Giant costal chondrosarcoma in a patient with hereditary multiple exostoses[J]. Ann Thorac Surg, 2014, 98(5): 1848. DOI:10.1016/j.athoracsur.2014.06.081 |
| [11] |
Galluzzo A, Fatica F, Caternicchia F, et al. 3D CT scan for perioperative identification of anatomical variations of lungs[J]. Future Oncol, 2016, 12(23s): 27-30. DOI:10.2217/fon-2016-0344 |
| [12] |
Chen-Yoshikawa TF, Date H. Update on three-dimensional image reconstruction for preoperative simulation in thoracic surgery[J]. J Thorac Dis, 2016, 8(Suppl 3): S295-S301. DOI:10.3978/j.issn.2072-1439.2016.02.39 |
| [13] |
Feng Z, Li M, Liu F, et al. Analysis of giant thoracic neoplasms: Correlations between imaging, pathology and surgical management[J]. Thorac Cancer, 2017, 8(5): 402-409. DOI:10.1111/1759-7714.12448 |
| [14] |
Huang ZG, Sun HL, Wang CL, et al. CT-guided transthoracic needle biopsy of pulmonary lesions: comparison between the cutting needle and aspiration needle[J]. Br J Radiol, 2021, 94(1118): 20190930. DOI:10.1259/bjr.20190930 |
| [15] |
Ocak S, Duplaquet F, Jamart J, et al. Diagnostic accuracy and safety of ct-guided percutaneous transthoracic needle biopsies: 14-gauge versus 22-gauge needles[J]. J Vasc Interv Radiol, 2016, 27(5): 674-681. DOI:10.1016/j.jvir.2016.01.134 |
| [16] |
Yohe S, Thyagarajan B. Review of Clinical Next-Generation Sequencing[J]. Arch Pathol Lab Med, 2017, 141(11): 1544-1557. DOI:10.5858/arpa.2016-0501-RA |
| [17] |
Lu Y, Dai W, Zong Z, et al. Bronchial blocker versus left double-lumen endotracheal tube for one-lung ventilation in right video-assisted thoracoscopic surgery[J]. J Cardiothorac Vasc Anesth, 2018, 32(1): 297-301. DOI:10.1053/j.jvca.2017.07.026 |
| [18] |
Li Y, Wang J. Experience of video-assisted thoracoscopic resection for posterior mediastinal neurogenic tumours: a retrospective analysis of 58 patients[J]. ANZ J Surg, 2013, 83(9): 664-668. DOI:10.1111/j.1445-2197.2012.06174.x |
| [19] |
Yang H, Chen R, Chen J, et al. ECMO-assisted resection of left main bronchial malignant tumor and left pneumonectomy with comprehensive nursing support: a case report[J]. J Cardiothorac Surg, 2020, 15(1): 300. DOI:10.1186/s13019-020-01348-z |
| [20] |
Ansell SM. Hodgkin Lymphoma: Diagnosis and Treatment[J]. Mayo Clin Proc, 2015, 90(11): 1574-1583. DOI:10.1016/j.mayocp.2015.07.005 |
| [21] |
Mastrangelo S, Attinà G, Ruggiero A. 131-I-metaiodobenzylguanidine and chemotherapy for advanced neuroblastoma[J]. Expert Rev Clin Pharmacol, 2021, 14(11): 1325-1327. DOI:10.1080/17512433.2021.1960821 |
| [22] |
Chen X, Kong H, Luo L, et al. High efficacy of PD-1 inhibitor after initial failure of PD-L1 inhibitor in Relapsed/Refractory classical Hodgkin Lymphoma[J]. BMC Cancer, 2022, 22(1): 9. DOI:10.1186/s12885-021-09028-4 |
| [23] |
Ohaegbulam KC, Assal A, Lazar-Molnar E, et al. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J]. Trends Mol Med, 2015, 21(1): 24-33. DOI:10.1016/j.molmed.2014.10.009 |
| [24] |
Martinez M, Moon EK. CAR T Cells for Solid Tumors: New Strategies for Finding, Infiltrating, and Surviving in the Tumor Microenvironment[J]. Front Immunol, 2019, 10: 128. DOI:10.3389/fimmu.2019.00128 |
| [25] |
Sahin U, Tureci O. Personalized vaccines for cancer immunotherapy[J]. Science, 2018, 359(6382): 1355-1360. DOI:10.1126/science.aar7112 |
 2022, Vol. 21
2022, Vol. 21
