骶神经调控(sacral neuromodulation,SNM)作为泌尿系统神经调控领域的高端技术,已被广泛用于治疗成人神经源性下尿路功能障碍(neurogenic lower urinary tract dysfunction,NLUTD)。近年来多项研究发现,骶神经调控对于儿童神经源性膀胱(pediatric neurogenic bladder,PNB)也有较为理想的疗效。由于学龄前期(3~7岁)PNB患者的认知及行为能力尚未发育完全,因此对这一人群PNB的评估及治疗难度更大。目前国内外尚无研究报道骶神经调控对于学龄前期儿童神经源性膀胱患者的治疗效果。本研究回顾性分析上海儿童医学中心泌尿外科近年来接受骶神经调控患者的临床数据,现报告如下。
材料与方法 一、一般资料自2017年1月至2021年8月,上海儿童医学中心共有8例神经源性膀胱患者接受骶神经调控一期电极置入术,其中女7例,男1例。接受手术时患者年龄3~7岁,平均年龄5.44岁。
二、病因、临床表现及保守治疗情况8例均有神经系统手术史,其中5例为先天性脊膜膨出手术,2例为骶尾部肿瘤手术,1例为椎管内脂肪瘤手术。8例均表现为排尿困难,尿潴留。8例中仅有1例使用清洁间歇导尿排空膀胱,另有4例使用Credé手法按压排尿,3例不进行辅助排尿。4例存在3次以上发热性尿路感染史。保守治疗情况:8例均口服抗胆碱能药物3个月以上,其中4例无法耐受药物副作用,3例疗效不佳。详见表 1。
| 表 1 所有患者临床资料及骶神经调控一期电极置入术前与术后尿动力学参数 Table 1 Clinical data and urodynamic parameters before and after primary lead implantation |
|
|
8例术前均进行了详细的病史和体格检查。实验室检查包括血尿素氮及肌酐、尿常规及尿培养情况,影像学检查包括泌尿系超声、排泄性膀胱尿路造影、腰骶部磁共振成像、腰骶椎CT、膀胱尿道镜检查等。术前依据国际儿童尿控协会(International Children's Continence Society, ICCS)尿动力学规范行尿动力学检查,灌注速度10 mL/min,当患者出现漏尿或强烈不适时停止灌注[1]。记录膀胱最大容量、逼尿肌漏尿点压力(detrusor leak point pressure, DLPP)以及膀胱顺应性。
四、手术方案手术治疗包括一期电极置入与二期永久调控器置入两部分。手术指征为:①储尿功能障碍,膀胱容量低于预计膀胱容量的75%;②控尿时间小于1 h;③排尿困难,残余尿量增多(超过膀胱最大容量的50%)。存在以上情况患者接受行为治疗及抗胆碱能药物治疗3个月以上而效果不明显或无法耐受药物副反应者,经与家属充分沟通,家属有强烈意愿尝试骶神经调控疗法,遂签定知情同意书,本研究经医院伦理委员会审核批准。
手术采取全身麻醉,一期电极置入术中患者取俯卧位,臀部抬高,小腿垫高,使膝关节屈曲,保证足趾悬空。在C形臂X线机透视下定位骶3神经孔,逐步调整并将穿刺针置入骶3神经孔。使用外接电刺激器通过触碰已置入骶3神经孔的穿刺针行神经测试。如患者肛门出现风箱样运动及大拇趾跖屈反射,提示定位准确,连接临时刺激器;如骶3神经孔测试未见明显反应,则选择骶4神经孔进行电极置入。
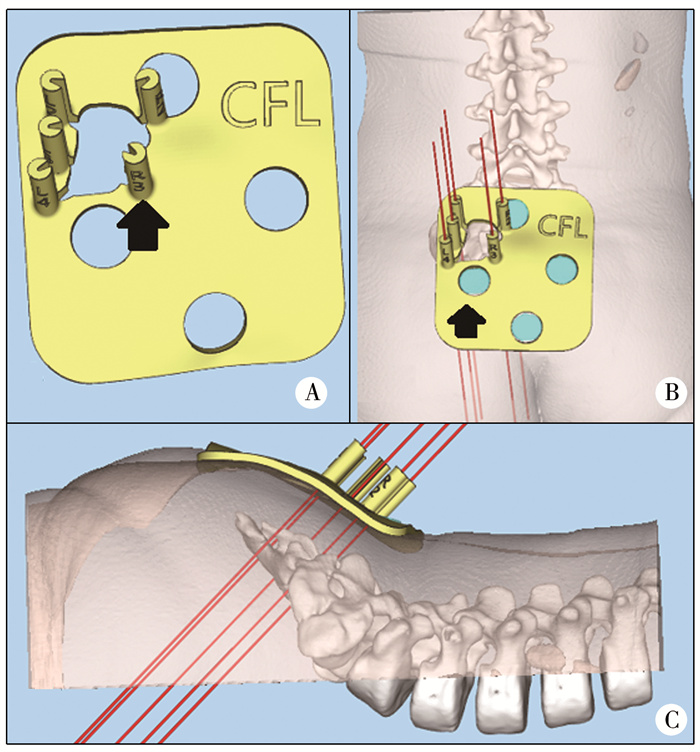
一期电极置入术后3周左右再次进行尿动力学检查,比较一期电极置入术前及术后最大膀胱容量、膀胱顺应性及逼尿肌漏尿点压力的变化。术后排尿量增加、尿失禁次数减少、残余尿量减少视为有效。当以上指标有一项或多项改变幅度大于50%时,可二期置入美敦力公司第2代3058型骶神经调控仪。围手术期使用二代头孢菌素预防感染。因本中心接受骶神经调控的部分患者存在局部解剖结构异常,一部分患者经历过骶尾部手术,对于此类患者我们使用3D打印技术制作3D导板辅助神经穿刺(图 1),并依靠肛门肌肉运动与拇趾反射判断定位。
|
图 1 3D打印导板在骶尾部畸形患者骶神经调控一期电极置入术中的应用 A:3D导板正面外观,箭头所示凸起为引导穿刺处;B:导板应用时正面外观,此患者骶骨左移,导致手术困难,应用3D导板可解决此问题;C:导板应用时侧面外观,红线部分示穿刺方向 Fig.1 Application of plate during lead |
采用SPSS 21.0对数据进行统计分析。正态分布的计量资料用均数±标准差(x±s)表示,一期电极置入术前、术后测量指标的比较采用配对t检验,P < 0.05为差异有统计学意义。
结果一期电极置入后,8例中7例效果明显,行二期永久调控器置入;1例因膀胱容量改善不明显,拔除电极,未行二期永久调控器置入。一期电极置入后,患者最大膀胱容量较术前明显增加(图 2),膀胱顺应性较术前明显改善,差异均有统计学意义(P<0.05);但DLPP术后未见明显变化(表 2)。所有患者一期电极置入术后排尿困难症状无明显变化,均需经指导后行清洁间歇导尿,定期排空膀胱。
| 表 2 骶神经调控一期电极置入术前与术后尿动力学参数比较(x±s) Table 2 Statistical comparison of urodynamic parameters before and after lead implantation(x±s) |
|
|
PNB发病率为0.3‰ ~4.5‰,是指发生于儿童的、因神经系统异常导致的排尿功能障碍,又称神经源性排尿功能障碍。引起PNB的主要原因是先天性脊髓发育不良[2]。除此之外,外伤、骶尾部肿瘤、椎管内肿瘤及医源性损伤也是引起此疾病的常见原因[3]。随着病情进展,此类患者逐渐出现膀胱内压力异常增高、膀胱顺应性下降、膀胱重构,继而发生膀胱输尿管反流、肾积水,最终导致肾功能损伤,逐渐发展为终末期肾病。因此,神经源性膀胱的治疗目的是在保护上尿路功能的前提下尽量解除尿失禁,从而实现延长寿命并提高生活质量的目的。实现这个目的关键在于保证贮尿期膀胱内低压(低于40 cm水柱),并在此前提下保证膀胱具有充足的容量,从而实现控尿[4, 5]。目前常用的治疗手段有生物反馈治疗、抗胆碱能药物治疗、清洁间歇导尿以及可控性膀胱扩大术等[6]。尽管目前儿童神经源性膀胱以保守治疗为主,但仍有部分患者疗效不佳,或无法耐受药物带来的副作用(如病例1,尽管平日口服托特罗定可维持满意的膀胱容量,但患者经常诉口干等不适,而降低药量又会导致膀胱容量减小),而膀胱扩大术对于患者解剖结构改变较大,患者家长往往难以接受。
骶神经调控作为一种新疗法,可通过改变或调节预先存在的神经活动来影响器官生理行为[7]。1997年FDA首先批准其用于急迫性尿失禁的治疗[8]。我国自2000年开始将骶神经调控用于成人下尿路功能障碍的治疗。Guys等[9]于2004年报道将其用于儿童及青少年(平均年龄11.9岁)神经源性膀胱致下尿路功能障碍的治疗,该研究选取42例脊柱裂患者(平均年龄12.25岁),并分为置入组(21例)及对照组(21例),置入组采用骶神经调控疗法,对照组采取口服抗胆碱能药物等保守治疗。结果显示置入组中9例排便功能得到改善,5例尿路感染完全消失,6例可感知膀胱充盈,而对照组中无一例主观感觉得到改善。2010年Haddad等[10]发表了一项前瞻性研究,使用骶神经调控疗法治疗儿童尿失禁及大便失禁,总改善率超过75%。Megan等[9]于2015年使用骶神经调控疗法治疗儿童(6.1~17.3岁,平均10.8岁)下尿路功能障碍,21例膀胱过度活动患者植入骶神经调控器后,14例症状明显改善;4例膀胱排空功能障碍患者安装骶神经调控器后,残余尿量显著下降(术前765 mL vs.术后235 mL)。
二、骶神经调控疗法对学龄前期神经源性膀胱的治疗意义本研究首次报道使用骶神经调控疗法治疗学龄前期儿童神经源性膀胱。因学龄前期儿童年幼,无法完整表达主观感受,因此一期电极置入术采用全身麻醉,术中仅依靠患者运动应答(会阴部及足部运动)来判断电极位置准确与否,这与标准骶神经调控一期电极置入略有不同[11]。学龄前期儿童手术后往往无法很好地配合检查(如超声膀胱容量及残余尿量测定),因此本研究选用膀胱容量、顺应性、逼尿肌漏尿点压力这三个较为客观的参数来评价患者术前术后下尿路功能状态的变化[12, 13]。作为微创手术,骶神经调控疗法不改变下尿路及神经原有的解剖结构,具有可逆性,可在行膀胱扩大术前尝试。本研究发现,对于神经源性膀胱患者,骶神经调控疗法可显著增加膀胱容量,但无法改变患者排尿困难的现实,因此仍需要强调清洁间歇导尿对于此类患者的重要作用。对于临近学龄期的患者,骶神经调控疗法的意义在于增加膀胱容量,从而延长控尿时间,方便家长对患者进行清洁间歇导尿。
三、骶神经调控疗法应用于儿童面临的问题尽管目前全世界已有多篇骶神经调控疗法治疗儿童下尿路功能障碍的研究报道,但骶神经调控疗法在儿童(尤其是幼儿及学龄前期儿童)群体中的应用仍被许多同行质疑[14]。究其原因,可能包括以下方面:第一,目前现存研究大部分为回顾性研究,且每项研究样本量均较小,临床可参考性有待提高。第二,骶神经调控仪器均针对成人研发,儿童体型与成人体型差异明显,难以适配,增加了手术的难度;同时因为儿童通常无法完整、清晰地表达自身感觉,这也对手术后仪器准确程控提出了挑战。第三,有研究指出,电极放置在儿童体内,可能因为随着儿童体格的生长,出现电极移位或断裂的风险增加[15]。但也有研究指出,电极问题的发生可能与儿童体格生长无关[16]。第四,骶神经调控仪的价格较昂贵,且目前没有医保覆盖,测试阶段及调控仪永久植入两阶段约需花费10万元甚至以上,而多数神经源性膀胱患者既往存在神经系统病变,可能有多次手术史,家属为治疗原发病已花费较多金钱及时间,从而限制了此项技术的开展。
由于对骶神经调控手术指征的把握较为严格,且研究时间较短,导致本研究样本量较小,仅收集了短期的尿动力学参数进行分析。同时,由于新型冠状病毒肺炎疫情的存在,部分接受骶神经调控的患者出行及返程受到影响,这也给术后随访工作带来了困扰。因此,骶神经调控对于学龄前期神经源性膀胱患者的长期效果还有待进一步研究。
| [1] |
Austin PF, Bauer SB, Bower W, et al. The standardization of terminology of lower urinary tract function in children and adolescents: Update report from the standardization committee of the international children's continence society[J]. J Urol, 2014, 191(6): 1863-1865. e13. DOI:10.1016/j.juro.2014.01.110 |
| [2] |
Park JS, Lee YS, Lee CN, et al. Efficacy and safety of mirabegron, a β3-adrenoceptor agonist, for treating neurogenic bladder in pediatric patients with spina bifida: a retrospective pilot study[J]. World J Urol, 2019, 37(8): 1665-1670. DOI:10.1007/s00345-018-2576-0 |
| [3] |
曹勇, 樊春燕. 针刺八醪穴对脊髓损伤后神经源性膀胱患者尿流动力学, 膀胱残留尿量和最大尿流率影响[J]. 辽宁中医药大学学报, 2019, 21(8): 205-208. Cao Y, Fan CY. Effects of acupuncture at Baliao Point on urodynamics, bladder residual urine volume and maximum urinary flow rate in patients with neurogenic bladder after spinal cord injury[J]. J Liaoning Univ Tradit Chin Med, 2019, 21(8): 205-208. DOI:10.13194/j.issn.1673-842x.2019.08.055 |
| [4] |
张国贤, 何翔飞, 张艳, 等. 神经源性膀胱患儿清洁间歇导尿致复发性尿路感染的危险因素[J]. 中华实用儿科临床杂志, 2018, 33(1): 812-815. Zhang GX, He XF, Zhang Y, et al. Risk factors for recurrent urinary tract infection in children with neurogenic bladder treated by clean intermittent catheterization[J]. J Appli Clin Ped, 2018, 33(1): 812-815. DOI:10.3760/cma.j.issn.2095-428X.2018.11.004 |
| [5] |
苏佳鸿, 李守林. 肾素-血管紧张素系统在儿童膀胱尿道功能障碍中的作用研究进展[J]. 临床小儿外科杂志, 2021, 20(3): 273-279. Su JH, Li SL. Role and treatment advances of renin-angiotensin system in children with vesicourethral dysfunction[J]. J Clin Ped Sur, 2021, 20(3): 273-279. DOI:10.12260/lcxewkzz.2021.03.014 |
| [6] |
胡丹, 陈玉霞. 儿童神经源性膀胱治疗方式研究进展[J]. 现代医药卫生, 2019, 35(16): 2510-2513. Hu D, Chen YX. Research progress in the treatment of neurogenic bladder in children[J]. J Mod Med &Hel, 2019, 35(16): 2510-2513. DOI:10.3969/j.issn.1009-5519.2019.16.027 |
| [7] |
Amend B, Khalil M, Kessler TM, et al. How does sacral modulation work best? Placement and programming techniques to maximize efficacy[J]. Curr Urol Rep, 2011, 12(5): 327-335. DOI:10.1007/s11934-011-0204-2 |
| [8] |
Steele SS. Sacral nerve stimulation: 50 years in the making[J]. Can Urol Assoc J, 2012, 6(4): 231-232. DOI:10.5489/cuaj.12194 |
| [9] |
Guys JM, Haddad M, Planche D, et al. Sacral neuromodulation for neurogenic bladder dysfunction in children[J]. J Urol, 2004, 172(4 Pt 2): 1673-1676. DOI:10.1097/01.ju.0000138527.98969.b0 |
| [10] |
Haddad M, Besson R, Aubert D, et al. Sacral neuromodulation in children with urinary and fecal incontinence: a multicenter, open label, randomized, crossover study[J]. J Urol, 2010, 184(2): 696-701. DOI:10.1016/j.juro.2010.03.054 |
| [11] |
陈国庆, 宋勇, 丁留成, 等. 骶神经调节术临床应用中国专家共识[J]. 中华泌尿外科杂志, 2014, 35(1): 1-5. Chen GQ, Song Y, Ding LC, et al. Chinese experts' consensus on the application of sacral neuromodulation[J]. Chin J Urol, 2014, 35(1): 1-5. DOI:10.3760/cma.j.issn.1000-6702.2014.01.001 |
| [12] |
文建国, 杨黎. 儿童尿动力学检查[J]. 临床小儿外科杂志, 2011, 10(3): 228. Wen JG, Yang L. Urodynamic testing in children[J]. J Clin Ped Sur, 2011, 10(3): 228. DOI:10.3969/j.issn.1671-6353.2011.03.028 |
| [13] |
罗娟, 徐加龙, 刘倩, 等. 神经源性膀胱括约肌功能障碍患者下尿路尿动力学表现的研究[J]. 临床小儿外科杂志, 2018, 17(7): 506-509. Luo J, Xu JL, Liu Q, et al. Urodynamic performance of lower urinary tract in children of neuropathic bladder-sphincter dysfunction[J]. J Clin Ped Sur, 2018, 17(7): 506-509. DOI:10.3969/j.issn.1671-6353.2018.07.007 |
| [14] |
Ebert KM, Alpert SA. Sacral Neuromodulation: Improving Bladder and Bowel Dysfunction in Children[J]. Current Treatment Options in Pediatrics, 2018, 4(1): 24-36. DOI:10.1007/s40746-018-0116-1 |
| [15] |
Stephany HA, Juliano TM, Clayton DB, et al. Prospective Evaluation of Sacral Nerve Modulation in Children with Validated Questionnaires[J]. J Urol, 2013, 190(4): 1516-1522. DOI:10.1016/j.juro.2013.01.099 |
| [16] |
Mason MD, Stephany HA, Casella DP, et al. Prospective Evaluation of Sacral Neuromodulation in Children: Outcomes and Urodynamic Predictors of Success[J]. J Urol, 2016, 195(4 Pt 2): 1239-1244. DOI:10.1016/j.juro.2015.11.034 |
 2021, Vol. 20
2021, Vol. 20


