由于神经源性膀胱(neurogenic bladder, NB)患者控制膀胱尿道的神经受损,可导致下尿路功能障碍,并在储尿期和(或)排尿期出现异常表现[1, 2]。儿童NB的主要病因包括脊髓发育不良、神经系统肿瘤、骶骨发育不全、脊柱畸形或外伤、颅内感染、脑瘫等。随着病情进展,NB患者膀胱功能将逐步恶化,表现为膀胱壁增厚及纤维化、膀胱容量和顺应性下降,继而导致膀胱内压力逐步升高。这一过程将导致尿液反流至上尿路,引起上尿路受损,严重时将导致肾功能衰竭。因此对上尿路受损情况进行快速而准确的评估,并对造成上尿路受损的危险因素及时进行干预具有极其重要的意义。目前针对NB患者上尿路受损的危险因素进行分析的文献相对较少,且观点存在争议。本研究旨在初步探讨上尿路受损的相关危险因素及其预测价值,为NB的临床诊治提供参考。
材料与方法 一、研究对象及分组回顾性分析2013年3月至2020年12月在郑州大学第一附属医院住院治疗的NB患者临床资料。病例纳入标准:①年龄1~14岁;②自幼排尿功能异常,病因包括神经发育异常、产伤、颅内感染、脊柱发育异常、骨盆畸形。排除标准:入院前行相关治疗,包括近期服用膀胱受体阻滞剂药物、进行清洁间歇导尿、留置导尿管导尿、行膀胱造瘘术或膀胱扩大术。本研究最终纳入131例NB患者,年龄范围1~14岁,平均年龄7.44岁;其中男性64例,女性67例。
参考神经源性膀胱上/下尿路功能障碍的分类标准,符合下述一项即判定为上尿路受损:①泌尿系B超、静脉尿路造影(intravenous urography,IVU)、电子计算机断层扫描(computed tomography,CT)、磁共振尿路造影(magnetic resonance urography,MRU)提示肾、输尿管扩张或积水,肾集合系统分离短径≥10 mm;输尿管直径≥5 mm;②SPECT检查结果提示总肾小球滤过率(total glomerular filtration rate,tGFR) < 90 mL/min;③CT、MRU提示输尿管壁形态明显异常,表现为不规则增厚、管腔狭窄、梗阻[3]。根据上述标准,将纳入的NB患者分为上尿路受损组(n=82)及上尿路未受损组(n=49)。
二、临床资料收集收集患者性别、年龄、病因、神经系统手术史、血常规、尿常规、尿培养、普通尿动力检查、影像尿动力检查、泌尿系超声检查、泌尿系CT、IVU、MRU及SPECT肾动态显像检查结果。通过尿动力及影像尿动力检查结果,获得最大膀胱容量(maximum cystometric capacity,MCC)、膀胱容积比(bladder volume ratio,BVR)、充盈期最大逼尿肌压力(maximum detrusor pressure during filling,maxPdet)、膀胱顺应性(compliance,△C)、峰值流率(maximum flow rate,Qmax)、膀胱排空效率(bladder emptying efficiency,BVE)、逼尿肌漏尿点压力(detrusor leak point pressure,DLPP)、峰值流率时逼尿肌压力(pressure at the peak flow rate,PdetQmax)以及膀胱过度活动(overactive bladder, OAB)、逼尿肌括约肌协同障碍(detrusor sphincter dyssynergia, DSD)、逼尿肌无收缩(acontractile detrusor, ACD)、膀胱宝塔样改变、膀胱壁粗糙、多发憩室样改变、膀胱输尿管反流(vesicoureteric reflux, VUR)的发生率。其中BVR=MCC/EBV(预测膀胱容量,expected bladder volume)×100%,BVE=VV(排尿量,voided volume)/MCC×100%。通过泌尿系超声检查获得相关参数,包括肾盂前后径(anterior posterior diameter,APD)、输尿管内径(ureteral diameter,UD)以及膀胱壁厚度(bladder wall thickness,BWT),其中BWT为测量膀胱壁3个不同部位厚度并取平均值所得。通过肾动态SPECT检查结果获得总肾功能tGFR。
三、统计学方法采用SPSS21.0进行统计学分析。对两组定量资料进行正态性及方差齐性检验后,采用独立样本t检验进行组间比较,结果以均数±标准差(x±s)表示。定性资料采用χ2检验,结果以频数、率和构成比表示。将单因素分析有意义的变量进行多因素Logistic逐步回归分析,以探讨上尿路受损的危险因素。将多因素分析中有统计学意义的变量绘制ROC曲线,分析其对NB患者上尿路受损的预测价值,并获取最佳临界值。P < 0.05为差异有统计学意义。
结果82例上尿路受损患者tGFR为(67.64±13.67)mL/min。双肾积水发生率为35.37%;左肾积水发生率为40.24%,其APD范围为(22.21±9.34)mm;右肾积水发生率为40.24%,其APD范围为(23.70±10.53)mm。双侧输尿管扩张发生率20.73%;左输尿管扩张发生率为28.05%,其UD范围为(10.30±4.16)mm;右输尿管扩张发生率为29.27%,其UD范围为(9.79±3.86)mm。
49例上尿路未受损患者tGFR为(105.64±16.46)mL/min, 泌尿系影像学检查未发现形态改变。
两组在病因、神经系统手术方式方面比较,差异无统计学意义(表 1)。两组BVR、maxPdet、△C、DLPP、Qmax、BVE、BWT、尿液中白细胞数、血液中淋巴细胞比例、血液中中性粒细胞比例和淋巴细胞计数(lymphocyte count,LY)以及OAB、DSD、ACD、膀胱圣诞树样改变、膀胱壁毛糙、膀胱憩室、VUR、尿培养阳性、亚硝酸盐阳性的发生率比较,差异有统计学意义(P<0.05)。详见表 2。
| 表 1 上尿路受损组与上尿路未受损组病因及神经系统手术方式比较[n(%)] Table 1 Comparison of etiologies and neurosurgical approaches between two groups[n(%)] |
|
|
| 表 2 上尿路受损组与上尿路未受损组辅助检查结果比较 Table 2 Comparison of auxiliary examination results between two groups |
|
|
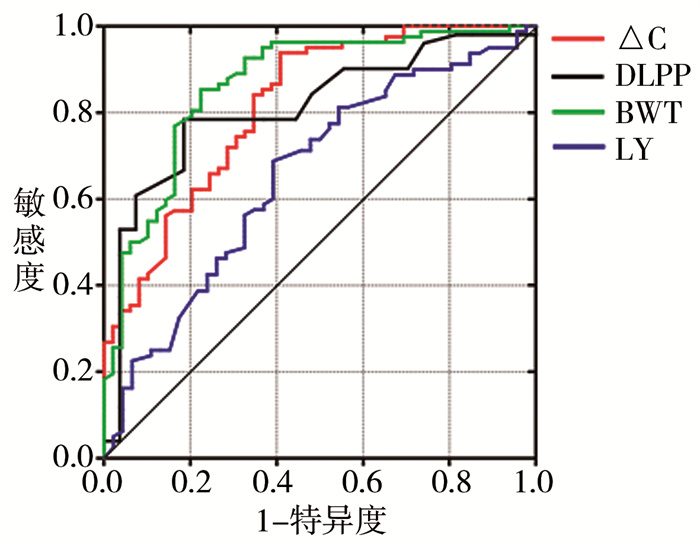
将上述单因素分析后差异有统计学意义的变量经多因素Logistic逐步回归分析后发现,△C下降、DLPP升高、BWT增厚、LY下降为上尿路受损的危险因素(表 3)。分别用△C、LY、BWT、DLPP绘制ROC曲线(图 1),发现BWT可以较好地预测上尿路受损(表 4)。
| 表 3 NB患者上尿路受损的多因素Logistic分析结果 Table 3 Multivariate Logistic analysis of upper urinary tract injury in NB children |
|
|
|
图 1 △C、DLPP、BWT、LY预测NB患者发生上尿路受损的ROC曲线 Fig.1 ROC curve of △C, DLPP, BWT and LY predicting upper urinary tract injury in NB children |
| 表 4 △C、DLPP、BWT、LY预测NB患者上尿路受损的ROC曲线分析 Table 4 ROC curve analysis of predictive factors of upper urinary tract injury in NB children |
|
|
神经源性膀胱患者如未得到及时治疗,随着病情进展,其上尿路将严重受损,结构及功能将发生明显改变。有研究表明,如果不对NB患者进行干预,约58%的患者将出现上尿路受损进行性恶化[4]。Manack[5]发现,脊髓损伤致慢性肾功能衰竭的概率为1.3%,本研究中NB上尿路受损的发生率为62.60%,肾功能衰竭的发生率为3.4%。因此,及时对上尿路进行保护具有极其重要的意义。
一、NB患者上尿路受损的危险因素保护上尿路需要对相关危险因素进行针对性控制[6]。目前较多研究发现,上尿路受损与膀胱尿道功能、膀胱结构改变、泌尿系感染有关,曾健文[7]通过对40例腰骶椎管病变患者的病变类型、术式与上尿路损害的相关性进行分析,发现这两个因素与上尿路损害不相关。本研究发现,不同神经系统病变及接受不同术式的患者,上尿路损害发生率无显著差异,这表明病变类型以及进行神经系统相关手术与上尿路受损无关。Galloway等[8]研究发现,采用VUR、NDO、△C、DLPP、DSD建立的评分与上尿路受损显著相关。Wang[9]根据NB患者是否发生上尿路扩张进行分组,比较两组患者DLPP、膀胱容量以及ACD发生率,发现上述指标组间差异显著。Önal[10]对脊髓损伤儿童上尿路损伤的危险因素进行分析,发现maxPdet>70 cmH2O、BVR < 70%是导致上尿路损伤的危险因素。另外一些研究发现,UAB、BVE、膀胱憩室形成、膀胱壁小梁化、膀胱厚度与肾功能受损存在相关性[11-13]。我们将两组患者上述参数进行比较后发现,上尿路受损组膀胱结构及功能较未受损组有明显的差异。上尿路受损组膀胱壁明显增厚,膀胱壁毛糙,多发憩室,VUR的发生率较高,膀胱功能表现为低△C、低膀胱顺应性、高逼尿肌压力、残余尿增多、充盈期出现OAB、DSD、ACD。这些变化将导致膀胱储尿及排尿功能明显下降,从而使尿液从上尿路运输至下尿路的过程受阻,发生反流。上尿路压力明显升高将导致其病理性扩张,从而出现功能受损并逐渐恶化。同时我们发现,上尿路受损组膀胱圣诞树样改变的发生率较正常组低。目前尚无该方面的研究及结论,仅对该现象进行描述,其可能原因是膀胱通过扩大膀胱容积来进行代偿,后续我们将对此进行进一步的探讨。
一些研究认为,泌尿系感染也与上尿路受损有关。一项研究发现,85%的泌尿系感染婴儿及儿童DMSA扫描结果异常,其中10.4%出现永久性肾瘢痕[14]。其可能机制为VUR将病原体带入上尿路。病原体的毒力因素导致肾组织发生异常的炎症及免疫应答,从而导致肾组织受损及肾功能下降。
有研究发现慢性肾功能不全患者会出现淋巴细胞数量减少,免疫功能下降,从而导致尿路感染的风险增加[15]。我们的研究发现,上尿路受损组淋巴细胞计数较上尿路未受损组明显下降,表明淋巴细胞对上尿路具有重要的保护作用。这提示在NB患者随访过程中,如果出现血液中淋巴细胞计数下降,应积极采取措施调节免疫功能。
本研究对上述全部单因素进行分析后,将差异有统计学意义的变量纳入Logistic回归分析,结果显示与上尿路受损相关的独立危险因素包括△C、DLPP、LY、BWT,说明当患者出现这些因素恶化时,上尿路受损的风险增加。其中BWT的Wald χ2值最高,表明其对上尿路影响较大,与崔艳红[16]的研究结果一致,崔艳红认为BWT增厚与神经源性下尿路功能障碍患者的上尿路损害存在很强的相关性。
二、BWT可较好地预测NB患者上尿路受损自1981年McGuire[17]发现42例脊髓发育不良患者中仅15例DLPP>40 cmH2O的患者存在膀胱输尿管反流以后,此范围即被认为是导致上尿路受损的危险因素。Tarcan[18]认为DLPP>20 cmH2O比DLPP>40 cmH2O有更高的预测敏感性。本研究以DLPP构建ROC曲线的AUC值达0.812,其截断值的灵敏度及特异度尚可。但当患者存在DSD时,该值的测量会由于尿道存在异常收缩而受影响,所以DLPP不宜作为预测指标。△C反映的是膀胱在充盈期维持膀胱内压力不变的能力,其升高或降低将对膀胱充盈及排空功能产生影响。有研究发现,以DLPP>40 cmH2O、△C<9 mL/cmH2O以及是否存在ACD来构建的尿动力学风险评分与上尿路扩张程度呈正比。本研究以△C构建的ROC曲线截断值为12.05 mL/cmH2O,但是特异度相对较低,可为后续进一步研究提供参考[9]。通过超声检测膀胱厚度具有简便、无创、易随访的特点,崔艳红[16]通过BWT对NB成年患者上尿路是否出现损伤进行预测,其截断值为4.8 mm,但该截断值特异度低,且不适用于儿童。Prakash等[13]以3.05 mm作为截断值,但其纳入的样本量仅30例,因而不具说服力。本研究以BWT构建ROC曲线的AUC为0.866,以3.925 mm作为截断值,灵敏度为0.854,特异度为0.776,表明BWT对NB患者是否存在上尿路受损有很好的预测作用。同时以BWT构建ROC曲线的AUC值及截断值的约登指数均大于其他3个指标,所以其预测效能更优。该值的确立可为NB患者病情评估及治疗方案的制定提供参考,当膀胱壁厚度接近或者大于此值时,应该采取积极的处理措施以保护上尿路。
综上所述,DLPP升高、△C下降、BWT增厚、LY下降是导致NB患者上尿路受损的危险因素。BWT>3.925 mm可在一定程度上预测NB患者存在上尿路受损。
| [1] |
文建国, 李云龙, 袁继炎, 等. 小儿神经源性膀胱诊断和治疗指南[J]. 中华小儿外科杂志, 2015, 36(3): 163-169. Wen JG, Li YL, Yuan JY, et al. Guideline on diagnosis and treatment of neurogenic bladder in children[J]. Chin J Pediatr Surg, 2015, 36(3): 163-169. DOI:10.3760/cma.j.issn.0253-3006.2015.03.002 |
| [2] |
罗娟, 徐加龙, 刘倩, 等. 神经源性膀胱括约肌功能障碍患儿下尿路尿动力学表现的研究[J]. 临床小儿外科杂志, 2018, 17(7): 506-509. Luo J, Xu JL, Liu Q, et al. Urodynamic performance of lower urinary tract in children of neuropathic bladder-sphincter dysfunction[J]. J Clin Ped Sur, 2018, 17(7): 506-509. DOI:10.3969/j.issn.1671-6353.2018.07.007 |
| [3] |
廖利民. 神经源性膀胱患者上/下尿路功能障碍的全面分类标准[J]. 中华泌尿外科杂志, 2015, 36(2): 84-86. Liao LM. Comprehensive classification criteria for upper/lower urinary tract dysfunction in patients with neurogenic bladder[J]. Chin J Urol, 2015, 36(2): 84-86. DOI:10.3760/cma.j.issn.1000-6702.2015.02.002 |
| [4] |
Smith ED. Urinary prognosis in spina bifida[J]. J Urol, 1972, 108(5): 815-817. DOI:10.1016/S0022-5347(17)60877-2 |
| [5] |
Manack A, Motsko SP, Haag-Molkenteller C, et al. Epidemiology and healthcare utilization of neurogenic bladder patients in a us claims database[J]. Neurourol Urodyn, 2011, 30(3): 395-401. DOI:10.1002/nau.21003 |
| [6] |
Denys P, Chartier-Kastler E, Even A, et al. How to treat neurogenic bladder and sexual dysfunction after spinal cord lesion[J]. Rev Neurol (Paris), 2021, 177(5): 589-593. DOI:10.1016/j.neurol.2020.07.013 |
| [7] |
曾健文, 莫鉴锋, 吴小伟, 等. 腰骶椎管病变患者发生上尿路损害的危险因素分析[J]. 中国全科医学, 2011, 14(24): 2746-2748. Zeng JW, Mo JF, Wu XW, et al. Risk factors for upper urinary tract injury among patients with lumbosacral vertebrae lesions[J]. Chinese General Practice, 2011, 14(24): 2746-2748. DOI:10.3969/j.issn.1007-9572.2011.24.012 |
| [8] |
Galloway NT, Mekras JA, Helms M, et al. An objective score to predict upper tract deterioration in myelodysplasia[J]. J Urol, 1991, 145(3): 535-537. DOI:10.1111/j.1464-410X.1991.tb15153.x |
| [9] |
Wang QW, Wen JG, Song DK, et al. Is it possible to use urodynamic variables to predict upper urinary tract dilatation in children with neurogenic bladder-sphincter dysfunction?[J]. BJU International, 2010, 98(6): 1295-1300. DOI:10.1111/j.1464-410X.2006.06402.x |
| [10] |
Önal B, Kırlı EA, Selçuk B, et al. Risk factors predicting upper urinary tract deterioration in children with spinal cord injury[J]. Neurourol Urodyn, 2021, 40(1): 435-442. DOI:10.1002/nau.24580 |
| [11] |
Kim DK. Current pharmacological and surgical treatment of underactive bladder[J]. Investig Clin Urol, 2017, 58(Suppl 2): S90-S98. DOI:10.4111/icu.2017.58.S2.S90 |
| [12] |
Kumar S, Jayant K, Barapatra Y, et al. Giant urinary bladder diverticula presenting as epigastric mass and dyspepsia[J]. Nephro-Urol Mon, 2014, 6(4): e18918. DOI:10.5812/numonthly.18918 |
| [13] |
Prakash R, Puri A, Anand R, et al. Predictors of upper tract damage in pediatric neurogenic bladder[J]. J Pediatr Urol, 2017, 13(5): 503.e1-503.e7. DOI:10.1016/j.jpurol.2017.02.026 |
| [14] |
Stein R, Dogan HS, Hoebeke P, et al. Urinary tract infections in children: EAU/ESPU guidelines[J]. Eur Urol, 2015, 67(3): 546-558. DOI:10.1016/j.eururo.2014.11.007 |
| [15] |
Borges A, Borges M, Fernandes J, et al. Apoptosis of peripheral CD4(+) T-lymphocytes in end-stage renal disease patients under hemodialysis and rhEPO therapies[J]. Ren Fail, 2011, 33(2): 138-143. DOI:10.3109/0886022X.2011.553300 |
| [16] |
崔艳红, 谢克基, 欧汝彪. 膀胱壁厚度预测神经源性下尿路功能障碍患者上尿路损害的价值[J]. 中华泌尿外科杂志, 2018, 39(5): 377-381. Cui YH, Xie KJ, Ou RB. Value of bladder wall thickness in predicting upper urinary tract damage in patients with neurogenic lower urinary tract dysfunction[J]. Chinese Journal of Urology, 2018, 39(5): 377-381. DOI:10.3760/cma.j.issn.1000-6702.2018.05.013 |
| [17] |
Mcguire EJ, Woodside JR, Borden TA, et al. Prognostic value of urodynamic testing in myelodysplastic patients[J]. J Urol, 1981, 126(2): 205-209. DOI:10.1016/S0022-5347(17)54449-3 |
| [18] |
Tarcan T, Sekerci CA, Akbal C, et al. Is 40 cmH2O detrusor leak point pressure cut-off reliable for upper urinary tract protection in children with myelodysplasia?[J]. Neurourol Urodyn, 2017, 36(3): 759-763. DOI:10.1002/nau.23017 |
 2021, Vol. 20
2021, Vol. 20


