2. 广东欧谱曼迪科技有限公司(广东省广州市, 528200)
2. Guangdong OptoMedic Technologies Inc, Guangzhou 528200, China
儿童急性肠套叠、肠扭转均可引起肠管缺血,若不能通过保守治疗复位,则需急诊手术治疗。传统上对缺血肠段的判断主要依靠术中观察肠壁色泽、肠管收缩力等,如术者经验不足极易导致误判。近年来,腹腔镜剖腹探查术因创伤小等优点而受到欢迎,但手术过程中术者缺乏触觉反馈,仅依靠视觉信息作出判断,存在一定的主观性。近红外- 吲哚菁绿(near infrared-indocyanine green, NIR-ICG)荧光成像技术显示出较大优势。1954年,吲哚菁绿(indocyanine green, ICG)首次被美国食品和药物管理局批准应用于临床,可用于心输出量检测和肝功能评估[1]。与蛋白结合的ICG在近红外光照射下发出的荧光峰值约在840 nm,几乎不会被周围组织吸收,因此可以穿透组织而被检测到[2]。由于这一特性,NIR-ICG成像系统被广泛应用于外科手术,极大地提高了手术的安全性和准确性[3]。但是,NIR-ICG在小儿外科领域的应用尚未推广,本研究利用犬模型模拟急性肠道血液循环障碍,旨在评估NIR-ICG成像系统用于术中检测缺血肠段的价值。
材料与方法 一、实验药物及动物模型静脉麻醉药物舒泰50(法国维克有限公司,250 mg/盒),注射用灭菌水稀释为50 mg/mL;ICG(丹东医创药业有限公司,25 mg/支),注射用灭菌水稀释为0.25 mg/mL。
实验动物为雄性10月龄比格犬,体重10 kg。动物来源于上海交通大学农学院教学实验实习厂,于上海交通大学医学院附属新华医院动物实验部手术室进行本实验。由于犬的体型与幼儿相似,麻醉用药及手术操作更加接近临床实际情况,因此选择犬构建动物模型开展本项目研究。动物模型构建方法如下:
1. 急性肠缺血模型:暴露、游离犬的一段空肠或回肠,无损夹闭此肠段上的系膜5 min,阻断其间分布的所有空肠动静脉与回肠动静脉分支,外周静脉注射ICG 1 mg/kg一次,等待1 min、3 min后分别对肠段进行成像拍摄,并将此缺血肠段的荧光强度与周围正常肠段的荧光强度进行对比。
2. 再灌注损伤模型:暴露、游离犬的一段空肠或回肠,先外周静脉注射ICG 1 mg/kg一次,等待约1 min达到全身平衡后对肠段进行成像拍摄。以上述方法无损夹闭肠系膜10 min后松开,等待120 min后再次拍摄,并对比缺血肠段的荧光强度。
二、图像采集和半定量方法术中使用NIR-ICG荧光成像腹腔镜系统(欧谱曼迪科技有限公司),光源类型为激光,波长805 nm,感光波长820~880 nm。以机械臂固定成像摄像头,置于肠管斜上方约1 m高度,调整适当焦距。本实验使用了3种成像方式,包括白光模式、荧光模式和对比模式(整合模式),所有模式皆可自由切换。在荧光模式下,拍摄所得图像荧光强度可利用系统自带软件进行实时半定量分析:由操作者在荧幕上勾画出1 cm×1 cm的闭合区域作为测量框,系统将自动对所选区域的荧光强度进行分析。在急性肠缺血模型中,待周围正常肠段显影后,于正常肠段荧光显影明显处勾画一个测量框进行测量,将此区域的荧光强度定义为100%,然后将测量框复制到缺血肠段处进行测量,测得缺血肠段处的数值(即为相对荧光强度)。在再灌注损伤模型中,肠段先显影后再进行缺血处理,此时勾画出1 cm×1 cm闭合区域作为测量框,测得缺血肠段的荧光强度均为100%,待血供再灌注120 min后再次测量此处的荧光强度及周围正常肠段的荧光强度并进行对比。
结果 一、ICG在缺血肠段显影受阻无损夹闭局部肠段的系膜,并结扎靠近该肠段的动脉弓(图 1A箭头所指处为靠近肠段的动脉弓),使得局部肠段缺血5 min,白光模式下可见缺血肠段相对正常肠段的色泽开始变深(图 1A)。此时经外周静脉注射ICG 1 mg/kg等待1 min,在荧光模式下可见正常肠段显影,而缺血肠段显影受阻,正常肠段与缺血肠段边界清晰可见,定义此时的正常肠段荧光强度为100%,则缺血肠段的荧光强度为0%(图 1B)。3 min后再次测量缺血肠段的荧光强度仍为0%(图 1C)。

|
图 1 ICG在缺血肠段显影受阻 Fig.1 Failed ICG imaging in ischemic intestine A:缺血5 min后,白光模式下缺血肠段和正常肠段的色泽差异;B:缺血5 min后,荧光模式下缺血肠段和正常肠段的显影差异;C:缺血8 min后,荧光模式下缺血肠段和正常肠段的显影差异 |
待ICG从肠段中代谢完毕后,再次经外周静脉注射ICG(1 mg/kg),等待1 min,选择一段正常肠段,在荧光模式下可见显影良好(图 2A)。无损夹闭此肠段的系膜并结扎靠近该肠段的动脉弓,使局部肠段缺血10 min,白光模式下可见缺血肠段色泽明显变深,荧光模式下缺血肠段和正常肠段显影无显著区别,定义此时缺血肠段的荧光强度为100%。松开系膜使血液再灌注肠段120 min,白光模式下再灌注损伤的肠段与周围正常肠段无显著区别,但荧光模式下可见缺血再灌注损伤后的肠道中有ICG滞留,其荧光强度为20.3%,而周围正常肠段荧光强度下降为0%(图 2B)。
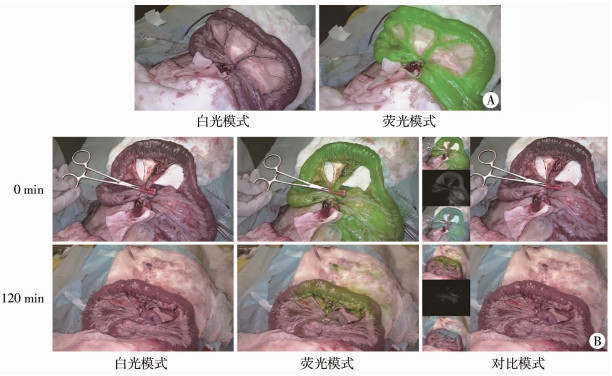
|
图 2 ICG在缺血再灌注损伤后的肠段中滞留 Fig.2 ICG retention in reperfusion injured intestinal segment A:静脉注射ICG并等待1 min后,正常肠段的白光模式下色泽及对应的荧光模式下显影;B:令此肠段缺血10 min,在白光模式,荧光模式及对比模式下拍摄;再灌注血液120 min后再次在白光模式,荧光模式及对比模式下拍摄 |
ICG通过静脉注射方式进入人体后可立即与血浆蛋白结合,并迅速分布于血液循环系统和淋巴回流系统。近红外光(波长700~900 nm)的组织穿透性大,而其组织本底荧光强度小,因此可以得到最佳对比度,在影像学定位和诊断中具有广泛的应用前景[4]。ICG在前哨淋巴结定位、血管造影、胆管造影等方面,较传统影像学技术具有更加精准、容易辨识的优点[5-8]。在外科手术中,NIR-ICG成像系统让以三维可视化为代表的数字医学成为可能,基于ICG成像的多模式影像技术实现了精准外科手术操作,预示了真正意义上的虚拟现实医学的到来[9]。目前,NIR-ICG成像系统已经广泛应用在肿瘤精准切除、乳房重建、肝叶切除等外科手术中[10-13]。
在儿外科领域,姚伟等[14]利用ICG对8例肝母细胞瘤患者的肿瘤部位和切除范围进行精准评估,全部实现了RO切除,显示出ICG荧光显影技术在确定肿瘤边界和完整切除中的重要价值。此外,利用三维CT重建联合ICG荧光显影技术,能够在腹腔镜手术中清晰显示病变胆管扩张位置和毗邻动静脉及分支情况,有效避免因术中副损伤而导致的并发症[15]。显然,术中合理应用ICG显影技术能有效提高手术质量,减少手术时间,提高手术的安全性,符合精准医疗的未来趋势。
ICG进入血液后分布迅速,且由于不参与肠肝循环,进入肠管的ICG不再吸收入血,是术中判断肠管微灌注的新型技术。肠管血供情况将直接影响吻合口的愈合,因此,这一技术目前已被应用于手术中评估结直肠吻合口的微灌注情况,可在儿童先天性巨结肠重建手术中起指导作用[16]。有系统性评价研究认为术中评估肠道吻合口的灌注情况十分重要,在方法学上已经从单纯基本的机械通畅性测试向内窥镜可视化技术过渡,NIR-ICG成像是未来发展的方向[17]。然而,肠管吻合术是否成功主要依赖术者的手术技术,NIR-ICG成像虽然可作为一种补救措施,相对于传统肉眼判断在敏感性上有很大优势,但不够经济实用,尚不能大规模应用。利用ICG判断急性缺血肠段,相对而言更有临床应用前景。ICG在血管造影中速度很快,这使它成为一种简便快捷的术中诊断工具,在急诊手术中可以快速定位缺血肠段。
本研究结果证实ICG在静脉注射1 min后即可在正常肠管中快速显影,而缺血肠段显影受阻,且二者边界清晰,可以作为切除缺血肠段范围的确切依据。相对于注射1%普鲁卡因后观察肠管是否恢复活性的传统方法,ICG显影具有灵敏、高效的特点,术者无需额外时间等待。更重要的是,ICG显影为术中判断缺血再灌注损伤肠段提供了一种便捷的方法,术中部分缺血肠段虽然重新得到了血供,但可能已经出现了不可逆损伤。本研究中,缺血后再灌注的肠管能够恢复正常色泽,但真实血供已经不如周围正常肠段,因此ICG滞留在这些可能受损的肠段中。显然,缺血再灌注损伤模型直接显示了血供不良的肠管,这是术者凭借肉眼和经验无法判断的。滞留在肠段中的ICG显影强度或许预示了肠段受损的严重程度,但还需要进一步研究来确定显影强度、缺血与再灌注损伤时间之间的关系。总之,利用ICG显影或将在判断可能存在肠管缺血的急诊手术中发挥巨大作用。
ICG导致的不良反应少见,其在临床使用多年而不良反应发生率低于0.01%,且其分布迅速,是术中理想的诊断用染料药物[18]。利用NIR-ICG成像系统判断肠管缺血,特别是对荧光强度的实时分析,可以得到一个半定量的荧光数值,为术中判断肠管缺血程度提供了客观的指标。在本研究中,实验犬正常肠管的荧光强度在120 min之后与缺血再灌注损伤肠管的荧光强度会产生肉眼可见的分界线,或许可以根据再灌注损伤肠管和周围正常肠管之间荧光强度的差异来区分判断分界线。总之,作为一种前沿的术中成像诊断技术,NIR-ICG成像系统有望成为儿外科医师的“第六感”,提高精准外科手术的成功率。
| [1] |
Ishizawa T, Saiura A, Kokudo N. Clinical application of indocyanine green-fluorescence imaging during hepatectomy[J]. Hepatobiliary Surg Nutr, 2016, 5(4): 322-328. DOI:10.21037/hbsn.2015.10.01 |
| [2] |
Landsman ML, Kwant G, Mook GA, et al. Light-absorbing properties, stability, and spectral stabilization of indocyanine green[J]. J Appl Physiol, 1976, 40(4): 575-583. DOI:10.1152/jappl.1976.40.4.575 |
| [3] |
van Manen L, Handgraaf HJM, Diana M, et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery[J]. J Surg Oncol, 2018, 118(2): 283-300. DOI:10.1002/jso.25105 |
| [4] |
Egloff-Juras C, Bezdetnaya L, Dolivet G, et al. NIR fluorescence-guided tumor surgery: new strategies for the use of indocyanine green[J]. Int J Nanomedicine, 2019, 14: 7823-7838. DOI:10.2147/ijn.S207486 |
| [5] |
van der Vorst JR, Schaafsma BE, Verbeek FP, et al. Randomized comparison of near-infrared fluorescence imaging using indocyanine green and 99(m) technetium with or without patent blue for the sentinel lymph node procedure in breast cancer patients[J]. Ann Surg Oncol, 2012, 19(13): 4104-4111. DOI:10.1245/s10434-012-2466-4 |
| [6] |
Jia Y, Bailey ST, Hwang TS, et al. Quantitative optical coherence tomography angiography of vascular abnormalities in the living human eye[J]. Proc Natl Acad Sci USA, 2015, 112(18): E2395-E2402. DOI:10.1073/pnas.1500185112 |
| [7] |
Woitzik J, Horn P, Vajkoczy P, et al. Intraoperative control of extracranial-intracranial bypass patency by near-infrared indocyanine green videoangiography[J]. J Neurosurg, 2005, 102(4): 692-698. DOI:10.3171/jns.2005.102.4.0692 |
| [8] |
Ishizawa T, Tamura S, Masuda K, et al. Intraoperative fluorescent cholangiography using indocyanine green: a biliary road map for safe surgery[J]. J Am Coll Surg, 2009, 208(1): e1-e4. DOI:10.1016/j.jamcollsurg.2008.09.024 |
| [9] |
张鹏, 祝文, 方驰华, 等. 多模影像技术在解剖性肝切除手术导航中应用价值研究[J]. 中国实用外科杂志, 2019, 39(5): 480-486. Zhang P, Zhu W, Fang CH, et al. Application of multimode imaging technology in real-time navigation during anatomical liver resections[J]. Chin J Clin Pract Sur, 2019, 39(5): 480-486. DOI:10.19538/j.cjps.issn.1005-2208.2019.05.19 |
| [10] |
Nguyen QT, Tsien RY. Fluorescence-guided surgery with live molecular navigation: a new cutting edge[J]. Nat Rev Cancer, 2013, 13(9): 653-662. DOI:10.1038/nrc3566 |
| [11] |
Griffiths M, Chae MP, Rozen WM. Indocyanine green-based fluorescent angiography in breast reconstruction[J]. Gland Surg, 2016, 5(2): 133-149. DOI:10.3978/j.issn.2227-684X.2016.02.01 |
| [12] |
Aoki T, Yasuda D, Shimizu Y, et al. Image-guided liver mapping using fluorescence navigation system with indocyanine green for anatomical hepatic resection[J]. World J Surg, 2008, 32(8): 1763-1767. DOI:10.1007/s00268-008-9620-y |
| [13] |
Kawaguchi Y, Nomura Y, Nagai M, et al. Liver transection using indocyanine green fluorescence imaging and hepatic vein clamping[J]. Br J Surg, 2017, 104(7): 898-906. DOI:10.1002/bjs.10499 |
| [14] |
姚伟, 董岿然, 李凯, 等. 吲哚菁绿荧光显像技术在肝母细胞瘤精准切除手术中的应用[J]. 临床小儿外科杂志, 2019, 18(2): 107-111. Yao W, Dong KR, Li K, et al. Application of indocyanine green fluorescent imagine technique during precise hepatectomy for hepatoblastoma[J]. J Clin Ped Sur, 2019, 18(2): 107-111. DOI:10.3969/j.issn.1671-6353.2019.02.008 |
| [15] |
袁妙贤, 尹强, 季春宜, 等. 三维CT重建联合ICG荧光染色技术在腹腔镜先天性胆管扩张症根治术中的应用[J]. 临床小儿外科杂志, 2020, 19(7): 614-618. Yuan MX, Yin Q, Ji CY, et al. Application of three-dimensional computed tomography reconstruction plus indocyanine green fluorescent staining technique during radical laparoscopy for congenital biliary dilatation[J]. J Clin Ped Sur, 2020, 19(7): 614-618. DOI:10.3969/j.issn.1671-6353.2020.07.010 |
| [16] |
Rentea RM, Halleran DR, Ahmad H, et al. Preliminary use of indocyanine green fluorescence angiography and value in predicting the vascular supply of tissues needed to perform cloacal, anorectal malformation, and Hirschsprung reconstructions[J]. Eur J Pediatr Surg, 2020, 30(6): 505-511. DOI:10.1055/s-0039-1700548 |
| [17] |
Nachiappan S, Askari A, Currie A, et al. Intraoperative assessment of colorectal anastomotic integrity: a systematic review[J]. Surg Endosc, 2014, 28(9): 2513-2530. DOI:10.1007/s00464-014-3520-z |
| [18] |
Garski TR, Staller BJ, Hepner G, et al. Adverse reactions after administration of indocyanine green[J]. JAMA, 1978, 240(7): 635. DOI:10.1001/jama.240.7.635b |
 2021, Vol. 20
2021, Vol. 20


