肾盂输尿管连接部梗阻(ureteropelvic junction obstruction, UPJO)是指由于各种原因引起的肾盂与输尿管连接处狭窄,尿液引流不畅,继而导致患者出现各种症状、体征以及肾脏功能改变的先天性输尿管异常疾病。自Anderson等[1]首次提出离断式肾盂成形术以来,开放Anderson-Hynes离断式肾盂成形术一直被认为是治疗该病的标准术式。随着微创技术的发展,腹腔镜及机器人辅助腹腔镜肾盂成形术以其疼痛轻、创伤小、恢复快、美容效果好及成功率等于或优于开放手术等优点而被广泛应用,尤其在复杂性输尿管重建手术中,应用机器人辅助腹腔镜技术的优势更加明显[2-4]。可视化工具是辅助外科医生进行术中判断的重要手段。吲哚菁绿(indocyanine green, ICG)是目前使用最广泛的无辐射荧光造影剂, 近年来已在多个领域的外科手术治疗中显示出独特优势[5-7]。其波长为700~850 nm,可通过近红外线荧光显像,在外科手术中鉴别血供丰富和血供薄弱区域,从而为肿瘤界限或重建手术中组织瓣血供情况的判断等提供实时依据。本研究总结分析2017年10月至2019年8月中国人民解放军总医院第七医学中心附属八一儿童医院收治的36例肾积水患者临床资料。术中均应用静脉注射吲哚菁绿的区域血流荧光可视化成像输尿管显影技术,根据荧光显影血流灌注区域可视化成像结果,指导并优化机器人儿童肾盂成形术的手术策略。
材料与方法 一、临床资料2017年10月至2019年8月,本中心共收治复杂肾盂输尿管连接部梗阻患者36例。其中男29例,女7例,右侧22例,左侧14例。年龄3~126个月,中位年龄58个月。伴腹痛21例,伴泌尿系感染9例。初次狭窄8例,经肾盂成形术后再次狭窄28例。因肾盂成形术中静脉注射吲哚菁绿并非注射用吲哚菁绿的临床适应证,经医院伦理委员会审批同意后,患者家属术前均被告知操作风险并签署了书面同意书。患者均行机器人辅助腹腔镜肾盂成形术,其中肾盂翻瓣成型术18例,口腔黏膜代输尿管10例,阑尾代输尿管5例,回肠代输尿管3例。所有患者无泌尿系结石、膀胱输尿管狭窄或梗阻等其他合并症。
二、手术方法及术后处理患者全麻后先取健侧卧位,患侧腰背部垫高70°。达芬奇机器人系统床旁机械臂采用3臂,自脐窝置入8.5 cm套管作为镜头孔,于耻骨联合上缘与腹横纹交叉处置入一8 mm的1号机械臂,于剑突下置入5 mm的2号机械臂,于脐下机械臂操作通道患侧3 cm处置入1个5 mm辅助通道。各操作孔均用2 - 0慕丝线缝合固定。
手术步骤:①打开患侧结肠外侧腹膜,游离肾周脂肪及筋膜或粘连组织,充分显露肾下极及输尿管上段;②裁剪扩张的肾盂,吸尽积液,经腹壁穿一牵引线将肾盂上极悬吊牵引。然后切除狭窄段输尿管,并于输尿管外侧壁纵行剖开一段距离;③输尿管狭窄段≥5 cm者,裁剪肾盂并翻瓣,或截取阑尾、相应长度的回肠或口腔黏膜作为组织材料以替代输尿管;④确定肾盂最低点,并以雪橇针将肾盂最低点与输尿管劈开最低处或组织材料末端行点对点定位缝合,连续或间断缝合吻合口后壁,经吻合口顺行置入双J管,连续缝合吻合口前壁及多余的肾盂瓣开口;⑤注射吲哚菁绿,运用机器人系统集成的荧光实时显影技术,观察重建后组织的血运情况;⑥如血运良好,则关闭腹膜,吸尽积液,结束手术;如血运不理想则更换组织材料,重新自上述第③步继续手术。
术后常规留置尿管3~4 d,保持尿管通畅。术后6~8周拔除双J管,术后1个月、3个月、6个月、12个月分别复查泌尿系超声,术后6个月评估利尿性肾动态显像。术后并发症情况采用Clavien-Dindo分类标准进行分级。手术成功定义为术后临床症状解除,泌尿系超声检查提示肾盂分离前后径恢复正常,拔除双J管后利尿性肾动态显像提示梗阻解除。
结果本组36例均顺利完成手术,无一例中转开放手术或改变术式。手术时间65~150 min,平均(93.2±16.7)min。术中出血量10~50 mL,平均(26.8±8.3)mL。术后拔除引流管时间2~5 d,平均(3.7±1.3)d,术后住院时间4~9 d,平均(7.4±1.6)d。5例术后出现泌尿系感染(Clavien-Dindo Ⅱ级并发症),给予静脉滴注抗生素治疗后好转,无一例出现Clavien Ⅲ、Ⅳ级并发症。
随访时间4~26个月,平均(12.8±5.3)个月。所有患者术后症状消失,术后3~6个月复查超声及肾图检查,结果提示患肾功能不同程度恢复,无吻合口狭窄、再次梗阻、泌尿系感染等并发症。拔除引流管6个月后复查利尿性肾动态显像,结果显示患者梗阻均解除,继续随访观察。
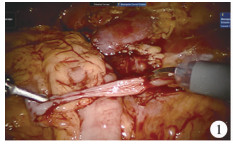
|
图 1 一例输尿管长段狭窄患者的术中情况 Fig.1 Intraoperative finding of a child with long ureteral stenosis |
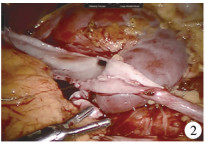
|
图 2 采用肾盂翻瓣技术进行输尿管吻合 Fig.2 Flap of renal pelvis |
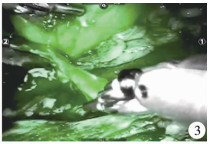
|
图 3 荧光显影技术显示肾盂翻瓣部分血运良好 Fig.3 Fine blood circulation of flap with fluorescent technique |
吲哚菁绿是一种水溶性的三碳菁染料,1955年由美国柯达公司研发并于1956年由美国FDA批准用于人类疾病诊断,其静脉注射后以与血清蛋白结合或游离两种形式在血液中运输,其中约98%与血清蛋白结合,主要与球蛋白和脂蛋白结合。肝脏从血流摄取ICG并通过谷胱甘肽S-转换酶代谢,较其他造影剂具有无辐射、高吸光度、低毒性、价格便宜等优势[8, 9]。游离ICG会被肝脏迅速从血管系统中清除,并通过蛋白谷胱甘肽S-转移酶转运到胆汁中代谢。而与血清蛋白结合的ICG可以在1 min内将荧光显示在整个血管系统中[10]。其不良反应发生率很低,药代动力学亦已得到充分的研究[11, 12]。近红外荧光成像技术是集成在达芬奇外科手术系统中的一套可以在术中实时对ICG进行显像的专利技术。ICG-NIRF成像技术在肿瘤切除术及外科各专科中均已得到广泛应用。该技术通过静脉注射ICG并利用NIRF频段进行术中实时显影,从而让外科医生确认肿瘤区域和正常组织的血流灌注情况;心脏外科和胃肠外科可利用ICG的NIRF成像技术来判断用于人体组织修复或流出道组织吻合后的部位是否存在局部缺血[13, 14]。
ICG-NIRF技术在泌尿外科手术也得到了一定应用[15]。虽然美国FDA至今未批准ICG在泌尿外科手术中常规应用,但自2006年起已有30余篇文献报道在临床研究中试验性使用ICG进行术中辅助判断。多数研究集中在肾移植手术及肾上腺、肾脏、膀胱、前列腺、腹膜后组织等器官组织恶性肿瘤的界限判断和分辨肿瘤的淋巴结转移范围等。
ICG在上尿路疾病修复性手术中的应用研究相对较少。Marc等[16]于2013年报道了ICG-NIRF技术在上尿路机器人辅助手术中的初步应用, 在其纳入的42例上尿路重建手术患者中,采用静脉注射ICG的方法来辅助判断组织血流灌注情况。Ziho等[17]于2014年报道了一组ICG-NIRF在机器人输尿管重建手术中的应用研究,其纳入的病例术式包括肾盂成形术、输尿管吻合术及膀胱输尿管再植术等。和先前研究不同,他们利用逆行置管将ICG直接灌注到肾盂及输尿管内,从而实现了辅助输尿管定位和精确判断狭窄段输尿管长度的目的。
本研究中,我们主要评估了ICG对于较为复杂的儿童肾盂输尿管连接部梗阻病例的临床应用价值。对于输尿管长段狭窄或手术后再次狭窄的患者,采用翻转肾盂瓣、口腔黏膜及阑尾或部分肠管等自身人体组织材料代替部分输尿管进行肾盂成形术。这些情况下,转移组织材料在镶嵌入输尿管后血供是否丰富,是其能否存活的关键。达芬奇机器人系统因其自身集成的NIRF显示模式,使得术中应用ICG实时荧光显影技术成为可能,术者可及时发现缺血的组织段,避免术后再次狭窄及再次手术的情况发生。我们认为通过静脉注射ICG而非在肾盂输尿管灌注ICG更符合我们的实验设计,在完成肾盂组织瓣转移并与输尿管后壁吻合后,即刻采用荧光实时显影技术观察吻合口血流情况,通过比对转移肾盂组织瓣与周围正常尿路组织间的荧光显影亮度变化来判断其血运情况。本研究首次报道较大样本量的ICG-NIRF技术在复杂儿童肾盂成形术中应用。在复杂肾盂输尿管连接部梗阻手术中,ICG-NIRF技术的可行性、安全性和有效性均得到了验证,其实时判断转移组织瓣血供的功能优势明显,能更好地指导术者手术方式的决策,帮助提高手术的成功率。
本研究的主要缺陷是荧光显影技术在临床应用经验尚浅,对于血供判断的时机及灌注程度主要依靠术者经验,缺乏相应的客观指标及远期随访带来的效果反馈。未来我们将继续对这批患者进行相应的随访。
| [1] |
The long-term results of Anderson-Hynes pyeloplasty-O'Reilly-2001-BJU International-Wiley Online Library[EB/OL]. [2020-01-09]. https://onlinelibrary.wiley.com/doi/full/10.1046/j.1464-410x.2001.00108.x.
|
| [2] |
徐哲, 谢钧韬, 高文宗, 等. 达芬奇机器人手术治疗小儿肾积水的初步经验[J]. 中华腔镜泌尿外科杂志(电子版), 2017, 11(3): 154-157. Xu Z, Xie JT, Gao WZ, et al. Initial experiences of treating pediatric hydronephrosis by Da vinci robotic surgery[J]. Chinese Journal of Endourology (Electronic Version), 2017, 11(3): 154-157. DOI:10.3877/cma.j.issn.1674-3253.2017.03.003 |
| [3] |
周骏, 梁朝朝, 方卫华, 等. 机器人辅助腹腔镜肾盂输尿管离断成形术的初步经验(附21例报告)[J]. 微创泌尿外科杂志, 2017, 6(1): 43-47. Zhou J, Liang CZ, Fang WH, et al. Robot-assisted laparoscopic pyeloplasty for treatment of ureteropelvic junction obstruction: a report of 21 cases[J]. Journal of Minimally Invasive Urology, 2017, 6(1): 43-47. DOI:10.19558/j.cnki.10-1020/r.2017.01.011 |
| [4] |
曹华林, 周辉霞, 马立飞, 等. 婴幼儿隐藏切口法机器人辅助腹腔镜肾盂输尿管成形术[J]. 微创泌尿外科杂志, 2017, 6(2): 74-77. Cao HL, Zhou HX, Ma LF, et al. Hidden incision robot-assisted pyeloplasty for infants and toddlers[J]. Journal of Minimally Invasive Urology, 2017, 6(2): 74-77. DOI:10.19558/j.cnki.10-1020/r.2017.02.003 |
| [5] |
Piwkowski C, Gabryel P, Gasiorowskia L, et al. Indocyanine green fluorescence in the assessment of the quality of the pedicled intercostal muscle flap: a pilot study[J]. Eur J Cardiothorac Surg, 2013, 44(1): 77-81. DOI:10.1093/ejcts/ezt102 |
| [6] |
Tobis S, Knopf J, Silvers C, et al. Near infrared fluorescence imaging with robotic assisted laparoscopic partial nephrectomy: initial clinical experience for renal cortical tumors[J]. Journal of Urology, 2011, 186(1): 47-52. DOI:10.1016/j.juro.2011.02.2701 |
| [7] |
Manny TB, Krane LS, Hemal AK. Indocyanine green cannot predict malignancy in partial nephrectomy: histopathologic correlation with fluorescence pattern in 100 patients[J]. J Endourol, 2013, 27(7): 918-921. DOI:10.1089/end.2012.0756 |
| [8] |
Baker KJ. Binding of sulfobromophthalein (BSP) sodium and indocyanine green (ICG) by plasma α1 lipoproteins[J]. Proc Soc Exp Biol Med, 1966, 122(4): 957-963. DOI:10.3181/00379727-122-31299 |
| [9] |
Desmettre T, Devoisselle JM, Mordon S. Fluorescence properties and metabolic features of indocyanine green (ICG) as related to angiography[J]. Surv Ophthalmol, 2000, 45(1): 15-27. DOI:10.1016/s0039-6257(00)00123-5 |
| [10] |
Tobis S, Knopf JK, Silvers CR, et al. Near infrared fluorescence imaging after intravenous indocyanine green: initial clinical experience with open partial nephrectomy for renal cortical tumors[J]. Urology, 2012, 79(4): 958-964. DOI:10.1016/j.urology.2011.10.016 |
| [11] |
Hope-Ross M, Yannuzzi LA, Gragoudas ES, et al. Adverse Reactions due to Indocyanine Green[J]. Ophthalmology, 1994, 101(3): 529-533. DOI:10.1016/s0161-6420(94)31303-0 |
| [12] |
Ott P, Bass L, Keiding S. The kinetics of continuously infused indocyanine green in the pig[J]. J Pharmacokinet Biopharm, 1996, 24(1): 19-44. DOI:10.1007/bf02353509 |
| [13] |
Pacheco PE, Hill SM, Henriques SM, et al. The novel use of intraoperative laser-induced fluorescence of indocyanine green tissue angiography for evaluation of the gastric conduit in esophageal reconstructive surgery[J]. Am J Surg, 2013, 205(3): 349-353. DOI:10.1016/j.amjsurg.2012.11.005 |
| [14] |
Kawamoto N, Anayama T, Okada H, et al. Indocyanine green fluorescence/thermography evaluation of intercostal muscle flap vascularization[J]. Thorac Cancer, 2018, 9(12): 1631-1637. DOI:10.1111/1759-7714.12871 |
| [15] |
Pathak RA, Hemal AK. Intraoperative ICG-fluorescence imaging for robotic-assisted urologic surgery: current status and review of literature[J]. Int Urol Nephrol, 2019, 51(5): 765-771. DOI:10.1007/s11255-019-02126-0 |
| [16] |
Bjurlin MA, Gan M, McClintock TR, et al. Near-infrared fluorescence imaging: emerging applications in robotic upper urinary tract surgery[J]. Eur Urol, 2014, 65(4): 793-801. DOI:10.1016/j.eururo.2013.09.023 |
| [17] |
Lee Z, Moore B, Giusto L, et al. Use of indocyanine green during robot-assisted ureteral reconstructions[J]. Eur Urol, 2015, 67(2): 291-298. DOI:10.1016/j.eururo.2014.08.057 |
 2021, Vol. 20
2021, Vol. 20


