肝母细胞瘤(hepatobalstoma, HB)是儿童最常见的肝脏恶性肿瘤,占5岁以下儿童原发性肝脏恶性肿瘤的90%以上[1, 2]。HB起病隐匿,早期多无症状,主要治疗方法包括化学疗法、手术切除和肝移植,总体存活率约80%[3]。手术切除肿瘤是肝母细胞瘤治疗的基础。无法手术切除或有残留病灶的患者预后相对较差[3, 4]。手术中主要通过超声检查、肉眼观察和组织触诊来确定肿瘤位置以及切除范围,在肿瘤边界的确定、肝内可疑转移灶的识别方面仍存在不足,容易造成漏检,从而影响患者预后[5]。
荧光染料吲哚氰绿(indo cyanine green,ICG)能够在肝肿瘤组织中特异性聚集,可被特定波长的光波照射后激发出荧光,通过光学影像设备成像形成光学影像,使肿瘤组织与正常组织形成强烈的荧光对比。ICG技术已被证实是非常敏感的肝癌术中病灶实时检测、显像的手段,有文献报道其已作为一种术中导航工具用于精准肝脏肿瘤外科手术,但在儿童肝母细胞瘤中的应用尚处于起步阶段,报道例数较少[6-8]。本研究旨在探索ICG介导的近红外荧光成像技术在儿童肝母细胞瘤识别及切缘界定中的应用,评估ICG近红外荧光成像引导肝母细胞瘤切除手术的潜力。
材料与方法 一、临床资料收集2019年12月至2021年5月由上海交通大学医学院附属新华医院收治的6例HB患者作为研究对象,所有患者在ICG导航下完成手术。收集患儿流行病学数据,包括性别、年龄、术前治疗情况及手术方式等;CT影像数据,包括PRETEXT分期、肿瘤大小等;术前吲哚菁绿注射时间和剂量;术后病理检查结果等。6例HB患者中,男5例,女1例,中位年龄1岁,年龄范围5个月至6岁。术前肝功能、凝血功能均无异常。5例均在术前接受2~3个疗程的新辅助化疗;1例在外院行手术治疗,术后接受了4个疗程化疗后发现肝内多发病灶。5例为单发肿瘤病灶,1例为多发肿瘤病灶(系术后化疗后肝内复发)。肿瘤分期:2例为PRETEXT Ⅱ期,3例为PRETEXT Ⅲ期,1例为PRETEXT Ⅳ期。6例均无远处转移。使用术前计算机断层扫描(CT)图像(最小切片间隔:0.5 mm)测量肿瘤最大径和距肝表面的肿瘤深度,肿瘤直径1~10 cm,肿瘤距离肝脏包膜距离0~15 mm。6例患儿术中均使用ICG近红外荧光成像系统进行肿瘤病灶定位。5例行右肝肿瘤解剖性切除术,1例肝内多发、复发肿瘤患者行不规则肝肿瘤切除术。
研究入组患儿监护人均签署知情同意书,同意将其在本院诊治期间或以后的病程中与健康相关的信息应用于将来的研究。本院伦理委员会评估了本研究的设计与执行过程,符合医学伦理规范准则。
二、ICG注射方法及手术过程ICG注射剂为粉剂,单支剂量25 mg,配套灭菌注射用水10 mL。用配套灭菌注射用水溶解ICG粉剂后,按0.5 mg/kg剂量于术前45~72 h静脉注射,注射前无需皮试。术中使用10 mm内窥镜ICG近红外荧光成像系统(欧谱曼迪OPTO-CAM2100,激发光805 nm,反馈荧光成像835 nm)观察荧光反射情况,摄像头距离观察部位10~20 cm。该系统的摄像头单元通过监视器可以可视化肉眼不可见的近红外光线。6例ICG摄像头系统下观察到可疑荧光病灶,5例显示出强烈的荧光(图 1A, 1B, 1D),1例显示荧光强度稍弱。肿瘤切除后,使用ICG摄像机检查手术标本和切除部位是否存在荧光反射。对所有切除标本及手术切缘进行病理检查,以明确肝母细胞瘤的诊断及手术切缘情况。
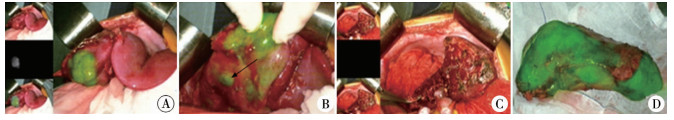
|
图 1 ICG术中成像图 Fig.1 ICG intraoperative fluorescence imaging 注 A: 肝母细胞瘤病灶ICG荧光显像; B: 肝母细胞瘤肝内转移病灶ICG荧光显像; C: 肿瘤切缘处无ICG荧光显像; D: 切除标本ICG荧光显像 A.Imaging of hepatoblastoma lesions; B.Imaging of intrahepatic metastases of hepatoblastoma; C.No imaging at the tumor margin; D.Imaging of excised lesions |
所有患者对0.5 mg/kg的吲哚菁绿注射剂耐受良好,无恶心、发烧、休克等与ICG注射相关不良事件。平均手术时间(150±31)min。术中所有患者获得荧光显像,在伪彩模式下,注射间隔时间在60 h以内的患者荧光强度强于60 h以后注射的患者,注射ICG 72 h后荧光显示强度最弱。肿瘤切除后肝脏切缘面未检测到荧光(图 1C),病理检查结果显示切缘为阴性。病理检查结果提示:上皮型HB 5例,混合型HB 1例。6例患者临床资料、结果见表 1。
| 表 1 应用ICG术中导航显像病例的一般资料、使用方法、术中显示情况、病理类型及并发症情况 Table 1 Basic profile, application approach, intraoperative imaging, pathological classification and complication of patients undergoing navigation surgery with ICG fluorescent imaging |
|
|
术前影像学检查提示6例肝脏肿瘤中位直径为7.5 cm(范围1~10 cm),肿瘤距离最近肝脏包膜的中位距离为5 mm(范围0~15 mm)。术中所有患者获得ICG荧光显像,病变组织与正常肝组织荧光显像分界清晰,显像范围与术前影像学检查一致。5例根据术前影像学检查和术中ICG荧光显像导航行解剖性肝段切除术,肿瘤切除后复测切缘ICG荧光均为阴性,与术后病理检查切缘结果一致。
三、肝内转移灶界定1例患者为右半肝切除术后肝内多发复发转移病灶,病灶距离肝包膜0~15 mm,直径1~2.7 cm,病灶在术中ICG荧光显像导航系统中均获得良好显示,根据荧光范围切除病灶,但术后1个月复查CT发现肝内残余1处肿瘤病灶。
讨论吲哚氰绿是临床最成熟、应用最广的非特异性近红外荧光探针,也是食品药品监督管理局(Food and Drug Administration, FDA)认证唯一可用于临床的荧光探针。ICG由静脉注入体内后,立刻和血浆蛋白结合,随血液循环迅速分布到全身血管内,被肝细胞选择性高效率摄取,以游离形式排泄到胆汁中,经胆道入肠,随粪便排出体外。ICG不参与体内化学反应,无肠肝循环(进入肠管的ICG不再吸收入血),无淋巴逆流,也不从肾脏等其它肝外脏器排泄,毒性小,是一种非常安全的药物[9]。目前ICG成像主要应用于视网膜血管造影和肝脏功能测定,也用于多种成人肿瘤的术中实时显像[7];具有可以活体成像,操作简单,无放射性损伤的优点[8, 10]。
ICG的注射剂量和给药时机对获得理想的成像效果至关重要。肿瘤细胞和肝细胞都可吸收ICG,但排出时间不同。如果注射ICG和手术时间间隔过短,正常肝组织不能充分排出ICG,可出现弥漫性的假阳性显影。在成人肝细胞癌中,多数文献建议在肝肿瘤手术之前2~3 d给予ICG注射,以减少正常肝脏组织的背景荧光,获得理想的病灶与肝脏的荧光对比。成人肝癌手术推荐ICG注射安全剂量为0.5 mg/kg,已有文献报道儿童肝母细胞瘤也采用此剂量[8, 11, 12]。本组病例于手术前45~72 h注射ICG,均获得较好的荧光显像,但成像荧光强度、对比度不一。注射ICG 72 h后荧光显示强度最弱。这可能是因为成人肝癌的数据显示ICG显像效果与肝脏功能的好坏有关。而儿童HB患者肝功能多正常,且儿童和成人肝脏储备功能、代谢能力可能存在不同, 这就导致适合成人的ICG注射剂量可能不能在儿童肝母细胞瘤中获得最理想的显像效果。也有文献对肝母细胞瘤患者ICG注射剂量和时间进行了初步的改变尝试[13]。但制定适合儿童HB的ICG剂量和注射时机还有待进一步大样本的研究和验证。
在不同分化程度的肝细胞癌组织中,ICG的近红外荧光显像强度是不同的。分化良好的肝细胞癌组织在切面上表现出强烈的荧光,而对于分化较差的肝细胞癌组织则相反。有文献认为,这是因为分化良好的肝细胞癌组织吸收ICG,但是肿瘤组织形态或功能异常,ICG的胆汁排泄受到损害,导致ICG在肿瘤组织内聚集。相反,低分化的肝癌和转移性肝癌不吸收ICG,导致成像呈低荧光强度[11, 14]。本组病例中ICG在HB组织的原发灶和肝内转移灶均表现为强烈荧光,和肿瘤的病理类型无关,与文献报道一致[15, 16]。肿瘤切除后,观察切缘是否有荧光发出,可以协助判断切缘是否干净。本组病例中ICG在切缘无荧光显像,与术中冷冻病理报告切缘阴性的结果相符合。已有文献报道使用ICG术中实时荧光成像可发现下腔静脉周围的残留HB肿瘤[15, 16]。故ICG术中近红外荧光成像可以用于确认切缘是否存在残留肿瘤。
有文献报道,ICG术中荧光成像可检测出直径1 mm以下的肝母细胞瘤肺部转移肿瘤,但即使切除所有显像的病灶,术后不久肺部又出现了复发性肿瘤[17]。这说明ICG近红外荧光成像对微小肿瘤病灶的检测尚存在局限性。本组病例数较少,肿瘤直径较大,无法判断出ICG近红外荧光成像可以检测到最小直径为多少的HB肿瘤病灶。此外,ICG近红外荧光成像对较深(>10 mm)肝肿瘤结节的灵敏度较低,这与近红外荧光的物理特性相关,ICG发射的荧光组织穿透仅约10 mm,无法看到位于肝脏深处的肿瘤[6]。本研究中,1例肝内多发转移病灶的患者根据荧光显像导航切除病灶,术后1个月复查CT发现肝内残余病灶。这提示针对肝内多发病灶的ICG导航肿瘤切除术可能会遗漏微小肿瘤病灶。
总之,ICG术中近红外荧光成像在判断HB肿瘤切缘,辅助确认肝内转移病灶方面,具有一定的价值。ICG注射的合适时机以及对肿瘤检测的敏感性,还有待通过更多病例的经验积累来进一步的研究和阐明。
| [1] |
Ranganathan S, Lopez-Terrada D, Alaggio R. Hepatoblastoma and Pediatric Hepatocellular Carcinoma: An Update[J]. Pediatr Dev Pathol, 2020, 23(2): 79-95. DOI:10.1177/1093526619875228 |
| [2] |
Meyers R, Hiyama E, Czauderna P, et al. Liver Tumors in Pediatric Patients[J]. Surg Oncol Clin N Am, 2021, 30(2): 253-274. DOI:10.1016/j.soc.2020.11.006 |
| [3] |
袁晓军. 儿童肝母细胞瘤多学科诊疗专家共识(CCCG-HB-2016)[J]. 中华小儿外科杂志, 2017, 38(10): 733-739. Yuan XJ. Expert Consensus for Multidisciplinary Management of Hepatoblastoma(CCCG-HB-2016)[J]. Chin J Pediatr Surg, 2017, 38(10): 733-739. DOI:10.3760/cma.j.issn.0253-3006.2017.10.003 |
| [4] |
陈芝雪, 董瑞. 肝母细胞瘤多学科治疗方案的研究进展[J]. 临床小儿外科杂志, 2020, 19(5): 398-403. Chen ZX, Dong R. Advances in the treatment of hepatoblastoma[J]. J Clin Ped Sur, 2020, 19(5): 398-403. DOI:10.3969/j.issn.1671-6353.2020.05.005 |
| [5] |
Handgraaf HJM, Boogerd LSF, Höppener DJ, et al. Long-term follow-up after near-infrared fluorescence-guided resection of colorectal liver metastases: A retrospective multicenter analysis[J]. Eur J Surg Oncol, 2017, 43(8): 1463-1471. DOI:10.1016/j.ejso.2017.04.016 |
| [6] |
Purich K, Dang JT, Poonja A, et al. Intraoperative fluorescence imaging with indocyanine green in hepatic resection for malignancy: a systematic review and meta-analysis of diagnostic test accuracy studies[J]. Surg Endosc, 2020, 34(7): 2891-2903. DOI:10.1007/s00464-020-07543-2 |
| [7] |
Reinhart MB, Huntington CR, Blair LJ, et al. Indocyanine Green: Historical Context, Current Applications, and Future Considerations[J]. Surg Innov, 2016, 23(2): 166-175. DOI:10.1177/1553350615604053 |
| [8] |
姚伟, 董岿然, 李凯, 等. 吲哚菁绿荧光显像技术在肝母细胞瘤精准切除手术中的应用[J]. 临床小儿外科杂志, 2019, 18(2): 107-111. Yao W, Dong KR, Li K, et al. Application of indocyanine green fluorescence imagine technique in precise hepatectomy for hepatoblastoma[J]. J Clin Ped Sur, 2019, 18(2): 107-111. DOI:10.3969/j.issn.1671-6353.2019.02.008 |
| [9] |
Egloff-Juras C, Bezdetnaya L, Dolivet G, et al. NIR fluorescence-guided tumor surgery: new strategies for the use of indocyanine green[J]. Int J Nanomedicine, 2019, 14: 7823-7838. DOI:10.2147/IJN.S207486 |
| [10] |
Paraboschi I, De Coppi P, Stoyanov D, et al. Fluorescence imaging in pediatric surgery: State-of-the-art and future perspectives[J]. J Pediatr Surg, 2021, 56(4): 655-662. DOI:10.1016/j.jpedsurg.2020.08.004 |
| [11] |
Nakaseko Y, Ishizawa T, Saiura A. Fluorescence-guided surgery for liver tumors[J]. J Surg Oncol, 2018, 118(2): 324-331. DOI:10.1002/jso.25128 |
| [12] |
Ishizawa T, Saiura A, Kokudo N. Clinical application of indocyanine green-fluorescence imaging during hepatectomy[J]. Hepatobiliary Surg Nutr, 2016, 5(4): 322-328. DOI:10.21037/hbsn.2015.10.01 |
| [13] |
Yamada Y, Ohno M, Fujino A, et al. Fluorescence-Guided Surgery for Hepatoblastoma with Indocyanine Green[J]. Cancers (Basel), 2019, 11(8): 1215. DOI:10.3390/cancers11081215 |
| [14] |
方驰华, 梁洪玻, 迟崇巍, 等. 吲哚氰绿介导的近红外光技术在微小肝脏肿瘤识别、切缘界定和精准手术导航的应用[J]. 中华外科杂志, 2016, 54(6): 444-450. Fang CH, Liang HB, Chi CW, et al. Application of indocyanine green-fluorescent imaging technique in planning resection line and real-time surgical navigation in small hepatocellular carcinoma[J]. Chin J Surg, 2016, 54(6): 444-450. DOI:10.3760/cma.j.issn.0529-5815.2016.06.011 |
| [15] |
Yamamichi T, Oue T, Yonekura T, et al. Clinical application of indocyanine green (ICG) fluorescent imaging of hepatoblastoma[J]. J Pediatr Surg, 2015, 50(5): 833-836. DOI:10.1016/j.jpedsurg.2015.01.014 |
| [16] |
Souzaki R, Kawakubo N, Matsuura T, et al. Navigation surgery using indocyanine green fluorescent imaging for hepatoblastoma patients[J]. Pediatr Surg Int, 2019, 35(5): 551-557. DOI:10.1007/s00383-019-04458-5 |
| [17] |
Kitagawa N, Shinkai M, Mochizuki K, et al. Navigation using indocyanine green fluorescence imaging for hepatoblastoma pulmonary metastases surgery[J]. Pediatr Surg Int, 2015, 31(4): 407-411. DOI:10.1007/s00383-015-3679-y |
 2021, Vol. 20
2021, Vol. 20


