2. 上海交通大学医学院附属新华医院小儿急危重症医学科(上海市, 200092);
3. 上海交通大学医学院附属新华医院儿童心脏中心(上海市, 200092)
2. Pediatric Intensive Care Unit, Affiliated Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China;
3. Department of Pediatric Cardiology, Affiliated Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China
先天性膈疝(congenital diaphragmatic hernia, CDH)是一种先天性膈肌缺损。CDH患者的腹腔器官通过缺损膈肌疝入胸腔,从而导致一系列病理生理变化。活产儿中CDH发病率约为2.6/10 000[1]。虽然近年来对CDH管理的进步改善了其预后,但在过去十年间,CDH总体存活率一直维持在70% ~80%之间[2, 3]。
目前CDH的超声产前总检出率约为70%,且产前诊断的CDH通常与较差的预后相关[4]。在所有类型的CDH中,右侧CDH(right CDH, RCDH)较为少见,发病率约占所有CDH的13%[5]。目前对于RCDH的研究较少,尤其在产前诊断方面的研究较为有限。CDH患者的心脏和纵膈通常受到不同程度的压迫和移位影响,既往研究发现左侧CDH(left CDH,LCDH)患者左心室内径偏小,可能为心脏受到腹部突出器官的压迫所致[6, 7]。但对于RCDH患者心脏和血管结构的研究较少,且疝侧是否影响CDH患者心脏结构仍然存在争议。本研究旨在对产前诊断为LCDH、RCDH患者的临床特征和胎儿心脏结构进行对比分析。
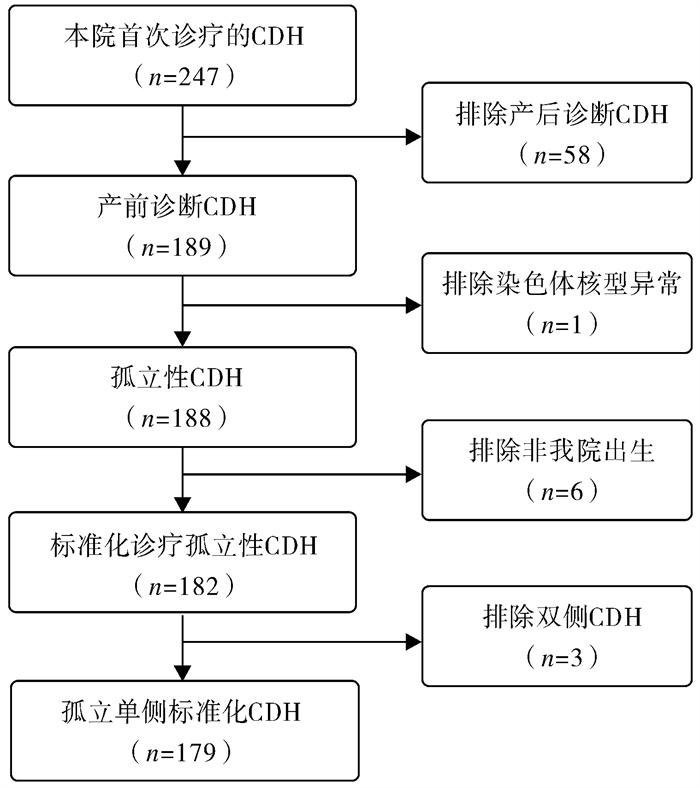
材料与方法 一、研究对象以2009年4月至2019年12月上海交通大学医学院附属新华医院小儿外科收治的产前诊断为先天性膈疝的179例患者为研究对象。纳入标准:①产前通过影像学检查明确诊断为胎儿膈疝;②患者母亲产前行规律产检;③于本院出生的活产儿;④患者出生后于本院儿外科住院治疗;⑤单侧膈疝。排除标准:①未于本院出生;②产后未于本院儿外科进行首次住院治疗;③产前检查发现合并染色体异常;④患者母亲流产或终止妊娠。
2009年4月至2019年12月期间,共有247例CDH患者于本院接受首次诊疗。排除产后诊断58例,合并染色体异常1例(NIPT9号染色体数目偏多),外院分娩6例(外院行首次手术3例,本院行首次手术3例),双侧膈疝3例,共有179例患者符合纳入标准并纳入分析(图 1)。
|
图 1 研究对象纳入流程图 Fig.1 Flow chart of research object inclusion |
收集的产前资料包括患者母亲怀孕时年龄、患者首次诊断CDH时的孕周大小、产前超声检查指标[包括CDH疝侧、肺头比(lung head ratio, LHR)、肝脏位置、胃泡位置、是否合并单脐动脉或右脐静脉];收集患者及其母亲的产时临床特征,包括分娩方式、分娩孕周、是否为早产儿、出生体重、1分钟Apgar评分、5分钟Apgar评分、血气分析指标(包括出生后1 h内pH值和PaCO2值);收集其中于本院行膈肌修补术患者的手术相关参数资料,包括手术方式(胸腔镜或开腹膈肌修补术)、有无疝囊、膈肌缺损等级,根据膈肌缺损大小决定是否应用补片修补。同时收集其中存活患者的住院时长、术后住院时间、呼吸机使用天数、吸氧时间。
LHR均由本院有经验的超声医生进行测量,具体方法为追踪测量法[8];另外根据缺损位置(左侧或右侧),用Jane法[9]在计算平台(网址:https://www.perinatology.com)上计算观察/预期肺头比(observed-to-expected lung-to-head ratio, O/E LHR)。根据患者手术记录中的膈肌缺损范围及残余膈肌分布情况,参照Lally膈肌缺损大小分类标准[2],将膈肌缺损大小由小到大分为A、B、C、D四型[A型缺损完全被周围的膈肌包绕,B型缺损周围有一小部分(< 50%)没有横膈组织的胸壁,C型缺损周围有一大部分(>50%)没有横膈组织的胸壁,D型患者完全或几乎完全没有横膈组织]。
(二) 单中心“产前- 产时- 产后”程序化多学科综合诊疗模式本研究中的CDH患者及其母亲均参与本院“产前- 产时- 产后”程序化多学科综合诊疗模式,即孕妇携产前相关资料于本院儿外科门诊就诊并参与多学科会诊,进一步临床诊断为胎儿膈疝,并于孕期行规律产检。所有诊断为CDH的新生儿于本院分娩后立即在产房插管并放入鼻胃管,随后转移至儿外科重症监护室,所有婴儿初期进行温和通气(允许一定的高碳酸血症)、有创血压测量和动脉血氧饱和度连续监测,必要时使用高频振荡通气。有循环功能障碍者根据需要使用正性肌力药或升压药(如多巴胺、多巴酚丁胺和肾上腺素),并在血流动力学稳定后接受外科修复[10, 11]。
本研究机构采取经腹膈肌修补术和胸腔镜下膈肌修补术,手术方式的选择需要综合考虑患者出生后的各项指标、临床表现以及对各项治疗的反应性等因素。胸腔镜手术的主要适应证包括:①左侧膈疝;②肝脏未疝入胸腔;③体重>2.0 g;④呼吸、循环功能状态相对稳定;⑤未合并严重心脏畸形。手术的目的是通过一期修补闭合膈肌缺损,对于膈肌缺损较大的严重病例使用补片修复。
(三) 胎儿心脏超声CDH患者的超声心动图测量均由接受过专业培训的儿科心脏病专家进行。使用标准化解剖平面,并结合脉冲、彩色和功率多普勒成像,经腹部途径,按照美国超声心动图学会和美国医学会现有的指南进行[12, 13]。多普勒超声设备为GE Voluson E8,探头频率2.0~5.0 MHz;GE Vivid E9,探头频率1.6~4.5 MHz(通用电气公司)。
按膈肌缺损的位置分为LCDH组和RCDH组,对产前预后指标、产科和新生儿临床结果、手术相关参数、临床结局以及产前胎儿超声心动图中心脏结构参数进行组间对比。
使用基于现有标准数据的Z-score评分系统求得LVd(left ventricle diameter, 左心室内径)、RVd(right ventricle diameter, 右心室内径)、Aod(aortic diameter, 主动脉内径)、MPAd(main pulmonary artery diameter, 肺动脉内径)、LPAd(left pulmonary artery diameter, 左肺动脉内径)、RPAd(right pulmonary artery diameter, 右肺动脉内径)的Z-score[14]。
三、统计学方法采用SPSS 19.0进行统计学分析,诊断孕周等服从正态分布的计量资料采用(x ±s)表示;两组间比较先进行正态性检验,若两组数据均符合正态分布则采用独立样本t检验,若至少一组数据不符合正态分布则采用秩和检验。手术方式等计数资料采用频数分析,两组间比较采用χ2检验,根据样本量及最小期望计数选择卡方检验校正或Fisher精确概率法,P<0.05为差异有统计学意义。
结果 一、一般情况179例中,LCDH组139例(77.7%),RCDH组40例(22.3%);男98例(55.3%),女80例(44.7%);存活123例,总体存活率为68.7%。LCDH组死亡38例(27.3%),RCDH组死亡18例(45.0%);179例中25例术前因呼吸、循环衰竭未行手术死亡(14.0%)。154例行膈肌修补术(86.0%),其中胸腔镜手术77例(50.0%),开腹手术77例(50.0%)。
二、两组主要临床特征及临床结局对比两组诊断孕周和O/E LHR差异均无统计学意义(P>0.05)。RCDH组患者母亲的分娩孕周较LCDH组患者小[(38.66±1.39)vs.(37.89±1.94),P=0.024],早产发生率更高(32.5% vs.7.2%,P < 0.001)。分析患者出生时情况发现,RCDH组生后1 h内pH值较LCDH组患者低,生后1 h内PaCO2值更高,差异有统计学意义(P < 0.05)。而两组在出生体重、分娩方式、1分钟Apgar评分、5分钟Apgar评分差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组患者产前指标、产时新生儿临床结果比较 Table 1 Comparison of prenatal parameters and neonatal outcomes in two groups |
|
|
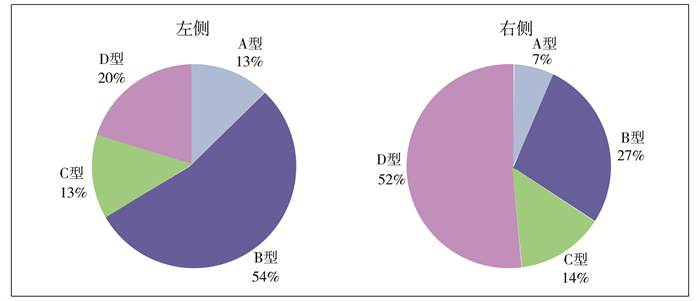
153例行膈肌修补术的患者中,RCDH组患者均行开腹手术,LCDH组腔镜手术率大于RCDH组(61.3% vs.0%,P<0.001),RCDH组的疝囊发生率更大(58.6% vs.33.1%,P=0.011)。而在术中是否应用补片方面,两组间差异无统计学意义(P>0.05)。在膈肌缺损方面,左侧组中B型缺损占比最多,右侧组中D型缺损占比最多(图 2),两组在各缺损类型占比方面的差异有统计学意义(P=0.007)。见表 2。
|
图 2 左侧、右侧CDH膈肌缺损等级分布 Fig.2 Grade distribution of diaphragm defect in left/right CDH |
| 表 2 两组患者手术相关参数比较 Table 2 Comparison of operation-related parameters between two groups |
|
|
179例患者中,LCDH组存活率明显大于RCDH组(72.7% vs.55.0%,P=0.034),两组在是否合并心脏畸形、呼吸机使用时间、吸氧时间、住院时间上的差异均无统计学意义(P>0.05),见表 3。
| 表 3 两组患者临床结局比较 Table 3 Comparison of clinical outcomes of two groups |
|
|
40例产前行超声心动图的胎儿中,发现6例心脏畸形,3例室间隔缺损,1例肺动脉闭锁合并室间隔缺损,1例右室双出口合并主动脉骑跨,1例室间隔缺损合并主动脉骑跨,均为LCDH组患者。两者产前发现合并心脏畸形人数的比例差异无统计学意义(6/33 vs.0/7,χ2=0.411,P=0.522)。排除此6例心脏畸形CDH患者,表 4显示了其余34例行产前超声心动图检查的孤立性CDH患者心脏结构参数,相较于RCDH组患者而言,LCDH组患者的LVd z-score更小(P=0.009)、RVd/LVd值更大(P=0.015),RCDH组的Aod z-score更小(P=0.030)。而在心胸比、RVd z-score、MPAd z-score、LPA z-score、RPA z-score以及MPAd/Aod方面,两组间差异无统计学意义(P>0.05),见表 4。对LCDH组患者按肝脏是否疝入胸腔进行再次分组,发现肝脏疝入组的RV/LV值大于非肝疝入组(P=0.027),见表 5。
| 表 4 两组产前超声心动图心脏结构参数比较(x±s) Table 4 Comparison of cardiac structural echocardiographic data of two groups (x±s) |
|
|
| 表 5 两组产前超声心动图示左室标准化内径与右室标准化内径比较(x±s) Table 5 Comparison of left ventricle diameter z-score and right ventricle diameter z-score of prenatal echocardiographic data for two groups(x±s) |
|
|
LCDH组患者的LPAd z-score明显小于RPAd z-score([(-3.06±1.61)vs.(-2.40±1.43),P=0.041],而RCDH组患者中,上述两项指标差异无统计学意义(表 6)
| 表 6 两组产前超声心动图示左肺动脉标准化内径与右肺动脉标准化内径比较(x±s) Table 6 Comparison of left pulmonary artery diameter and right pulmonary artery diameter of prenatal echocardiographic data for two groups(x±s) |
|
|
既往的一些研究已经评估了部分可用于产前预测新生儿生存情况的参数的临床价值。Partridge等[15]回顾了单中心274例LCDH患者和56例RCDH患者的临床资料,发现两组总体存活率、ECMO需求率以及住院时间方面均无差异。本研究回顾性分析了179例在我院“产前- 产时- 产后”程序化多学科综合诊疗模式下诊疗的CDH患者资料,发现产前诊断为RCDH的患者早产发生率更高,产时情况更危重且存活率更低,而既往研究报道入院后首次血气分析值可有效预测CDH患者的预后,这提示对于产前诊断为RCDH的患者,围产期需要更严密的监护和更积极的抢救措施[16]。
据统计,仅有不到25%的RCDH在出生后首次被发现[15],RCDH的产前诊断可能比LCDH更加困难,这是因为肝脏可能会阻止肠管等空腔脏器疝入胸腔。既往的一些病例报告发现,脐静脉的位置对识别肝脏疝入是有用的,Botash等[17]描述了RCDH的这一特征,在彩色多普勒成像上可以看到血管从右上腹的肝右叶延伸至右侧胸腔内的回声肿块,提示RCDH。有研究发现,几乎所有的RCDH患者脐静脉位置均存在异常[18],意识到这一点可能会促使超声科医师在其他体征不能被识别的情况下考虑对某些RCDH的诊断。
二、膈肌缺损与手术方式的关系作为肺发育不良、胸腔受压严重程度的标志,CDH的膈肌缺损大小与存活率、补片修复需求和其他并发症显著相关[19]。值得注意的是,本研究发现产前诊断为RCDH的患者膈肌缺损相对较大,这可能是导致其临床结局较LCDH患者差的原因。因RCDH患者肝疝入比例较高,对于这部分患者,本研究机构均采用经腹开放膈肌修补的手术方式。对于一些膈肌缺损较大、无法直接缝合的情况,在LCDH患者中有时也可使用转移肌瓣进行修补,但在RCDH患者中,均需使用人工补片进行无张力修补。
三、不同疝侧对心室大小和肺动脉内径的影响目前关于CDH患者心脏结构和功能的研究较少。先前研究表明,出生前左心结构通常受腹部突出器官的压迫,而只有当缺损位于左侧时,才能看到对左心的额外压迫效应,重度LCDH患者的二尖瓣环直径、主动脉瓣环直径和左心室内径较轻度LCDH患者小[20]。本研究对34例通过产前发现的CDH患者进行超声心动图评估后发现,LCDH的LVd z-score更小,RVd/LVd更大,这与既往研究结果相符。在正常胎儿中,静脉导管血流优先流经卵圆孔,为左心提供约2/3的充盈量,这种左心血流之所以成为可能,是因为静脉导管进入下腔静脉的入口与肝左静脉和肝中静脉紧密相连,且卵圆孔的入口通常位于下腔静脉的左上方[21]。有研究观察到,这种错综复杂的排列可能在一些左侧心血管结构发育不全的胎儿中缺失,取而代之的是静脉导管优先流向心脏右侧[22]。对于患有LCDH的胎儿来说,这种异常的血流方向可能是由于胸腔内肝脏疝入导致心下静脉扭曲,静脉导管优先流向心脏右侧,减少了从右向左的心内分流,加上肺发育不良导致肺静脉左心回流减少。本研究进一步比较了LCDH患者中肝脏疝入对心脏大小的影响,发现肝脏疝入组的RVd/LVd值更小,可为LCDH的左侧心血管结构发育不良提供了进一步的血流动力学解释。
有研究发现,产前肺动脉直径的测量不能预测肺动脉高压,但可能有助于预测围产儿的死亡,解释孤立性CDH的病理生理机制很有意义,且测量肺动脉直径可能比估算胎儿肺体积或胎儿肺血管指数更容易和更具重复性。有研究发现8例终止妊娠的CDH患者肺动脉的直径与尸检测得的同侧肺重量存在很强的相关性(r=0.87)。同侧和对侧肺动脉生长的差异性也可能与疝入脏器的数量、类型有关,如果在产前成像时肠管疝入有更明显的突出,肺体积的测量可能会出现假性减少。在本研究中,我们观察到LCDH患者的同侧肺动脉标准化内径明显小于对侧。除了O/E LHR等产前肺组织形态学工具外,这可能是产前功能学指标的新研究思路。
本研究的局限主要是进行产前胎儿超声心动图检查的患者人数较少,缺乏相关检查数据。尽管心脏体积显著减小,但这种心室变小的功能影响是值得怀疑的,所以需要更多分析胎儿心功能方面的参数。
综上所述,产前诊断为RCDH的患者早产发生率较LCDH患者高,产时情况更危急,其围产期需要更密切的监测以及更积极的抢救措施;而在LCDH患者中,左心结构较RCDH患者更小,肝脏疝入对左心结构可能有影响。
| [1] |
Politis MD, Bermejo-Sánchez E, Canfield MA, et al. Prevalence and mortality in children with congenital diaphragmatic hernia: a multicountry study[J]. Ann Epidemiol, 2021, 56: 61-69.e3. DOI:10.1016/j.annepidem.2020.11.007 |
| [2] |
Lally KP, Lasky RE, Lally PA, et al. Standardized reporting for congenital diaphragmatic hernia-an international consensus[J]. J Pediatr Surg, 2013, 48(12): 2408-2415. DOI:10.1016/j.jpedsurg.2013.08.014 |
| [3] |
Wynn J, Krishnan U, Aspelund G, et al. Outcomes of congenital diaphragmatic hernia in the modern era of management[J]. J Pediatr, 2013, 163(1): 114-119.e111. DOI:10.1016/j.jpeds.2012.12.036 |
| [4] |
Burgos CM, Frenckner B, Luco M, et al. Prenatally versus postnatally diagnosed congenital diaphragmatic hernia-Side, stage, and outcome[J]. J Pediatr Surg, 2019, 54(4): 651-655. DOI:10.1016/j.jpedsurg.2018.04.008 |
| [5] |
Sperling JD, Sparks TN, Berger VK, et al. prenatal diagnosis of congenital diaphragmatic hernia: does laterality predict perinatal outcomes?[J]. Am J Perinatol, 2018, 35(10): 919-924. DOI:10.1055/s-0037-1617754 |
| [6] |
DeKoninck P, Richter J, Van Mieghem T, et al. Cardiac assessment in fetuses with right-sided congenital diaphragmatic hernia: case-control study[J]. Ultrasound Obstet Gynecol, 2014, 43(4): 432-436. DOI:10.1002/uog.12561 |
| [7] |
Vogel M, McElhinney DB, Marcus E, et al. Significance and outcome of left heart hypoplasia in fetal congenital diaphragmatic hernia[J]. Ultrasound Obstet Gynecol, 2010, 35(3): 310-317. DOI:10.1002/uog.7497 |
| [8] |
Ruano R, Martinovic J, Dommergues M, et al. Accuracy of fetal lung volume assessed by three-dimensional sonography[J]. Ultrasound Obstet Gynecol, 2005, 26(7): 725-730. DOI:10.1002/uog.2624 |
| [9] |
Jani JC, Peralta CF, Nicolaides KH. Lung-to-head ratio: a need to unify the technique[J]. Ultrasound Obstet Gynecol, 2012, 39(1): 2-6. DOI:10.1002/uog.11065 |
| [10] |
Wang W, Pan W, Chen J, et al. Outcomes of congenital diaphragmatic hernia in one of the twins[J]. Am J Perinatol, 2019, 36(12): 1304-1309. DOI:10.1055/s-0038-1676830 |
| [11] |
Snoek KG, Reiss IK, Greenough A, et al. Standardized Postnatal Management of Infants with Congenital Diaphragmatic Hernia in Europe: The CDH EURO Consortium Consensus-2015 Update[J]. Neonatology, 2016, 110(1): 66-74. DOI:10.1159/000444210 |
| [12] |
Rychik J, Ayres N, Cuneo B, et al. American Society of Echocardiography guidelines and standards for performance of the fetal echocardiogram[J]. J Am Soc Echocardiogr, 2004, 17(7): 803-810. DOI:10.1016/j.echo.2004.04.011 |
| [13] |
Meyer RA, Hagler D, Huhta J, et al. Guidelines for physician training in fetal echocardiography: recommendations of the Society of Pediatric Echocardiography Committee on Physician Training[J]. J Am Soc Echocardiogr, 1990, 3(1): 1-3. DOI:10.1016/s0894-7317(14)80291-5 |
| [14] |
Schneider C, McCrindle BW, Carvalho JS, et al. Development of Z-scores for fetal cardiac dimensions from echocardiography[J]. Ultrasound Obstet Gynecol, 2005, 26(6): 599-605. DOI:10.1002/uog.2597 |
| [15] |
Partridge EA, Peranteau WH, Herkert L, et al. Right-versus left-sided congenital diaphragmatic hernia: a comparative outcomes analysis[J]. J Pediatr Surg, 2016, 51(6): 900-902. DOI:10.1016/j.jpedsurg.2016.02.049 |
| [16] |
Khmour AY, Konduri GG, Sato TT, et al. Role of admission gas exchange measurement in predicting congenital diaphragmatic hernia survival in the era of gentle ventilation[J]. J Pediatr Surg, 2014, 49(8): 1197-1201. DOI:10.1016/j.jpedsurg.2014.03.011 |
| [17] |
Botash RJ, Spirt BA. Color Doppler imaging aids in the prenatal diagnosis of congenital diaphragmatic hernia[J]. J Ultrasound Med, 1993, 12(6): 359-361. DOI:10.7863/jum.1993.12.6.359 |
| [18] |
Richards DS, Kays DM. Fetal umbilical vein deviation in congenital diaphragmatic hernia[J]. J Ultrasound Med, 2013, 32(2): 263-268. DOI:10.7863/jum.2013.32.2.263 |
| [19] |
Lally KP, Lally PA, Lasky RE, et al. Defect size determines survival in infants with congenital diaphragmatic hernia[J]. Pediatrics, 2007, 120(3): e651-e657. DOI:10.1542/peds.2006-3040 |
| [20] |
Byrne FA, Keller RL, Meadows J, et al. Severe left diaphragmatic hernia limits size of fetal left heart more than does right diaphragmatic hernia[J]. Ultrasound Obstet Gynecol, 2015, 46(6): 688-694. DOI:10.1002/uog.14790 |
| [21] |
Schmidt KG, Silverman NH, Rudolph AM. Assessment of flow events at the ductus venosus-inferior vena cava junction and at the foramen ovale in fetal sheep by use of multimodal ultrasound[J]. Circulation, 1996, 93(4): 826-833. DOI:10.1161/01.cir.93.4.826 |
| [22] |
Stressig R, Fimmers R, Eising K, et al. Intrathoracic herniation of the liver ("liver-up") is associated with predominant left heart hypoplasia in human fetuses with left diaphragmatic hernia[J]. Ultrasound Obstet Gynecol, 2011, 37(3): 272-276. DOI:10.1002/uog.7747 |
 2021, Vol. 20
2021, Vol. 20


