2. 广州市妇女儿童医疗中心心脏中心(广东省广州市, 510623);
3. 广州市妇女儿童医疗中心数据中心(广东省广州市, 510623)
2. Heart Center,Guangzhou Women & Children Medical Center, Guangzhou 510623, China;
3. Data Center, Guangzhou Women & Children Medical Center, Guangzhou 510623, China
先天性膈疝(congenital diaphragmatic hernia, CDH)是膈肌发育不良导致腹腔脏器经膈肌缺损疝入胸腔的先天性疾病,是较常见的新生儿危重症,重症CDH患者病死率达50% ~60%[1]。对常规治疗无效的CDH患者,需通过ECMO辅助治疗度过呼吸衰竭及肺动脉高压的危险期。既往人们认为,肺发育不良和肺动脉高压是CDH的典型特征,也是决定患者预后的主要因素,但过去十年中,CDH患者对体外生命支持的需求并没有显著降低[2, 3]。近年研究发现,CDH患者的心功能不全与其不良预后有关,更有学者提出CDH的病理生理为肺发育不良、肺血管病变以及左心功能障碍三联征[4, 5]。CDH胎儿肺部评估已被普遍应用,但CDH胎儿心功能的产前评估结果并不能反映出生后情况。超声心动图利用超声的特殊物理学特性,是检查心脏和大血管解剖及功能的首选无创技术[6]。本研究旨在探讨超声心动图对CDH患者接受ECMO治疗的预测作用。
材料与方法 一、一般资料以2017年1月至2020年12月广州市妇女儿童医疗中心新生儿外科收治的CDH患者为研究对象,回顾性分析其临床资料及超声心动图资料。纳入标准:①经本院产前评估或出生后确诊为CDH的患者,并在本院积极救治者;②出生后24 h内在本院行超声心动图检查者。排除标准:合并严重心脏结构畸形或染色体异常者。本研究共纳入77例CDH患者,根据是否达到需要接受ECMO辅助治疗的指征,分为非ECMO组(58例)和ECMO组(19例)。本研究经医院伦理委员会批准,患者家属均签署知情同意书。
二、超声心动图检查收集患者一般临床资料及出生后24 h内床旁超声心动图资料。检查仪器为飞利浦CX50超声机,S8-3心脏探头,探头频率1~8 MHz。患者安静状态下取平卧位,对心脏进行全面扫查,重点扫查部位为胸骨旁左室长轴、胸骨上窝主动脉弓长轴、剑突下四腔心以及剑突下双心房切面,心脏超声数据测量方法参照欧美新生儿重症监护室超声心动图实践指南[7]。常规记录的测量值包括:经房水平分流流束宽径(atrial horizontal shunt, AHS)、右心室内径(right ventricular diameter, RVD)、主肺动脉内径(main pulmonary artery diameter, MPAD)、左心室缩短分数(left ventricular fractional shortening, LVFS)、左心室射血分数(left ventricular ejection fraction, LVEF)、经未闭动脉导管流束宽径(patent ductus arteriosus, PDA)、主动脉内径(aortic diameter, AOD)、左心房内径(left atrial diameter, LAD)、左心室收缩末期内径(left ventricular end-systolic diameter, LVESD)、左心室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)。
新生儿持续性肺动脉高压(persistent pulmonary hypertension of newborn, PPHN)的诊断需同时满足以下两点:①临床依据:动脉导管开口前后的动脉血氧分压差达10~20 mmHg或右上肢SpO2高于下肢5%或以上。②超声心动图:肺动脉收缩压大于35 mmHg或超过体循环收缩压的2/3;存在心房或动脉导管水平的右向左分流[8]。
三、CDH患者应用ECMO指征根据2016年欧洲CDH专家共识,符合其中一项即认为需要接受ECMO辅助治疗:①无法维持动脉导管前SpO2 85%以上或导管后SpO2 70%以上;②有效通气下pH<7.15,动脉血PaCO2持续上升;③需吸气峰压>28 cmH2O或平均气道压>17 cmH2O才能维持SpO2>85%;④持续pH < 7.15,乳酸≥5 mmol/L;⑤无法改善的低血压,12~24 h内尿量 < 0.5 mL·kg-1·h-1;⑥氧合指数≥40持续3 h以上[6]。
四、统计学方法应用SPSS 19.0进行数据分析。对符合正态分布的计量资料以(
非ECMO组58例均存活;ECMO组19例中,接受ECMO治疗12例,存活7例,拒绝ECMO治疗的7例均死亡。非ECMO组与ECMO组患者的性别构成、出生胎龄、出生体重、膈疝侧别以及是否产前诊断比较,差异无统计学意义(P>0.05);非ECMO组患者合并肝脏疝入、PPHN的比例低于ECMO组(P<0.05),见表 1。
| 表 1 非ECMO组与ECMO组的临床资料比较 Table 1 Comparison of clinical data between non-ECMO and ECMO groups |
|
|
两组超声心动图测量值中,AHS、RVD、MPAD、LVFS、LVEF差异无统计学意义(P>0.05);非ECMO组PDA值小于ECMO组,而AOD、LAD、LVESD、LVEDD值大于ECMO组,差异均有统计学意义(P < 0.05),见表 2。
| 表 2 非ECMO组与ECMO组的超声心动图测量值比较 Table 2 Comparison of echocardiographic measurements between non-ECMO and ECMO groups |
|
|
将非ECMO组与ECMO组中差异有统计学意义的变量作为自变量,采用逐步回归分析发现,肝脏疝入、PDA、LAD是CDH患者接受ECMO治疗的预测因子(P < 0.05)。PDA每增加1 mm则需要接受ECMO辅助治疗的风险上升3.33倍,LAD每增加1 mm则需要接受ECMO辅助治疗的风险下降82%。见表 3。
| 表 3 影响患者接受ECMO辅助治疗的多因素分析 Table 3 Multivariate analysis of risk factors in ECMO group |
|
|
PDA值的ROC曲线下面积为0.890(95%CI: 0.815~0.964, P < 0.05),约登指数最大值时对应数值为3.1mm,预测接受ECMO治疗的敏感度为100%,特异度为61.02%,见图 1A。LAD值的ROC曲线下面积为0.830(95%CI: 0.722~0.937, P < 0.05),约登指数取最大值时对应数值为7.5 mm,预测接受ECMO治疗的敏感度为61.11%,特异度为93.22%,见图 1B。
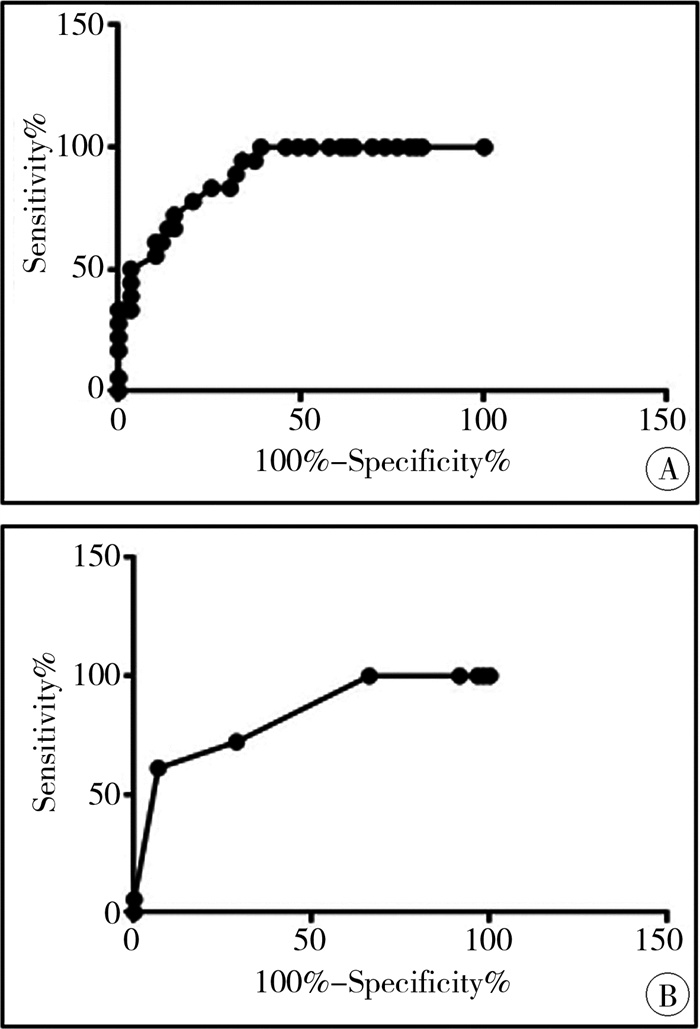
|
图 1 出生后超声心动图预测接受ECMO治疗的ROC曲线 Fig.1 ROC curve of postnatal echocardiography predicting ECMO treatment 注 A:PDA预测CDH患者接受ECMO治疗的ROC曲线; B:LAD预测CDH患者接受ECMO治疗的ROC曲线 |
本研究显示,肝脏疝入是CDH患者需要接受ECMO治疗的影响因素,与既往研究结果相符[9]。Gaffar等[10]提出心功能障碍是CDH患者需要接受ECMO辅助治疗的重要指征之一。既往有学者报道CDH患者左心质量低、心输出量低与ECMO应用后存活率降低相关[11];但左心质量数据只能通过尸检获取,且心输出量的监测在新生儿重症监护室应用较少。故本研究从已被广泛应用的超声心动图中提取基础数据,对CDH患者接受ECMO治疗的概率进行预测。
一、CDH患者PDA增大与ECMO使用相关在足月儿中,因肺血流增加可引起前列腺素的灭活,同时流经动脉导管血流氧分压的增加可导致动脉导管收缩,动脉导管多于出生后24 h内闭合[12]。CDH患者肺发育不良导致肺血流减少,同时CDH患者较高的肺动脉压力可造成未闭的动脉导管中主动脉和肺动脉之间的右向左分流,加重缺氧,导致胎儿循环向出生后循环的正常转变过程失败。大型的PDA会降低舒张压,减少冠状动脉的灌注,导致心肌缺血;在CDH患者中,大型PDA可导致左心的前负荷增大,进一步导致心功能的恶化。也有学者发现大型PDA会影响患者膈肌修补术后的恢复[13]。本研究显示,PDA增宽是导致患者接受ECMO治疗的独立危险因素,PDA每增加1 mm,患者需要接受ECMO辅助治疗的风险上升3.33倍,符合CDH患者的病理生理过程。但PDA不能简单结扎关闭,此时关闭可导致右心压力不能释放、右心衰竭以及体循环灌注不足,需通过机械通气、ECMO等治疗措施改善氧合,使PDA缩小甚至关闭。
二、CDH患者左心形态小与ECMO使用相关本研究单因素分析结果显示,非ECMO组的与左心相关径线AOD、LAD、LVESD、LVEDD值较ECMO组的值大,提示CDH患者左心形态较小与需要接受ECMO治疗相关,LAD缩小是需要接受ECMO治疗的影响因素,可能与以下因素有关:①腹腔脏器移位至胸腔内导致的物理性压迫,长期压迫导致左心舒张功能受限,血流减少,阻碍左心的充分发育。②肺发育不良、肺血管减少导致肺动脉压力高,右心压力高,也可致左心舒张受限。③CDH胎儿肺发育不良导致的肺血流减少使得左心容量负荷低,影响左心发育。需注意的是,LVEF和LVFS并不等同心输出量,有研究显示心输出量下降与需要接受ECMO治疗相关。当CDH患者病情稳定时,早期外科手术修补膈肌可缓解腹腔脏器对心脏的压迫,但当CDH患者病情不稳定时,延期手术已成为大多数治疗中心的共识,随着腔镜技术的成熟,胸腔镜手术修补避免了开胸、开腹手术的并发症,且不影响CDH患者的存活率[14, 15]。
三、CDH患者吸入一氧化氮(inhaled nitric oxide,iNO)效果不佳CDH患者合并肺动脉高压应用iNO需谨慎,其病死率和需要接受ECMO治疗的概率仍然较高[8]。动脉导管水平的分流方向取决于肺和全身血管阻力,心房分流取决于心室顺应性和由此产生的心房压力,非CDH的PPHN患者在心房水平和动脉导管水平上均以右向左分流为特征。而Wehrmann等[16]通过超声心动图发现84.3%的CDH患者肺动脉压力高于体循环压力,但82.4%的患者均为从左到右的心房分流,提示CDH患者左心房压力明显升高。CDH独特的病理生理导致了iNO应用效果不佳,CDH患者左心房小且压力高,肺静脉回流阻力大,行iNO治疗时,肺动脉扩张,加剧了肺静脉高压及左心房高压,甚至可导致肺出血。
综上,CDH患者的围手术期需重视心血管系统的管理,通过超声心动图的基础数据对CDH患者接受ECMO治疗概率进行预测,操作方便,实用性强,有助于临床决策。
| [1] |
Lally KP. Congenital diaphragmatic hernia: the past 25 (or so) years[J]. J Pediatr Surg, 2016, 51(5): 695-698. DOI:10.1016/j.jpedsurg.2016.02.005 |
| [2] |
Pierro M, Thébaud B. Understanding and treating pulmonary hypertension in congenital diaphragmatic hernia[J]. Semin Fetal Neonatal Med, 2014, 19(6): 357-363. DOI:10.1016/j.siny.2014.09.008 |
| [3] |
Kinsella JP, Steinhorn RH, Mullen MP, et al. The left ventricle in congenital diaphragmatic hernia: implications for the management of pulmonary hypertension[J]. J Pediatr, 2018, 197: 17-22. DOI:10.1016/j.jpeds.2018.02.040 |
| [4] |
Dao DT, Patel N, Harting MT, et al. Early left ventricular dysfunction and severe pulmonary hypertension predict adverse outcomes in "low-risk" congenital diaphragmatic hernia[J]. Pediatr Crit Care Med, 2020, 21(7): 637-646. DOI:10.1097/PCC.0000000000002318 |
| [5] |
Tingay DG, Kinsella JP. Heart of the matter? Early ventricular dysfunction in congenital diaphragmatic hernia[J]. Am J Respir Crit Care Med, 2019, 200(12): 1462-1464. DOI:10.1164/rccm.201909-1737ED |
| [6] |
Snoek KG, Reiss IK, Greenough A, et al. Standardized postnatal management of infants with congenital diaphragmatic hernia in Europe: the CDH EURO Consortium Consensus-2015 Update[J]. Neonatology, 2016, 110(1): 66-74. DOI:10.1159/000444210 |
| [7] |
Mertens L, Seri I, Marek J, et al. Targeted Neonatal Echocardiography in the Neonatal Intensive Care Unit: practice guidelines and recommendations for training.Writing Group of the American Society of Echocardiography (ASE) in collaboration with the European Association of Echocardiography (EAE) and the Association for European Pediatric Cardiologists (AEPC)[J]. J Am Soc Echocardiogr, 2011, 24(10): 1057. DOI:10.1016/j.echo.2011.07.014 |
| [8] |
杜立中, 薛辛东, 母得志, 等. 新生儿肺动脉高压诊治专家共识[J]. 中华儿科杂志, 2017, 55(3): 163-168. Du LZ, Xue XD, Mu DZ, et al. Expert Consensus on Diagnosis and Treatment of Neonatal Pulmonary Hypertension[J]. Chinese Journal of Pediatrics, 2017, 55(3): 163-168. DOI:10.3760/cma.j.issn.0578-1310.2017.03.002 |
| [9] |
于斯淼, 马立霜, 王莹, 等. 新生儿膈疝胸腔镜治疗后存活率的影响因素分析[J]. 临床小儿外科杂志, 2020, 19(5): 441-446. Yu SM, Ma LS, Wang Y, et al. Prenatal evaluations and postnatal diagnosis and treatment of congenital diaphragmatic hernia[J]. J Clin Ped Sur, 2020, 19(5): 441-446. DOI:10.3969/j.issn.1671-6353.2020.05.013 |
| [10] |
Gaffar S, Ellini AR, Ahmad I, et al. Left ventricular cardiac output is a reliable predictor of extracorporeal life support in neonates with congenital diaphragmatic hernia[J]. J Perinatol, 2019, 39(5): 648-653. DOI:10.1038/s41372-019-0348-3 |
| [11] |
Baumgart S, Paul JJ, Huhta JC, et al. Cardiac malposition, redistribution of fetal cardiac output, and left heart hypoplasia reduce survival in neonates with congenital diaphragmatic hernia requiring extracorporeal membrane oxygenation[J]. J Pediatr, 1998, 133(1): 57-62. DOI:10.1016/S0022-3476(98)70178-7 |
| [12] |
郑珊. 实用新生儿外科学[M]. 北京: 人民卫生出版社, 2013: 326-328. Zheng S. Practical Neonatal Surgery[M]. Beijing: People's Medical Publishing House, 2013: 326-328. |
| [13] |
赵萍, 刘翔, 左伟, 等. 胸腔镜手术治疗新生儿先天性膈疝复发的影响因素分析及其对复发膈疝的治疗效果[J]. 临床小儿外科杂志, 2021, 20(2): 153-160. Zhao P, Liu X, Zuo W, et al. Analysis of influencing factors for recurrence after thoracoscopic repair of congenital diaphragmatic hernia in neonates and its treatment effect on recurrence[J]. J Clin Ped Sur, 2021, 20(2): 153-160. DOI:10.12260/lcxewkzz.2021.02.009 |
| [14] |
Altit G, Bhombal S, Van Meurs K, et al. Ventricular performance is associated with need for extracorporeal membrane oxygenation in newborns with congenital diaphragmatic hernia[J]. J Pediatr, 2017, 191: 28-34. DOI:10.1016/j.jpeds.2017.08.060 |
| [15] |
Chatterjee D, Ing RJ, Gien J. Update on Congenital Diaphragmatic Hernia[J]. Anesth Analg, 2019, 131(3): 1. DOI:10.1213/ANE.0000000000004324 |
| [16] |
Wehrmann M, Patel SS, Haxel C, et al. Implications of atrial-level shunting by echocardiography in newborns with congenital diaphragmatic hernia[J]. J Pediatr, 2020, 219: 43-47. DOI:10.1016/j.jpeds.2019.12.037 |
 2021, Vol. 20
2021, Vol. 20


