来源于肾上腺髓质的嗜铬细胞瘤(pheochromocytoma, PHEO)是一类少见且特殊的肾上腺肿瘤,属于神经内分泌肿瘤,外科手术切除是其唯一的治愈方法。近些年来,腹腔镜及机器人辅助腹腔镜技术已逐渐替代传统开放手术,应用于成人及小儿的肾上腺肿瘤切除术[1-3]。机器人辅助腹腔镜肾上腺部分切除术(robotic-assisted laparoscopic partial adrenalectomy, RALPA)已被认定为良性的小肿瘤以及具有激素活性的肾上腺肿瘤的推荐治疗方法[4]。
2020年7月上海交通大学附属儿童医院收治了1例右侧肾上腺嗜铬细胞瘤患者,行机器人辅助腹腔镜下肾上腺部分切除术,现随访至术后6个月,疗效满意。
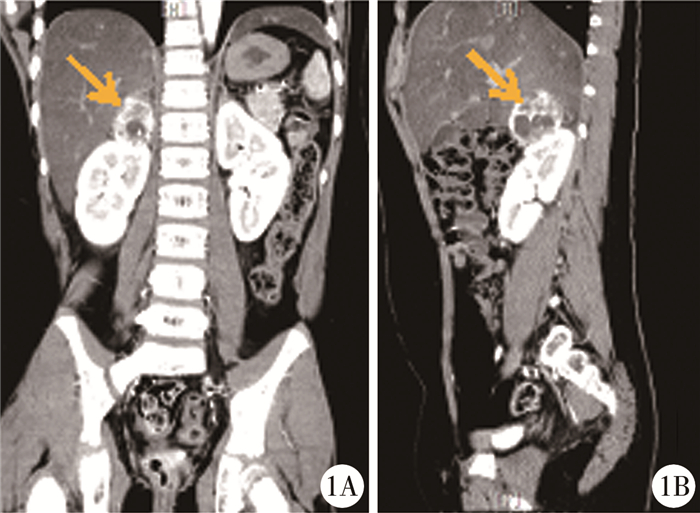
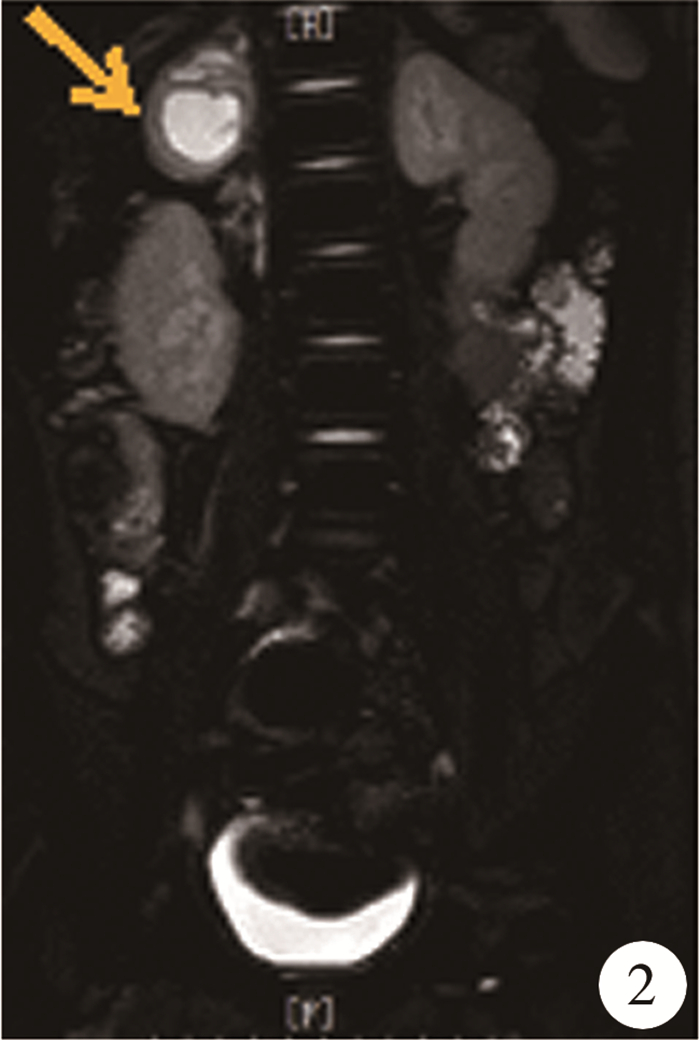
材料与方法 一、临床资料患者,男,8岁,因“发现血压升高及右侧肾上腺占位5天”入院。患者因“斜视”于当地医院拟行手术治疗,术前检查发现血压170/140 mmHg,行超声及CT检查发现右侧肾上腺肿物,考虑嗜铬细胞瘤,转入本院行手术治疗。患者无家族肿瘤病史。病程中有头痛、呕吐、多汗表现,血压最高达200/140 mmHg。入院后查血生化电解质、皮质醇节律、肿瘤标记物、性激素均基本正常;肾素、血管紧张素及醛固酮均正常;血糖升高;24 h尿香草基杏仁酸(vanillylmandelic acid, VMA)升高;血液及24 h尿中儿茶酚胺(catecholamine, CA)代谢产物明显增高,血液中以甲氧基去甲肾上腺素(normetanephrine, NMN)为主,尿中以甲氧基肾上腺素(metanephrine, MN)为主;骨髓细胞学检查正常;PET-CT检查未见明显转移灶;甲状腺及甲状旁腺功能基本正常;眼底检查未见高血压眼病;心脏彩超提示室间隔及左室壁肥厚。病灶的影像学检查包括增强CT及增强MRI(图 1至图 2),均提示右侧肾上腺区椭圆形肿物,大小约4.3 cm×3.9 cm×3.5cm,形态尚规则,边界尚清,增强后病灶大部分区域呈明显不均匀强化,以周边强化明显,周围脏器未见明显肿瘤浸润,左侧肾上腺结构正常。考虑为右侧良性嗜铬细胞瘤。
|
图 1 嗜铬细胞瘤患者增强CT图 注 1A:冠状面; 1B:矢状面示右侧肾上腺区椭圆形肿物(箭头),形态尚规则,边界尚清,增强CT检查提示病灶大部分区域呈明显不均匀强化,以周边强化明显 Fig.1 Contrast-enhanced CT image of a child with pheochromocytoma |
|
图 2 嗜铬细胞瘤患者增强磁共振T2加权成像 注 冠状面,显示肿瘤呈高信号(箭头) Fig.2 Enhanced T2-weighted MRI of a child with pheochromocytoma |
患者入院后口服酚苄明降血压,根据血压下降情况剂量由每日两次,每次10 mg递增至每日2次,每次25 mg。同时每日予高蛋白、高盐饮食,行晶体扩容治疗。治疗14 d后血压稳定于130/80 mmHg,随后完善术前准备,行机器人辅助经腹腔入路腹腔镜手术。
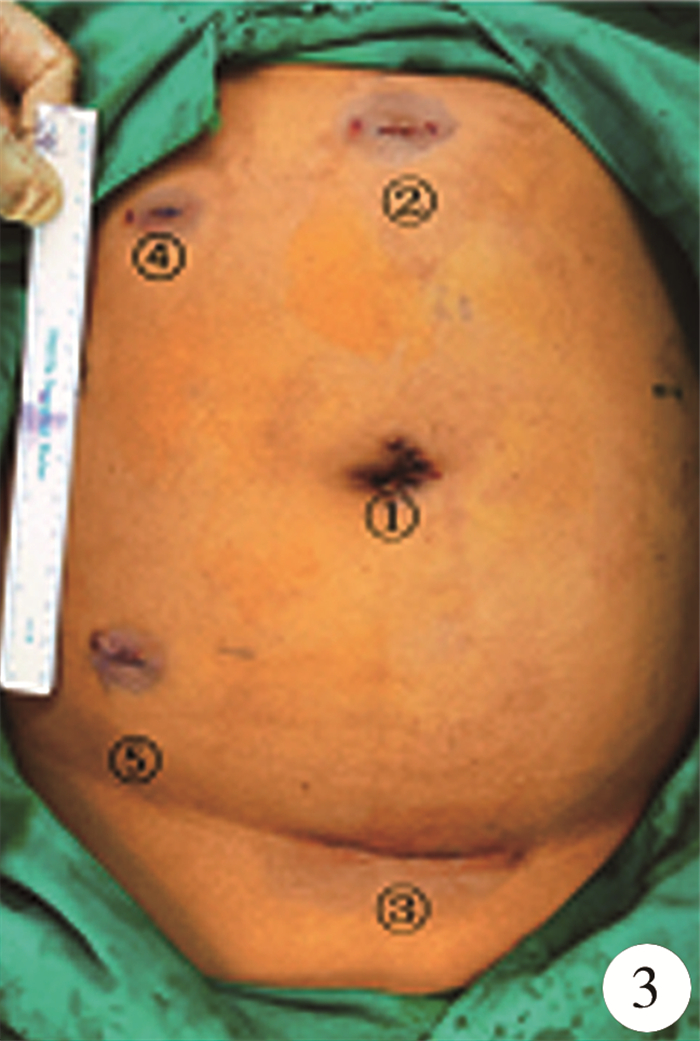
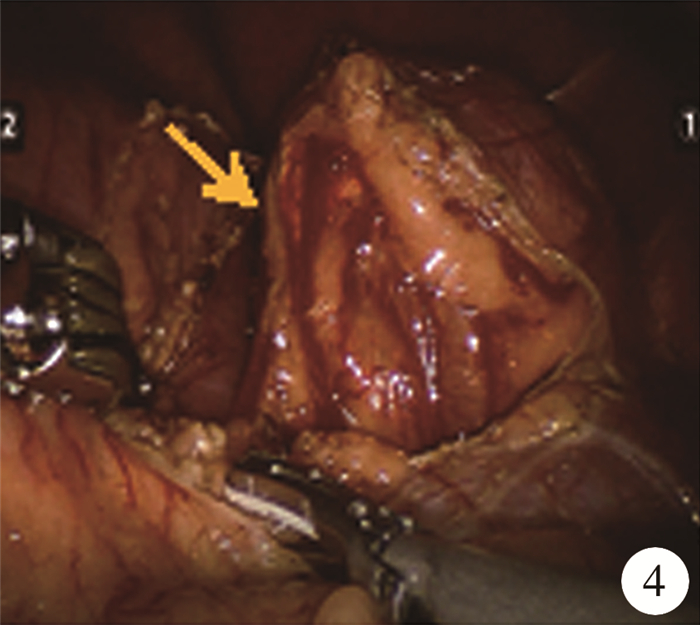
麻醉成功后,留置导尿管,按照笔者团队的单中心经验进行体位摆放,完成套管放置(图 3)及机械臂对接定位[1]。术中沿结肠旁沟切开侧腹膜,切断肝结肠韧带,将右半结肠翻向内下,经辅助孔1(图 3)使用金手指托举肝脏,在肾上极处切开Gerota筋膜,显露右肾上极及肾上腺区肿瘤。见肿瘤约4 cm×3 cm×3 cm大小,质韧,表面血管怒张(图 4),肿物肾面、外缘、背面边界清晰,内侧边界欠清晰,与周围组织粘连,瘤体内上方可见正常肾上腺结构。先游离肿瘤边界清晰的肾面、外缘及背面,Hem-o-lock夹闭肾上腺供养动脉,再沿肿瘤包膜外解剖间隙将腹侧缘的中央静脉显露并用Hem-o-lock夹闭,保留瘤体上方部分形态正常的肾上腺组织(距肿瘤边缘0.5 cm)及其供养血管(图 5),将肿瘤完整切除。术中有1根已应用超声刀阻断的供养血管突发再次出血,予增大气腹压力和流量后出血速度明显减缓,新增一个辅助孔放置吸引器(图 3),继而找到出血血管予Hem-o-lock钳夹止血。肿瘤切除过程中,麻醉师根据血压波动情况酌情予酚妥拉明降血压,切除肿物后予去甲肾上腺素维持血压稳定,防止低血压,腹腔内手术时间105 min,在麻醉药物控制及术者的轻柔操作下患者无明显血压波动及心率异常,术中出血约400 mL,予输血治疗。肿物大体标本如图 6,术后病理检查提示嗜铬细胞瘤,包膜完整。
|
图 3 经腹腔入路各Trocar位置 注 ①: 目镜(脐左缘);②: 操作孔1(正中线脐上8 cm);③: 操作孔2(脐下与Pfannenstiel切口交叉点),及其延长的Pfannenstiel切口(取出肿瘤处);④: 辅助孔1(右侧锁骨中线肋缘下交界处,放置金手指托举肝脏),⑤: 术中因出血增加辅助孔2(右下腹,放置吸引器) Fig.3 Trocar location for a transperitoneal approach |
|
图 4 嗜铬细胞瘤患者行肿物切除前,术中所见 注 显露右肾上极及肾上腺区肿瘤(箭头),表面血管怒张 Fig.4 Pheochromocytoma image during operation (before resection) |

|
图 5 患者嗜铬细胞瘤切除后,术中所见图 注 肿瘤切除术后保留部分正常肾上腺组织(箭头) Fig.5 Pheochromocytoma image during operation (after resection) |

|
图 6 嗜铬细胞瘤患者肿瘤大体标本图 注 肿瘤包膜完整 Fig.6 Gross specimen of pheochromocytoma |
检索万方、维普、中国知网、PubMed、Medline数据库,检索关键词:儿童(child)、机器人(robotics)、嗜铬细胞瘤(pheochromocytoma),检索2021年3月前公开发表的文献。剔除标准:①剔除无法获得全文资料的儿童病例。②对同一作者、医院、研究所、数据库重复报道病例予以剔除。共6例行机器人辅助腹腔镜肾上腺部分切除术治疗的嗜铬细胞瘤患者纳入本研究。
结果 一、本院1例预后患者围手术期严密监测血压、心率、中心静脉压、尿量等指标,适时补液,补充血容量;术后5 h停用去甲肾上腺素后血压稳定在110~130 mmHg/60~80 mmHg,术后2 d恢复饮食,患者可下地走动。术后住院6 d,复查尿VMA正常,血液及24 h尿中儿茶酚胺代谢产物基本正常。术后6个月,门诊复查超声未见异常,血压恢复正常,无其他术后并发症。
二、文献分析最终检索到英文文献报道儿童PHEO行RALPA共6例(8侧),结合本文1例(1侧),共7例患者。其资料见表 1[5-10]。除1例未提及性别、年龄侧别及大小外,其他6例均为男性,年龄8~18岁,1例左侧,3例右侧,2例双侧,5例明确合并Von Hippel-Lindau (VHL) 综合征。6例中2例存在并发症,包括1例因高血压危象转开放手术,切除的肿瘤最大直径为6 cm。所有病例术后恢复良好,无死亡或肿瘤复发病例,见表 1。
| 表 1 截至2021年3月文献报道的儿童PHEO行RALA术式者一般资料 Table 1 General profiles of PHEO children undergoing RALA in the literature up to March 2021 |
|
|
PHEO是一种来源于肾上腺髓质嗜铬组织或肾上腺外自主神经节的神经内分泌肿瘤,胚胎起源为神经嵴。2019年WHO将此类肿瘤分为两大类,来源于肾上腺髓质产生儿茶酚胺(包括肾上腺素、去甲肾上腺素及多巴胺)的嗜铬细胞肿瘤称为嗜铬细胞瘤;起源于交感或副交感神经节的肾上腺外嗜铬细胞的肿瘤称为异位嗜铬细胞瘤或副神经节瘤(para-ganglioma, PGL)。外科手术切除是唯一的治愈方法,腹腔镜技术的发展使得大部分PHEO可通过微创手术切除,但一部分巨大或复杂PHEO仍需行开放手术。机器人辅助腹腔镜技术的兴起使得一些不适合传统腹腔镜手术的复杂或大直径PHEO的微创切除成为可能[2, 3],而RALPA已被认定可作为良性的小肿瘤以及具有激素活性的肾上腺肿瘤的推荐治疗方法[4]。
儿童嗜铬细胞瘤的发病率远较成人低,发病率约2/100万[11]。Ross[12]统计及比较文献中儿童与成人嗜铬细胞瘤的流行病学资料,发现嗜铬细胞瘤患者中有家族史的儿童约占28%,而成人为10%;双侧嗜铬细胞瘤中儿童约占20%,也明显高于成人中的5% ~10%。
嗜铬细胞瘤的临床表现个体差异很大,这与儿茶酚胺分泌量有关。最常见症状为高血压和基础代谢改变,0.5% ~2%的儿童高血压继发于PHEO/PGL[13]。头痛、心悸、多汗是嗜铬细胞瘤患者高血压发作的三联征。高血压可表现为持续性或阵发性发作,或者持续性发作伴阵发性加重[14],可由剧烈运动、体位改变、情绪波动、肿瘤受挤压等诱发。恶性嗜铬细胞瘤的确诊不依赖于病理检查,而是需依据其生物学行为,只有在广泛浸润邻近组织及没有嗜铬细胞的组织或器官内发现转移灶时才可确诊[12, 14];多见于肝、肺、骨、淋巴结及脑转移等。
由于嗜铬细胞瘤往往起病隐匿,故易被延误诊断。临床上一旦怀疑,应立即进行生化及影像学检查。由于血和24 h尿中CA及VMA的敏感性和特异性较低,故目前临床上更推荐测定MMN和MN水平值,如异常值高于4倍,则高度提示肿瘤存在[13]。嗜铬细胞瘤的影像学检查包括B超、CT、MRI、MIBG及PEF-CT。超声可作为肿瘤筛查的首选检查,但会遗漏肾上腺小肿瘤和PGL。因97%以上儿童嗜铬细胞瘤位于膈下至盆腔的范围,可进一步行腹盆腔CT或MRI检查对肿瘤定位,两项检查的敏感性均高达90% ~100%,但MRI检查对肾上腺外肿瘤定位的敏感性优于CT,MRI的T2加权像表现为特征性的高信号像,同时还能评估肿瘤对椎管的浸润程度和主要血管的受累程度,且无辐射影响,故目前更为推荐MRI检查。MIBG虽有较高的特异性,但其显像的敏感性,特别是对肾上腺外的嗜铬细胞瘤而言较低,在一些研究中,MIBG扫描已与CT/MRI联合用于定位和排除多灶性疾病,在定位时提供高达95% ~100%的特异性[12, 13]。
嗜铬细胞瘤术前有效控制血压及调整心率是预防术中高血压危象的关键。有严重高血压或心律失常的患者需在术前通过药物先行治疗及纠正,包括使用α受体阻滞剂或血管扩张剂降血压,一般需要2周左右术前准备,使用α受体阻滞剂后,可使围手术期并发症从45% ~69%降至3%[13]。需要强调的是,尽管大部分患者有高血压表现,但因为长期的血管收缩,体内有效血容量严重不足,术前扩容有助于减少术后低血压的发生。患者在术前麻醉、术中挤压肿瘤以及切除肿瘤过程中可释放大量儿茶酚胺,导致剧烈的血压波动,因此围术期的处理尤为重要。本手术要求麻醉师术中实时监测患者血压波动情况,及时给予降压和升压药物。因此术中术者与麻醉师的密切配合至关重要。此外,切除肿瘤后,如果血压不降或下降后再次升高,则要警惕多发性嗜铬细胞瘤的可能。
嗜铬细胞瘤周围常包绕丰富的血管网,虽然目前大部分PHEO可通过腹腔镜肾上腺切除术(laparoscopic adrenalectomy, LA)完成,但LA的一些不足限制了其在复杂或直径较大或者肥胖人群的PHEO应用,如二维视野、镜头不稳定、操作工具僵硬、器械操作空间受限、术者舒适度差等[2, 3]。机器人辅助腹腔镜下肾上腺肿瘤切除术(robotic-assisted laparoscopic adrenalectomy, RALA)与传统腔镜手术比较,由于定位精准,操作轻柔,抖动幅度小,可减少不必要的肿瘤挤压及血管损伤,继而减少了儿茶酚胺的释放,故术中患者血压波动较小,可减少相关并发症的发生。本例患者BMI≥24 kg/m2,属于超重,体内脂肪组织过多,增加了肿瘤周围的粘连,术中分离瘤体时易导致脂肪组织出血,机器人手术的双极电凝止血操作相对轻松简单,比普通腹腔镜的超声刀或者电凝钩止血更有优势。
此外,对于肾上腺嗜铬细胞瘤而言,因肿瘤起源于肾上腺的髓质,其皮质具有正常的功能和形态。如果手术将患侧肾上腺全部切除,将来对侧肾上腺需要手术时可能面临肾上腺皮质功能不全的危险以及终生类固醇依赖等问题。因此,针对本例患者,本研究采取了保留同侧正常肾上腺皮质的手术方式。这类手术方式已被广泛应用于成人及儿童患者[6, 7, 15, 16]。早在1982年,开放性保留皮质的肾上腺切除术(cortical-sparing adrenalectomy)就已被应用于双侧嗜铬细胞瘤的治疗[15],1996年Walz等[16]对腹腔镜技术进行了相应改良。有趣的是,机器人辅助腹腔镜肾上腺部分切除术(robot-assisted laparoscopic partial adrenalectomy, RALPA)反而最早在儿童方面得到报道:2006年就有关于首例儿童RALPA病例的报道[7]:该患者罹患VHL综合征,9岁时因左侧肾上腺嗜铬细胞瘤曾行开放性肾上腺切除术,18岁因右侧肾上腺嗜铬细胞瘤行RALPA。2008年,Rogers等[6]报道了一例应用机器人肾上腺部分切除术治疗患有VHL的14岁肾上腺嗜铬细胞瘤并发肾上腺外嗜铬细胞瘤患者。
目前,机器人辅助腹腔镜肾上腺部分切除术已经被证明是治疗肾上腺肿瘤安全可行的手术方法[4, 6, 7, 17]。众所周知,如果采取肾上腺部分切除术,相较于肾上腺全切术,手术难度更大,精准度需求更高,而达芬奇机器人系统恰巧具备相关优势,可以确保对肿瘤周围正常肾上腺组织进行最小程度的操作[4, 17]。机器人手术提供的三维视野和眼手协调性可以使手术者操作更为精确。对于内镜手术并发症之一的血管损伤,不同于传统腹腔镜手术下的操作困难,由于机器人关节操作的精准性,可做到快速控制和初步修复这种损伤,从而降低中转开放手术的比例[10, 18],本例术中出血处理亦证实这个优势的存在。
目前,RALPA的手术方式多见于成人,而对于儿童患者,由于其腹腔内操作空间较成人更加局限,手术难度更大,故国际报道的病例极少[1]。就笔者所知,目前国际上有相关报道的仅6例(8侧)肾上腺嗜铬细胞瘤儿童行机器人手术[5-10],其中5侧行RALPA术式,而国内未见相关报道。因此,就目前而言,RALPA的作用仍存在争议,仍需要大样本的随机对照研究来评价其获益及远期疗效。
综上所述,对于肾上腺嗜铬细胞瘤,传统腹腔镜手术难度较大,采用机器人辅助腹腔镜技术能安全高效地完成手术,且该术式具有出血少和术后住院时间短等优点。
| [1] |
陈艳, 杨刚刚, 黄轶晨, 等. 机器人辅助腹腔镜下儿童肾上腺肿瘤切除术的初步探讨[J]. 中华小儿外科杂志, 2019, 40(2): 137-142. Chen Y, Yang GG, Huang YC, et al. Preliminary experience of robot-assisted laparoscopic adrenalectomy for children with adrenal tumor[J]. Chin J Pediatr Surg, 2019, 40(2): 137-142. DOI:10.3760/cma.j.issn.0253-3006.2019.02.009 |
| [2] |
沈周俊, 夏磊磊, 何威, 等. 机器人辅助腹腔镜下肾上腺复杂肿瘤手术(附光盘)[J]. 现代泌尿外科杂志, 2014, 19(2): 71-74. Shen ZJ, Xia LL, He W, et al. Da Vinci robot-assisted laparoscopic adrenalectomy for complex adrenal tumor (compact disc included)[J]. J Mod Urol, 2014, 19(2): 71-74. DOI:10.3969/j.issn.1609-8291.2014.02.001 |
| [3] |
沈周俊, 夏磊磊. 嗜铬细胞瘤手术方法的选择[J]. 现代泌尿外科杂志, 2014, 19(7): 426-429. Shen ZJ, Xia LL. Selections of surgical procedures for pheochromocytoma[J]. J Mod Urol, 2014, 19(7): 426-429. DOI:10.3969/j.issn.1009-8291.2014-07-003 |
| [4] |
Calì B, Nomine-Criqui C, Bihain F, et al. Robotic approach for partial adrenalectomy[J]. Updates in Surgery, 2021, 73(3): 1147-1154. DOI:10.1007/s13304-020-00957-6 |
| [5] |
Meehan JJ, Sandler A. Pediatric robotic surgery: A single-institutional review of the first 100 consecutive cases[J]. Surgical Endoscopy, 2008, 22(1): 177-182. DOI:10.1007/s00464-007-9418-2 |
| [6] |
Rogers CG, Blatt AM, Miles GE, et al. Concurrent robotic partial adrenalectomy and extra-adrenal pheochromocytoma resection in a pediatric patient with von Hippel-Lindau disease[J]. Journal of Endourology, 2008, 22(7): 1501-1504. DOI:10.1089/end.2007.0314 |
| [7] |
Julien JS, Ball D, Schulick R. Robot-assisted cortical-sparing adrenalectomy in a patient with Von Hippel-Lindau disease and bilateral pheochromocytomas separated by 9 years[J]. J Laparoendosc Adv Surg Tech A, 2006, 16(5): 473-477. DOI:10.1089/lap.2006.16.473 |
| [8] |
Volkin D, Yerram N, Ahmed F, et al. Partial adrenalectomy minimizes the need for long-term hormone replacement in pediatric patients with pheochromocytoma and von Hippel-Lindau syndrome[J]. Journal of Pediatric Surgery, 2012, 47(11): 2077-2082. DOI:10.1016/j.jpedsurg.2012.07.003 |
| [9] |
Meignan P, Ballouhey Q, Lejeune J, et al. Robotic-assisted laparoscopic surgery for pediatric tumors: a bicenter experience[J]. Journal of Robotic Surgery, 2018, 12(3): 501-508. DOI:10.1007/s11701-017-0773-2 |
| [10] |
Mitra AP, Vasquez E, Kokorowski P, et al. Robotic adrenalectomy in the pediatric population: initial experience case series from a tertiary center[J]. BMC Urology, 2020, 20(1): 155. DOI:10.1186/s12894-020-00727-x |
| [11] |
Ciftci AO, Tanyel FC, Senocak ME, et al. Pheochromocytoma in children[J]. J Pediatr Surg, 2001, 36(3): 447-452. DOI:10.1053/jpsu.2001.21612 |
| [12] |
Ross JH. Pheochromocytoma: special considerations in children[J]. Urol Clin North Am, 2000, 27(3): 393-402. DOI:10.1016/s0094-0143(05)70088-4 |
| [13] |
Bholah R, Bunchman TE. Review of pediatric pheochromocytoma and paraganglioma[J]. Front Pediatr, 2017, 5: 155. DOI:10.3389/fped.2017.00155 |
| [14] |
白悦心, 赵艺蕾, 沈卫萍, 等. 197例嗜铬细胞瘤临床分析[J]. 国际内分泌代谢杂志, 2007, 27(3): 209-210. Bai YX, Zhao YL, Shen WP, et al. Clinical analysis of pheochromocytoma: a report of 197 cases[J]. Intern J Endocrinol Metab, 2007, 27(3): 209-210. |
| [15] |
Giordano, William C. Preservation of adrenocortical function during surgery for bilateral pheochromocytoma[J]. Journal of Urology, 1982, 127(1): 100-102. DOI:10.1016/S0022-5347(17)53627-7 |
| [16] |
Walz MK, Peitgen K, Hoermann R, et al. Posterior retroperitoneoscopy as a new minimally invasive approach for adrenalectomy: results of 30 adrenalectomies in 27 patients[J]. World Journal of Surgery, 1996, 20(7): 769-774. DOI:10.1007/s002689900117 |
| [17] |
Morris LF, Perrier ND. Advances in robotic adrenalectomy[J]. Current Opinion in Oncology, 2012, 24(1): 1-6. DOI:10.1097/CCO.0b013e32834da8e1 |
| [18] |
朱照伟, 屈武功, 朱阿丽, 等. 达芬奇机器人手术治疗复杂肾上腺嗜铬细胞瘤的临床疗分析[J]. 中华内分泌外科杂志, 2020, 14(3): 204-207. Zhu ZW, Qu WG, Zhu AL, et al. Clinical study of robotic management of complex pheochromocytoma[J]. Chin J Endocr Surg, 2020, 14(3): 204-207. DOI:10.3760/cma.j.issn.115807-20190514-00100 |
 2021, Vol. 20
2021, Vol. 20


