2000年Rothenberg[1]第一次在文献中描述了小儿胸腔镜下肺叶切除术,近年来胸腔镜下肺叶切除术在世界各地逐渐开展[2]。文献报道胸腔镜辅助下肺叶切除术仍存在一定局限性,如:主刀医生操作过程中观察到的是二维平面图像、操作空间有限,手术时间过长易导致主刀医生疲劳等[3, 4]。机器人辅助外科系统的诞生解决上述问题。2008年, Meehan首次报道应用机器人辅助行肺叶切除术, 具有分离血管更精准、3D成像手术视野更清晰等优势[5]。浙江大学医学院附属儿童医院于2020年4月引进机器人手术系统,2020年5月开始进行第一台机器人辅助胸腔镜下纵膈肿瘤切除术,截至2021年3月底共完成小儿胸外科手术115例,其中小儿肺叶/肺段切除手术85例。本研究通过回顾性分析上述85例机器人辅助胸腔镜下肺叶/肺段切除术患者的临床资料,旨在探索机器人在小儿肺叶切除术中应用的可行性,为后续该技术在小儿胸外科手术中的深入开展提供参考。
材料与方法 一、研究对象及临床资料回顾性收集2020年5月至2021年3月在浙江大学医学院附属儿童医院胸外科行机器人辅助胸腔镜下肺部手术的85例患者临床资料,男54例、女31例,年龄6个月15天至12岁10个月,平均(17.56±7.35)个月。体重7.1~57.5 kg, 平均(10.75±6.42)kg。其中52例产前胎儿超声确认为肺部病变,随访至出生后6个月实施手术;25例有反复肺炎病史;3例有咯血史,均为叶内型隔离肺。
收集患者的性别、年龄、体重、病变位置、术前诊断、手术时间(机器人连接至撤机结束)、术中出血量、术后引流量、术后胸腔引流时间、围术期并发症发生率及病死率、住院天数、术后病理诊断及住院费用。
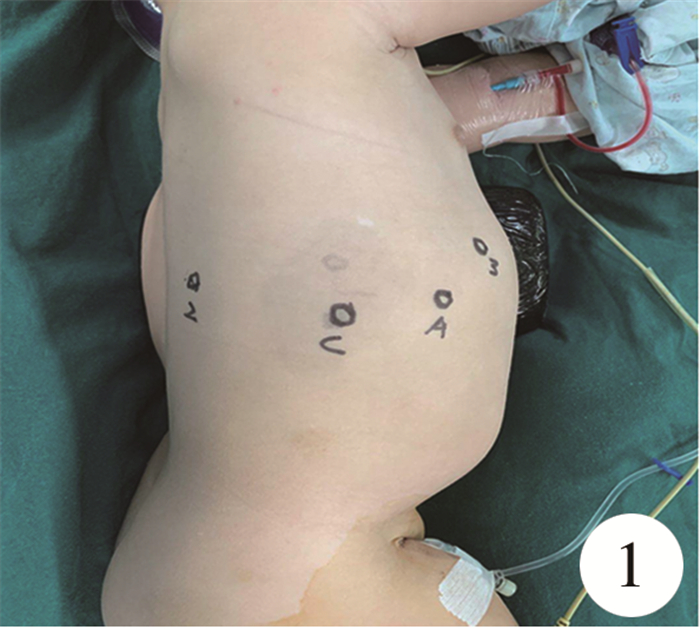
二、手术方法在全身麻醉诱导的同时,由经过专门培训的护士启动机器人外科辅助系统,完成系统自检和预热,套好无菌袋,备好用于手术操作的机械臂待命。采用单气管插管健侧肺叶或球囊封堵患侧气管,单肺通气,麻醉方式同胸腔镜手术。患者取健侧卧位,下垫垫子,尽量将患侧肋间隙拉大,以便于机械臂活动。常规消毒铺巾。机器人系统常规选用镜头臂和1、2号机械手臂(右手臂、左手臂),分别装入无损伤心包抓钳和双极电凝,具体布孔如图 1。
|
图 1 肺叶切除术常规布孔 注 A: 辅助孔;C: 观察孔;2:机器人2号臂;3:机器人3号臂; Fig.1 Lobectomy was performed with routine burrowing |
以右下肺手术为例,镜头孔位于腋中线第九肋间,置入一个8 mm Trocar,右手臂操作孔位于锁骨中线第六肋间,左手臂操作孔位于肩胛下线第十肋间,每个切口之间距离>4 cm,辅助孔5~12 mm大小,位于腋前线第七肋间,推入完成预热的机器人,与患者鞘孔完成对接。于观察孔接入向下三维镜头,并在胸腔充入CO2气体,将胸腔压力维持在6~8 mmHg水平,使肺叶萎陷。在三维镜头引导下,分别装配机器人系统1号臂(右臂)和2号臂(左臂),选取器械分别为无损伤心包抓钳和双极电凝。3D镜头30°向上,直视下引导抓钳和双极置入手术靶区。对于肺上叶手术,可将各孔位置上移一个肋间。对于小年龄的患者可将左右机械臂的操作孔往镜头孔方向靠近。
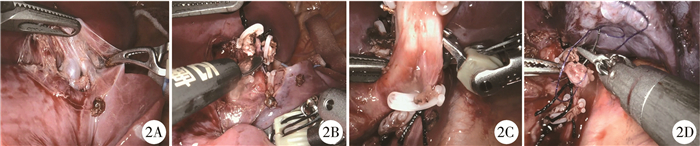
主刀医师坐在操作台操作,助手通过辅助孔置入抓钳和吸引器协助牵拉肺组织,显露胸腔内结构,吸引,放入Hem-o-lock结扎血管,对叶裂发育不良者可扩大辅助孔至直径12 mm大小,置入直线切割吻合器离断叶裂和支气管,取出肺组织标本(图 2)。手术顺序基本同常规胸腔镜手术,优先处理肺动脉、肺静脉,最后处理支气管,术后根据术中情况酌情决定是否放置引流管,拔管后返回病房。
|
图 2 机器人辅助胸腔镜下行肺叶切除术 注 2A: 解剖分离下肺动脉; 2B: 结扎离断下肺动脉; 2C: 解剖分离下肺支气管; 2D: 离断缝扎支气管 Fig.2 Da Vinci robot-assisted thoracoscopic lobectomy |
85例均顺利经机器人辅助胸腔镜下完成手术,包括解剖性肺叶切除术、肺段切除术、锲形切除术、囊肿剥离术和叶外隔离肺切除术,其中1例中转开胸手术,为1例7月龄左肺下叶叶内型隔离肺患者。所有患者无一例发生严重围术期并发症或死亡。胸腔引流时间0~5 d,平均(1.38±0.87)d;住院时间4~10 d,平均(6.23±1.25)d;手术时间42~270 min,平均(74.76±30.21)min;术中出血量1~30 mL,平均(4.05±2.21)mL;住院总费用61 897~95 033元, 平均(70 426.65±6 086.78) 元。所有患者围术期未行输血治疗。术后病理诊断:隔离肺23例,其中叶内型13例,叶外型10例(4例为膈肌内型);囊腺瘤62例,其中1型19例,2型38例,3型3例,4型2例。具体肺叶/肺段切除情况详见表 1。
| 表 1 肺叶/肺段切除部位及例数 Table 1 Locations and number of cases of lobectomy/segmental resection |
|
|
分别于术后1个月、4个月、10个月对患者进行随访,常规复查胸片和CT,至今未见复发病例,患者术后肺代偿良好。
讨论肺叶/肺段切除术是治疗小儿肺囊性病变的经典术式,胸腔镜下微创手术近年来得到了飞速发展,这使得胸腔镜下肺叶/肺段切除术越来越多被家长和患者所接受。但是受制于胸腔镜下的二维视野、不稳定的操作视野和操作受限的器械运动轨迹,胸腔镜手术的推广应用受到限制。机器人手术系统提供了一个由术者控制的、稳定的、高分辨率的3D视野,可进行手腕样动作并在有限空间内进行分离,使腔镜下肺叶切除术变得更加容易,也更加安全。2008年, 美国西雅图儿童医院Meehan[5]首次报道应用机器人辅助胸腔镜行小儿肺叶切除术,2012年,国外报道机器人肺叶切除术18例[6]。国内仅李帅[7]于2020年报道了2例较大年龄儿童患者在机器人辅助胸腔镜下行肺叶切除术。2020年4月本院引进机器人手术系统,至今已完成小儿外科各类手术400余例。本院为国内较早开展胸腔镜下肺叶切除术的单位之一,前期积累了一定的经验,为机器人辅助胸腔镜下肺叶切除术的顺利开展奠定了基础。
一、机器人辅助胸腔镜下肺叶切除术注意事项小儿胸腔空间较成人小,因此机器人辅助胸腔镜下行小儿肺叶/肺段切除术成功与否与术中Trocar放置位置有关。本院目前应用的机器人手术系统,其镜头的Trocar直径和操作孔Trocar直径均为8 mm;手术要求操作孔之间及操作孔与镜头孔之间的距离不应 < 8 cm。但在实际手术过程中,两个操作孔之间的距离一般不<4 cm,距离越远越有助于手术顺利完成。在建孔的过程中以镜头孔为中心,左右两个操作孔距离中心孔的垂直距离应>4 cm,而辅助孔根据助手的站位建于镜孔和操作孔之间。
本研究中转开腹手术的患者为一例7月龄左肺下叶叶内型隔离肺患者,系开展机器人手术的第3例,当时选择了腋中线布孔,隔离肺的侧支动脉巨大,离断后左下叶淤血明显,不能压缩,空间暴露不良,从而选择中转开胸完成左肺下叶的解剖性切除术。
肺叶/肺段切除术的处理要点是肺动脉和肺静脉的分离和离断。相对部分术者采用抓钳和单极电凝的手术方式而言,本研究采用心包抓钳和双极电凝抓钳进行血管分离,安全性更高,出现血管损伤后的止血处理更迅速。
二、机器人辅助胸腔镜下肺叶切除术的优缺点机器人辅助肺叶/肺段切除术的步骤与常规开胸肺叶/肺段切除术一致,也是先处理肺动脉、肺静脉,最后处理支气管。但相较于胸腔镜下手术,机器人手术具有以下优势:第一,机器人的三维视野较胸腔镜的二维视野在分离解剖过程中更有立体感,给术者更真实的视野,可以更清楚地辨别解剖结构,使得缝合、打结等操作更精准,提高手术的精确性。第二,机器人的机械臂有7个自由度,包括上下、前后、左右运动及机械手的左右、旋转、开合、末端关节弯曲共7种动作,每个关节活动度均>90°,并可作沿水平轴270°和垂直轴360°的旋转,可拥有比真人手腕更加灵活的操作,且可在狭窄的解剖环境中达到比人手更好的效果。第三,机械臂特殊的过滤抖动功能使得医生在完成精细解剖时动作更加精准稳定,降低了副损伤概率。机器人的视野更清楚,操作更灵活,使得手术更精准,损伤更小,出血更少,术后恢复更快。
但是机器人辅助肺叶/肺段切除术也存在一些问题:①在机器人手术中,由于术者不在手术床边,一些紧急的操作(如额外的牵拉、暴露、切割闭合器的使用、快速和精确止血)均需助手独立完成,而助手看到的是二维图像,操作的是胸腔镜器械,完成胸腔镜下手术操作的过程中,会受到机械手臂的干扰、碰撞,所以要求助手必须拥有微创外科的手术经验。一旦手术中出现出血等意外情况,助手要能独立和迅速地完成机器人撤除、开胸并控制出血等紧急操作,故要求助手必须是经验丰富的小儿胸外科医生。②机器人手术费用昂贵。一套最新的机器人手术系统在2 000万左右,且每年需要投入设备维修费用、系统升级费用等。专用的特殊手术器械如Endo-wrist机械臂的成本在40 000元左右,且仅能使用10次,每次使用的成本在4 000元左右,每次手术会用到专用手术器械4~5个,这使得机器人手术费用较传统胸腔镜手术高约30 000元。但两种术式相比较,机器人手术由于拥有传统胸腔镜手术无法比拟的技术优势,具有更为广阔的发展前景。如果能够引入医疗保险,一举解决机器人手术成本费用这一制约其发展的瓶颈,机器人手术必然超越传统胸腔镜手术,成为胸外科微创手术治疗的主流方式。
| [1] |
Rothenberg SS. Thoracoscopic lung resection in children[J]. J Pediatr Surg, 2000, 35: 271-274. DOI:10.1016/s0022-3468(00)90023-x |
| [2] |
谭征, 李建华, 梁靓, 等. 胸腔镜小儿肺叶切除术50例[J]. 中华胸心血管外科杂志, 2017, 33(8): 490-492. Tan Z, Li JH, Liang L, et al. Thoracoscopic lobectomy in children: a report of 50 cases[J]. Chin J Thorac Cardiovasc Surg, 2017, 33(8): 490-492. DOI:10.3760/cma.j.issn.1001-4497.2017.08.009 |
| [3] |
Kolvenbach R, Schwierz E, Wasilljew S, et al. Total laparoscopically and robotically assisted aortic aneurysm surgery: a critical evaluation[J]. Vasc Surg, 2004, 39(4): 771-776. DOI:10.1016/j.jvs.2003.10.050 |
| [4] |
Cook RC, Nifong LW, Enterkin JE, et al. Significant reduction in annuloplasty operative time with the use of nitinol clips in robotically assisted mitral valve repair[J]. J Thorac Cardiovasc Surg, 2007, 133(5): 1264-1267. DOI:10.1016/j.jtcvs.2006.10.079 |
| [5] |
Meehan JJ, Phearman L, Sandler A. Robotic pulmonary resections in children: series report and introduction of a new robotic instrument[J]. J Laparoendosc Adv Surg Tech A, 2008, 18(2): 293-295. DOI:10.1089/lap.2007.0078 |
| [6] |
Cundy TP, Shetty K, Clark J, et al. The first decade of robotic surgery in children[J]. J Pediatr Surg, 2013, 48(4): 858-865. DOI:10.1016/j.jpedsurg.2013.01.031 |
| [7] |
李帅, 汤绍涛, 曹国庆, 等. da Vinci机器人辅助胸腔镜下小儿肺叶切除术的初步经验[J]. 临床小儿外科杂志, 2020, 19(7): 619-621, 647. Li S, Tang ST, Cao GQ, et al. Preliminary experience of thoracoscopic pulmonary lobectomy using da Vinci robotic-system in children[J]. J Clin Ped Sur, 2020, 19(7): 619-621, 647. DOI:10.3969/j.issn.1671-6353.2020.07.011 |
 2021, Vol. 20
2021, Vol. 20


