小细胞性骨肉瘤(small cell osteosarcoma, SCOC)是一种非常罕见的骨肉瘤,约占骨肉瘤的1.3% ~4%。发病年龄与普通骨肉瘤相似,多发生在10~20岁[1, 2]。该病于1979年由Sim等[3]首次发现。这种小细胞骨肉瘤组织学形态类似于尤文氏肉瘤,预后比传统的骨肉瘤更差。其与尤文氏肉瘤的区别在于二者对治疗的反应不同,SCOC不具有放疗敏感性,根治性手术和辅助化疗是目前主要的治疗方式。SCOC组织学特征是小而均匀的圆形肿瘤细胞,这些小圆细胞间可见少量骨样基质,这是骨肉瘤与尤文肉瘤等小圆细胞恶性肿瘤相鉴别的典型形态特征。本研究首次报道1例腓骨SCOC,并对其临床病理特征作简要分析。
患者1岁,因发现走路不稳、右小腿肿胀2个月就诊。体格检查见右小腿近端外侧表皮正常,可触及包块,大小约2.0 cm×2.0 cm×4.0 cm,深压痛阳性,活动时疼痛。于2019年3月住院治疗。右侧胫腓骨正侧位显示:右侧腓骨近端占位,右侧腓骨近端见混杂稍高密度肿块,边界欠清,局部骨质破坏,大小约2.4 cm×3.7 cm×1.4 cm,可见骨膜增生伴破坏(图 1A)。右胫腓骨近端MR显示:右胫腓骨近端占位伴周围多发渗出、水肿,不除外骨肉瘤(图 1B);化疗3周后,右侧胫腓骨正侧位X线片提示右侧腓骨近端混杂稍高密度肿块较前增大,大小约7.0 cm×5.7 cm,边界欠清,骨质破坏范围较前增大,可见骨膜增生伴破坏(图 1C)。
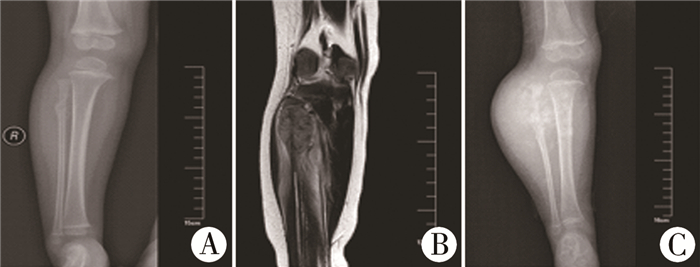
|
图 1 小细胞性骨肉瘤患者影像学资料 注 A:右侧胫腓骨正侧位X线片提示右侧腓骨近端见混杂稍高密度肿块,边界欠清,局部骨质破坏,大小约2.4 cm×3.7 cm×1.4 cm,可见骨膜增生伴破坏;B:右胫腓骨近端MR显示右胫腓骨近端占位伴周围多发渗出、水肿,不除外骨肉瘤;C:右侧胫腓骨正侧位X线片显示右侧腓骨近端混杂稍高密度肿块较前增大,大小约7.0 cm×5.7 cm,边界欠清,骨质破坏范围较前增大,可见骨膜增生伴破坏 Fig.1 Imaging findings of small cell osteosarcoma |
手术取部分肿物做病理活检,术中见腓骨近端肿瘤呈黄白色鱼肉样组织,腓骨近端骨皮质有破坏,钳夹取出部分腓骨骨皮质和骨髓内肿瘤组织。镜下可见瘤细胞圆形,核空泡状,核仁明显,弥漫生长,见钙化坏死,浸润横纹肌,见不定形类骨质(图 2A)。病理检查结果提示腓骨近端小圆细胞恶性肿瘤,考虑小细胞骨肉瘤。免疫组化结果:SATB2(+);Ki-67(40%+);Vimentin(+);P63(-);Syn(-);S-100(-);CD68(-);EMA(-);LCA(-);CK(-);NSE(-);MyoD1(-);Myogenin(-);CD99(-)。
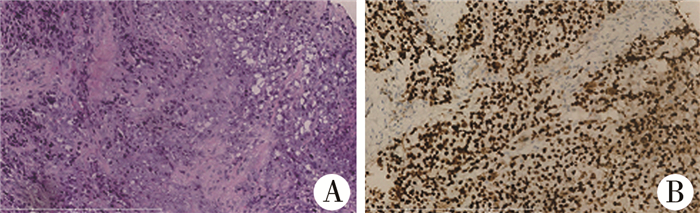
|
图 2 小细胞性骨肉瘤患者病理结果 注 A:肿瘤组织HE染色(200×); B:SATB2免疫组化染色,肿瘤细胞核强阳性表达(200×) Fig.2 Pathological results of small cell osteosarcoma |
组织活检后2周开始化疗,具体方案为盐酸表柔比星注射剂6 mg,D1 - D5;环磷酰胺注射剂0.08 g,D1 - D5;硫酸长春新碱注射剂0.7 mg,D1化疗;一个周期后患者病灶增大伴不适,改用依托泊苷40 mg,D1 - D5,异环磷酰胺注射剂0.8 g,D1 - D5行第二、三、四周期化疗;此方案化疗结束时局部病灶进展,改用安维汀100 mg,D0, 长春新碱0.5mg,D1,D8,伊立体康20 mg,D1 - 5, 替莫唑胺40 mg,D1 - D5行2个周期化疗。
目前随访8个月,患者尚存活,肿物明显增大,双肺及左侧髂骨发现转移(图 3)。现疾病进展为中晚期,多线治疗耐药,无指南推荐有效治疗方案;患者右下肢病灶处疼痛明显,予以吗啡口服止痛治疗,疼痛控制尚可。

|
图 3 小细胞性骨肉瘤患者影像学资料 注 A: 右侧胫腓骨近端MR显示右侧腓骨近端占位伴周围软组织占位较前进一步增大,大小约9.7 cm×7.1 cm×11.1 cm,右侧腓骨骨质破坏范围较前增大,伴病理性骨折;B:骨盆三维CT显示左侧髂骨不规则骨质破坏,骨质密度不均匀,边界不清,局部似见少许骨膜反应,考虑转移;C:胸部CT显示双肺可见新增散在结节影,考虑转移 Fig.3 Imaging findings of small cell osteosarcoma |
讨论 原发性骨肉瘤是骨骼中最常见的原发性高等级肉瘤,呈双峰年龄分布,第一高峰为10岁左右,第二高峰为40岁以上。本研究报道了一例1岁患者腓骨小细胞骨肉瘤,与以往报道相比,发病年龄较小。Bishop等[4]报道了5例SCOC患者,发现疼痛是最常见的临床表现,存在于所有患者中,持续时间为1~20个月。Ayala等[2]研究发现肿物累及部位和肿胀是最常见的症状,与本文报道的患者特征相符。SCOC的发病部位主要在四肢长骨,包括股骨远端(30%)、胫骨近端(15%)和肱骨近端(15%),也有2% ~9%的病例发生于颅面骨[5]。本例发病部位在腓骨近端,该部位发生SCOC较少见。
SCOC需要与原发性骨小圆细胞瘤[尤文肉瘤、原始神经外胚层肿瘤(Ewing sarcoma/primitive neuroectodermal tumor,ES/PNET)、淋巴瘤和间充质软骨肉瘤]相鉴别[6]。各种原发性骨小圆细胞肿瘤均可见单一成片的小圆形细胞,细胞质极少。如果有类骨质的产生,就可诊断为SCOC。类骨质是一团无定形或纤丝状的物质,与ES/PNET中存在的透明胶原蛋白很难区分。与胶原蛋白相比,类骨质具有更多的条状和花边质,边界不明确,缺乏裸露的纤维母细胞核。然而,类骨质的数量通常较少,在缺乏类骨质的情况下,明显的细胞多形性是诊断SCOC的重要特征,而存在Homer Wright菊形团和假菊形团则支持ES/PNET的诊断。此外,有文献表明,评估CD99和SATB2的免疫组化表达有助于区分小细胞骨肉瘤和其他原发性骨小细胞恶性肿瘤[7, 8]。SATB2是成骨细胞分化的标志物,在小细胞骨肉瘤中,SATB2核表达均较强。CD99在ES/PNET中通常呈强阳性表达,而阴性结果或少数细胞有胞浆弱阳性表达则支持诊断SCOC。本病例的免疫组化结果符合SCOC。分子检测在鉴别诊断中也起到重要作用,EWSR1-FLI1融合基因t(11;22)(q24;q12)是诊断ES/PNET的指标,SCOC病例未发现EWSR1-FUS基因重排。间充质软骨肉瘤发生在较年长的年龄组,其特征是两个细胞群: 小圆细胞成分和软骨样基质相关的腔隙细胞。软骨样基质S100染色灶阳性,原始间充质细胞CD99阳性。淋巴瘤细胞与SCOC相比,细胞核较大,染色质呈泡状,核仁突出,可见淋巴腺体,白细胞共同抗原阳性表达。
此外,SCOC还需要与转移性神经母细胞瘤和横纹肌肉瘤鉴别。转移性神经母细胞瘤的肿瘤细胞呈典型菊形团样排列。神经母细胞瘤对Syn和CgA有免疫反应,但对CD99几乎没有免疫反应。在横纹肌肉瘤中,可见三角形的、带状的横纹肌母细胞,其细胞质呈强嗜酸性,免疫组化染色Desmin、myogenin和MyoD1阳性。
虽然小细胞性骨肉瘤的发病率很低,但是由于SCOC的预后较普通骨肉瘤和尤文肉瘤更差,并且治疗方案不同,因此准确的诊断骨肉瘤这种特殊的亚型就显得十分重要。SCOC对放疗不敏感,积极的根治性手术加多药辅助化疗是其主要的治疗方式。
| [1] |
Nakajima H, Sim FH, Bond JR, et al. Small cell osteosarcoma of bone: Review of 72 cases[J]. Cancer, 1997, 79(11): 2095-2106. |
| [2] |
Ayala AG, Ro JY, Raymond AK, et al. Small cell osteosarcoma.A clinicopathologic study of 27 cases[J]. Cancer, 1989, 64(10): 2162-2173. |
| [3] |
Sim FH, Unni KK, Beabout JW, et al. Osteosarcoma with small cells simulating Ewing's tumor[J]. Journal of Bone and Joint Surgery, 1979, 61(2): 207-215. DOI:10.2106/00004623-197961020-00008 |
| [4] |
Bishop JA, Shum CH, Sheth S, et al. Small cell osteosarcoma cytopathologic characteristics and differential diagnosis[J]. American Journal of Clinical Pathology, 2010, 133(5): 756-761. DOI:10.1309/AJCPO07VGDZCBRJF |
| [5] |
Bose B. Primary osteogenic sarcoma of the skull[J]. Surgical Neurology, 2002, 58(3): 234-239. DOI:10.1016/s0090-3019(02)00864-9 |
| [6] |
Hameed M. Small round cell tumors of bone[J]. Archives of Pathology & Laboratory Medicine, 2007, 131(2): 192. DOI:10.1043/1543-2165(2007)131[192:SRCTOB]2.0.CO;2 |
| [7] |
Righi A, Gambarotti M, Longo S, et al. Small cell osteosarcoma[J]. The American Journal of Surgical Pathology, 2015, 39(5): 691-699. DOI:10.1097/PAS.0000000000000412 |
| [8] |
Bishop JA, Shum CH, Sheth S, et al. Small cell osteosarcoma cytopathologic characteristics and differential diagnosis[J]. American Journal of Clinical Pathology, 2010, 133(5): 756-761. DOI:10.1309/ajcpo07vgdzcbrjf |
 2021, Vol. 20
2021, Vol. 20


