目前,我国先天性心脏病(congenital heart disease, CHD) 发病率约为1%,位列新生儿出生缺陷首位[1, 2]。虽然CHD患者早期生存率随着心脏外科手术及围术期管理技术的显著进步而改善[3], 但CHD患者术后远期仍存在一些影响生活质量的问题,如运动耐量受损或运动耐量水平低[4, 5]。随着心脏康复认识水平的不断提高,CHD儿童心脏康复问题在国际上越来越受到重视[6]。CHD手术后优化儿童体育活动的优势逐渐体现并应用于实践中[7]。但能否参与运动的前提是要准确评估患者的运动能力。事实上,心肺运动试验(cardiopulmonary exercise test, CPET)作为评估健康状况和制定/咨询运动处方的基础,已经成为量化健康人群或疾病患者有氧运动能力的“金标准”[8]。尽管诸多研究报告探索了CPET对CHD患者手术后的意义,并建议将此检测项目作为成人和儿童CHD患者临床随访的一部分,定期进行评估[9, 10];但目前CPET仍未在儿童人群中得到广泛实施,尤其是在发展中国家。获取更多关于儿童CHD手术后有氧运动能力的数据,对更好地普及此类患者手术后心脏运动康复具有重要的指导意义。
因此,本研究对2018年12月至2020年12月在广州市妇女儿童医疗中心心血管专科门诊随访的502名6~18岁CHD手术后患者进行横断面调查,通过对符合标准的CHD手术后患者及健康儿童进行CEPT,比较不同疾病分类及手术方式的CHD患者与健康儿童心肺运动功能的差异,从而为制定CHD手术后患者的运动方案提供依据。
材料与方法 一、研究对象本研究对2018年12月至2020年12月在广州市妇女儿童医疗中心接受心脏畸形纠治手术并在心血管专科门诊规律随访的502名CHD患者进行CPET测试。另招募186名健康儿童作为对照组参与研究,健康对照组儿童来源于广州市妇女儿童医疗中心工作人员家庭的儿童和志愿参与CPET评估的儿童保健门诊儿童。
CHD患者入选标准:①6岁≤年龄<18岁;②明确诊断为CHD并已进行外科手术或内科介入治疗;③已完成解剖或功能纠治手术。排除标准:①发烧、哮喘发作期、呼吸衰竭、急性心肌炎或心包炎;②影响血流动力学的心律失常、急性心力衰竭、急性肺栓塞或肺梗塞;③仅完成阶段性姑息手术,如体肺分流术、上腔静脉肺动脉连接术、肺动脉环缩术等;④患无法合作或不配合的精神障碍疾病;⑤患有除已知心血管疾病和肥胖等任何其他慢性疾病;⑥即使经过口头鼓励仍不能配合完成全过程测试和运动测试,并且在达到最大能力之前被终止的参与者。
二、病例分组将CHD患者根据解剖学和临床分类、病理生理特征和复杂性类型进一步分为三个亚组:简单先天性心脏病组(SCHD组)、复杂先天性心脏病组(CCHD组)、全腔静脉肺动脉连接术组(TCPC组)。简单先天性心脏病定义为单纯的房间隔缺损(atrial septal defect, ASD)、室间隔缺损(ventricular septal defect, VSD)、动脉导管未闭(patent ductus arteriosus, PDA)和轻- 中度肺动脉狭窄(pulmonary stenosis, PS)[11]。SCHD组中有4名患者因术后存在持续性肺动脉高压而给予波生坦治疗。CCHD组包括除简单先天性心脏病以外的其他完成双心室矫正的先天性心脏病患者。TCPC组为全腔静脉肺动脉连接术患者。所有入选患者按照纽约心功能分级(New York Heart Association, NYHA)为Ⅰ级或Ⅱ级,详见表 1。
| 表 1 502名CHD患者基本特征 Table 1 Basic profiles of congenital heart disease children |
|
|
该研究方案经广州妇女儿童医疗中心医学伦理委员会批准(编号:2018120401),并按照赫尔辛基宣言及其后来的修正案进行。已获得所有符合条件的儿童及其父母的知情同意。
三、采集数据1. 测试前收集临床数据:包括性别、出生日期、体重(kg) 和身高(m)、NYHA评分、药物治疗、心脏手术日期和类型以及最近一次的氨基末端B型脑钠肽原(N-terminal pro brain natriuretic peptide, NT-proBNP)水平。
2. 静态肺功能数据:在开始CPET测试时,应用CPET测试系统检测患者的静息肺功能状态。采用流速测定型肺量计和呼/吸双相流速容量测定,通过液晶荧屏实时显示最大自主通气、呼/吸双相的流速及容积,测定患者静息通气功能。主要检测指标包括:用力肺活量(forced vital capacity, FVC)、一秒用力肺活量(forced expiratory volume in 1s, FEV1)、两者的比值(FEV1/FVC)及最大通气量(maximum ventilatory volume, MVV)等。
3. CPET数据:所有参与者采用GE公司(GE Healthcare, Little Chalfont, UK)生产的心肺运动测试系统,运动仪器为活动平板,采用美国运动医学院(American College of Sports Medicine, ACSM)推荐的递增功率布鲁斯方案,在医师的监督下进行症状限制性最大量心肺运动试验。当参与者表现出主观的难以忍受症状,无法再继续试验,或者当参与者在强烈的口头鼓励下达到最大的努力时,测试被终止。试验前根据QUARK PFT 4 ERGO心肺运动仪说明书进行气体定标和校准。患者在CPET前不停用心血管药物。同步记录运动过程中每一次呼吸时的气体交换指标、心率、血压、心电图和血氧饱和度等数据。运动试验结束后计算CPET指标参数,主要包括:最大千克体质量摄氧量(max oxygen consumption, VO2 max/kg)、最大千克体质量摄氧量占预测值的百分比(percent predicted max VO2, VO2 max%)及二氧化碳通气当量斜率(ventilatory equivalent of carbon dioxide slope, VE/VCO2 Slope)、达到无氧阈时摄氧量(VO2/kg at AT)、氧脉(oxygen pulse, O2/HR)、千克体质量摄氧效率斜率(oxygen uptake efficiency slope, OUES/kg)、峰值通气量(ventilation, VE)、峰值心率(Peak HR)等。
四、统计学处理采用SPSS 19.0统计学软件进行数据的整理与分析。对于身高、体重等服从正态分布的连续性计量资料采用均值加减标准差(x±s)表示,多组间比较采用方差分析,两组间比较采用独立样本t检验。对于NT-proBNP水平等不服从正态分布的连续性计量资料,采用中位数和四分位间距[M(P25, P75)]表示,多组间比较采用Kruskal-Wallis检验,两组间比较采用Wilcoxon秩和检验。对于性别、NYHA分级等计数资料采用频数分析,多组或者两组间比较采用卡方或Fisher精确概率法。根据变量的分布,使用Pearson或Spearman系数进行相关性分析。在所有CHD儿童与对照组的比较中,采用按性别和年龄调整的广义线性模型。采用多元线性回归方法对先天性心脏病患者VO2 max的解释因素(特别是年龄)进行识别。以P < 0.05为差异有统计学意义。
结果 一、临床资料比较所有患者的人口学数据和临床特征如表 2所示,四组年龄、性别、体表面积(body surface area, BSA)等临床特点均相匹配,先心病亚组间手术年龄差异无统计学意义(P>0.05)。对照组儿童体质量指数(body mass index, BMI)、身高、体重均高于先心病组(P < 0.001),但先心病各亚组的身高、体重、BMI差异无统计学意义(P>0.05)。
| 表 2 先天性心脏病儿童和健康儿童的临床特征 Table 2 Clinical characteristics of children with congenital heart disease and healthy children |
|
|
矫正年龄和性别后,CHD组的VO2 max低于对照组[(36.70±6.36) vs.(43.7±5.7)mL·min-1·kg-1,P < 0.001)。如图 1所示,矫正年龄后,CHD组中,男童VO2 max相比女童明显升高[(37.58± 6.25)vs.(35.58±6.36)mL·min-1·kg-1,P < 0.001];CHD组和对照组VO2 max%分别为(83±15) %和(98±15)%,差异有统计学意义(P < 0.001)。CHD组和对照组VO2 max%在80%以上者比例分别为60.4%和96.1%,差异有统计学意义(P < 0.001)。其中,CHD组中男性和女性VO2 max%在80%以上者占比均低于对照组(男性:61.8% vs.93.3%,P < 0.001;女性:58.8% vs.100%,P < 0.001)。但男性和女性VO2 max%在80%以上者占比差异无统计学意义(男性:61.8% vs.女性:58.8%,P=0.68),对照组男性和女性的VO2 max%比较差异无统计学意义(男性:93.3% vs.女性:100.0%,P=0.053)。
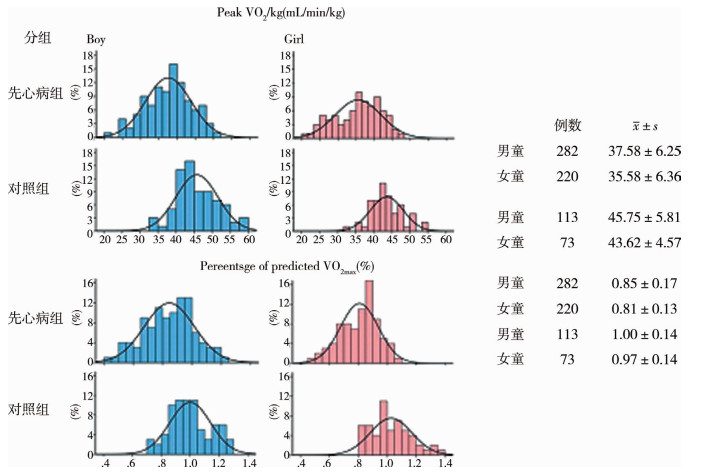
|
图 1 CHD组和对照组VO2和VO2 max%的分布 Fig.1 Peak VO2/kg and percentage of predicted VO2 max for CHD and control groups |
先心病三组(SCHD组、TCPC组、CCHD组)的VO2 max、VO2 max%、O2/HR、峰值VE和OUES/kg值明显低于对照组(P < 0.05),见表 3。TCPC组相较于SCHD组在VO2 max、VO2 max%、VO2/kg at AT、O2/HR、VE/VCO2 slope、OUES/kg方面显著降低(P < 0.05)。CCHD组相较于SCHD组在VO2 max、VO2 max%、OUES/kg和Peak HR值方面较低(P < 0.05)。TCPC组和CCHD组VO2 max、VO2 max%、VO2/kg at AT、O2/HR、VE/VCO2 slope和OUES/kg有显着差异(P < 0.05)。
| 表 3 CHD各亚组及对照组CEPT参数比较(x±s) Table 3 CPET results in children with TCPC, complex congenital heart disease, simple congenital heart disease and healthy children(x±s) |
|
|
采用Pearson相关分析影响CHD患者VO2 max和VO2 max%的相关因素,结果如表 4所示,年龄、性别、疾病分类、NYHA评分、BMI和BSA在不同侧面影响着CHD儿童的心肺功能。NT-proBNP与VO2 max之间无显著相关性(r=0.001,P=0.988),NT-proBNP与VO2 max%之间亦无相关性(r=0.01,P=0.84),广义线性模型也得到了类似的结果(表 4)。
| 表 4 影响不同组别CDH患者VO2 max和VO2 max%的相关因素 Table 4 VO2 max and % predicted VO2 max explanatory variables in CHD children |
|
|
采用多个广义线性模型分析CHD各亚组VO2 max和VO2 max%与年龄的关系(图 2)。在四组中,VO2 max(TCPC组:r=-0.49,P=0.001;CCHD组:r=-0.41,P < 0.001;SCHD组:r=-0.44,P=0.001;对照组:r=0.27,P < 0.002)和VO2 max% (TCPC组:r=-0.45,P < 0.002;CCHD组:r=-0.34,P < 0.001;SCHD组:r=-0.28,P < 0.04;对照组:r=0.17,P < 0.004)与年龄有关。与TCPC组、CCHD组和SCHD组年龄较小的患者相比,年龄较大的儿童VO2 max和VO2 max%较低。然而,在健康儿童中没有看到这种趋势。根据广义线性模型估算,CHD患者VO2 max每年下降2.26 mL·min-1·kg-1,相应的VO2 max%下降5.0%。在TCPC组中,儿童的VO2 max和VO2 max%平均下降率最高(3.05 mL·min-1·kg-1,相应VO2 max%下降8.0%)。

|
图 2 CHD各亚组VO2 max和VO2 max%与年龄的关系 Fig.2 Box plots showing peak VO2/kg and %predicted VO2 max of during different age groups in SCHD, CCHD, TCPC and control groups |
CPET的使用在我国开始较晚,由于缺乏推广意识,在儿科心脏病学领域的应用有限。本研究旨在评估接受不同心脏矫正手术干预的CHD儿童和青少年的最大运动耐量,以及影响运动耐量的可能因素。本研究填补了我国儿童心脏手术后心脏康复领域研究的空白。
本研究结果显示,60%的CHD儿童VO2 max%超过80%,平均VO2 max%为83%,说明该类患者手术后的生活质量非常接近或等于正常[12]。其中12%的简单CHD儿童运动耐量较正常水平下降(VO2 max%小于预测的80%),这与大多数简单CHD患者的父母并没有发觉他们的孩子运动耐力明显低于同龄人的事实是一致的。Zaqout等[13]研究报道,CHD儿童与健康儿童的情况略有不同,但没有显著差异,该结果与本研究结果基本一致。此外,本研究结果显示,CCHD组患者平均VO2 max%为82%,相应65%的完成双心室矫正的复杂CHD儿童表现为运动耐量正常(VO2 max%超过80%)。考虑该亚组患者运动耐量下降的原因可能是该亚组中37.8%的疾病类型是法洛四联症(tetralogy of fallot, TOF)和肺动脉闭锁(pulmonary atresia, PA),部分患者可能有右心室收缩压增高,中度甚至严重三尖瓣反流,或远端肺动脉发育不良,另有部分患者存在解剖残留。此外,家庭成员对CHD的认识不足、焦虑、对病人健康状况的扭曲看法,学校制止CHD患者做体育锻炼,父母过度保护和缺乏获得安全、愉快的体育活动的机会等,均会影响到CHD患者术后康复的效果。
本研究数据表明,TCPC组仅有22名(27.9%)患者VO2 max与预测值的占比>80%,这与Paridon等[14]的研究结果基本一致。Paridon等[14]研究中,411名接受Fontan手术儿童的心肺运动试验结果提示,约28%的患者VO2 max的预测值>80%。与CCHD和SCHD亚组相比,TCPC组的O2/HR和OUES/kg值明显较低,且VE/VCO2 slope明显更高。该结果与既往研究一致[15],并推测这些患者的骨骼肌质量下降、BMI下降、持续开窗和肺前向血流降低可能与此结果有关。
本研究观察到健康对照组儿童VO2 max和VO2 max%随年龄增长而上升的趋势,该特点符合正常儿童体格发育的规律,即年龄越大的儿童运动耐量越好。然而,CHD术后儿童中,处于青春期阶段的儿童相较于学龄期儿童的VO2 max和VO2 max%反而偏低,CHD各亚组均可见此规律。考虑原因可能是该研究中年龄较大的儿童手术年龄较年龄较小的儿童偏晚,由此可推测,年龄较大的CHD术后儿童完成心脏手术后在一段时间内运动耐量仍低于年龄较小的CHD术后儿童。这与Giardini[16]研究结果基本相符。Giardini等研究认为,手术年龄的早晚可能对运动耐量有影响,尤其是TCPC组手术年龄对术后运动耐量的恢复有很大影响。由于本研究为横断面研究,尚不能体现不同CHD术后儿童的VO2 max和VO2 max%随年龄变化的规律,如需进一步探究,建议进行长期连续纵向随访。
同时,本研究发现TCPC组有3名初始诊断为完全型大动脉转位合并室间隔缺损伴肺动脉狭窄患者,其运动能力低于CCHD组有相同诊断的2名患者(平均VO2 max%为62% vs.69%)。这提示不同的手术方法可能会影响患者当时的情况。因此,在那些行双心室矫正的人群中,运动耐量可能优于那些行Fontan手术的人群。
由于本研究为单中心研究,在样本数量上受限,且部分患者家长可能由于经济原因,不愿意接受CPET测试,甚至停止定期随访,故存在一定局限性。此外,不同年龄组的人口分布也存在不平等的问题,为了证实不同类型CHD儿童的VO2 max随年龄下降的趋势,连续纵向研究将比横断面研究更有说服力。
综上所述,虽然双心室矫正后简单和复杂CHD儿童的平均整体体质与健康人群显著不同,但其运动耐量接近正常(VO2 max%>80%)。相较而言,TCPC组的运动能力要低得多。故建议实施CHD矫正治疗后的儿童可以更自信地锻炼,以获得更好的身体素质。
| [1] |
黄国英. 我国开展新生儿先天性心脏病筛查的重要性[J]. 中华儿科杂志, 2017, 55(4): 241-243. Huang GY. Importance of conducting screening for neonatal congenital heart diseases in China[J]. Chinese Journal of Pediatrics, 2017, 55(4): 241-243. DOI:10.3760/cma.j.issn.0578-1310.2017.04.001 |
| [2] |
Qu Y, Liu X, Zhuang J, et al. Incidence of Congenital Heart Disease: The 9-Year Experience of the Guangdong Registry of Congenital Heart Disease, China[J]. PLoS One, 2016, 11(7): e159257. DOI:10.1371/journal.pone.0159257 |
| [3] |
Shi L, Zhai B, Yang F, et al. Emergency primary repair of critical congenital heart disease in neonates and infants[J]. J Clin Ped Sur, 2018, 17(12): 931-934. DOI:10.3969/j.issn.1671-6353.2018.12.012 |
| [4] |
Singh TP, Curran TJ, Rhodes J. Cardiac rehabilitation improves heart rate recovery following peak exercise in children with repaired congenital heart disease[J]. Pediatr Cardiol, 2007, 28(4): 276-279. DOI:10.1007/s00246-006-0114-0 |
| [5] |
Amedro P, Picot MC, Moniotte S, et al. Correlation between cardio-pulmonary exercise test variables and health-related quality of life among children with congenital heart diseases[J]. Int J Cardiol, 2016, 203: 1052-1060. DOI:10.1016/j.ijcard.2015.11.028 |
| [6] |
Sandberg C, Hedstr MM, Wadell K, et al. Home-based interval training increases endurance capacity in adults with complex congenital heart disease[J]. Congenit Heart Dis, 2018, 13(2): 254-262. DOI:10.1111/chd.12562 |
| [7] |
Takken T, Giardini A, Reybrouck T, et al. Recommendations for physical activity, recreation sport, and exercise training in paediatric patients with congenital heart disease: a report from the Exercise, Basic & Translational Research Section of the European Association of Cardiovascular Prevention and Rehabilitation, the European Congenital Heart and Lung Exercise Group, and the Association for European Paediatric Cardiology[J]. Eur J Prev Cardiol, 2012, 19(5): 1034-1065. DOI:10.1177/1741826711420000 |
| [8] |
Guazzi M, Arena R, Halle M, et al. 2016 focused update: clinical recommendations for cardiopulmonary exercise testing data assessment in specific patient populations[J]. Eur Heart J, 2018, 39(14): 1144-1161. DOI:10.1093/eurheartj/ehw180 |
| [9] |
Baumgartner H, Bonhoeffer P, De Groot NM, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010)[J]. Eur Heart J, 2010, 31(23): 2915-2957. DOI:10.1093/eurheartj/ehq249 |
| [10] |
Amedro P, Gavotto A, Guillaumont S, et al. Cardiopulmonary fitness in children with congenital heart diseases versus healthy children[J]. Heart, 2018, 104(12): 1026-1036. DOI:10.1136/heartjnl-2017-312339 |
| [11] |
Buratto E, Ye XT, Konstantinov IE. Simple congenital heart disease: a complex challenge for public health[J]. J Thorac Dis, 2016, 8(11): 2994-2996. DOI:10.21037/jtd.2016.11.45 |
| [12] |
Hossri CA, Souza I, de Oliveira JS, et al. Assessment of oxygen-uptake efficiency slope in healthy children and children with heart disease: Generation of appropriate reference values for the OUES variable[J]. Eur J Prev Cardiol, 2019, 26(2): 177-184. DOI:10.1177/2047487318807977 |
| [13] |
Zaqout M, Vandekerckhove K, Michels N, et al. Physical fitness and metabolic syndrome in children with repaired congenital heart disease compared with healthy children[J]. J Pediatr, 2017, 191: 125-132. DOI:10.1016/j.jpeds.2017.08.058 |
| [14] |
Paridon SM, Mitchell PD, Colan SD, et al. A cross-sectional study of exercise performance during the first 2 decades of life after the Fontan operation[J]. J Am Coll Cardiol, 2008, 52(2): 99-107. DOI:10.1016/j.jacc.2008.02.081 |
| [15] |
Muller J, Ewert P, Hager A. Only slow decline in exercise capacity in the natural history of patients with congenital heart disease: a longitudinal study in 522 patients[J]. Eur J Prev Cardiol, 2015, 22(1): 113-118. DOI:10.1177/2047487313505242 |
| [16] |
Giardini A, Hager A, Pace Napoleone C, et al. Natural history of exercise capacity after the Fontan operation: a longitudinal study[J]. Ann Thorac Surg, 2008, 85(3): 818-821. DOI:10.1016/j.athoracsur.2007.11.009 |
 2021, Vol. 20
2021, Vol. 20


