先天性心脏病(简称先心病)自2005年起始终占据我国出生缺陷的首位,严重危害儿童的健康和生活质量,是我国5岁以下儿童的主要死亡原因[1, 2]。产前诊断使先心病的诊疗计划延伸到产前,有利于科学控制先心病的出生率,避免不必要的引产,提前预测胎儿出生后的病情变化,消除复杂先心病出生后的急危重状态[3]。产前诊断和产后治疗一体化模式进一步发挥产前诊断的优势,使先心病的诊治从产前到生后保持连续性,进而减少先心病对儿童生存和生长发育的影响[4]。目前胎儿超声心动图仍是产前诊断先心病的主要手段,其灵敏度高达90%[5]。近几年,我国产前超声筛查率也从80%提升到了95%,出生缺陷发生率总体呈逐年下降的趋势,但先心病的出生率呈逐年上升趋势,这与先心病产前诊断不足、产后筛查不足密切相关[1, 2]。因此探索符合中国国情的先心病产前产后一体化管理策略,标准化先心病产前诊断筛查流程,提高围产期先心病的产前产后诊断一致性,以进一步降低严重出生缺陷的发生率,同时减少不必要的引产,具有重要的社会意义。
材料与方法 一、临床资料本研究为前瞻性队列研究,研究对象的入选标准为2018年1月至2019年12月在江苏省无锡市妇幼保健院(产院1)及昆山市妇幼保健院(产院2)孕早期建卡立档,孕早、中、晚期定期行产前检查,终止妊娠或分娩及进行产后新生儿先心病筛查的孕妇。排除标准为未进行孕早、中、晚期规律产检、或未分娩或未在上述二家产院进行分娩的孕妇。共纳入70 805例孕产妇。2018年产院1接受产检至分娩/终止妊娠的产妇数为13 477例,产院2为22 924例;2019年产院1接受产检及分娩/终止妊娠的产妇14 056例,产院2为20 348例。研究终点时间为2020年12月31日。新生儿定义为出生后42天以内。将所有围产期心脏异常的胎儿和新生儿病例作为研究对象。
二、研究方法1. 孕妇产前检查及诊断技术:所有孕妇在妇幼保健院建卡进行规律产检。孕早期12周左右进行常规超声检查。孕中期22周左右进行大排畸超声检查,对孕20~24周孕妇进行孕中期Ⅱ级胎儿超声心动图筛查,超声标准切面包括腹部横切面、四腔心切面、左室流出道切面、右室流出道切面、三血管气管切面。对筛查阳性病例由两位高年资医生共同做出诊断,进一步行胎儿超声心动图检查以明确先心病类型;继续妊娠者进行染色体检查,确认无染色体异常后,于首次检查后4周和孕37周分别复查胎儿超声心动图,观察疾病进展,评估胎儿心功能。产前诊断危重型先心病胎儿分娩时,予实时评估患者心脏情况。其他围产期心脏异常的病例于生后72 h内行超声心动图检查。围产期先心病筛查诊断流程见图 1。
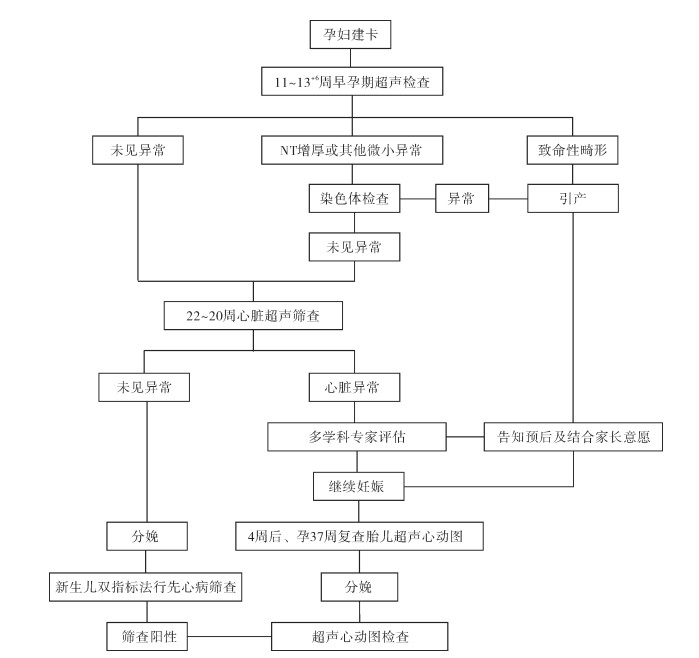
|
图 1 围产期先心病筛查诊断流程 Fig.1 Screening and diagnostic process of perinatal congenital heart diseases |
2. 产前多学科咨询:本研究依据中国心脏出生缺陷一体化诊疗协作组专家组撰写的专家共识[6],对围产期胎儿心脏出生缺陷进行科学、细化、规范的诊断及临床评估。根据胎儿先心病诊断及围产期管理专家共识进行多学科咨询[7],多学科咨询包括超声诊断医师、产科医师、儿科心血管医师、新生儿医师、遗传咨询医师等。本研究中部分病例超声诊断后由当地医院发起远程会诊,由复旦大学附属儿科医院相关专业组医师进行远程多学科会诊,结合孕妇具体情况,评估确定终止或继续妊娠,而是否进行产前多学科咨询完全遵循孕妇及家庭意见。
3.转运方式:由于本研究中的2家妇幼保健院均不具有先心病救治能力,需要产前根据多学科评估结果,按专家共识[6]对于Ⅳ级及部分Ⅲ级危重病例进行宫内转运。
4. 产后筛查:新生儿先心病筛查采用“双指标法”,即采用心脏听诊和脉搏血氧饱和度检测两项指标。对出生6~72 h内的新生儿进行先心病筛查[8]。对产前诊断胎儿先心病患者及产后筛查阳性病例进行超声心动图检查,并作为确诊依据。
5. 围产期治疗:由于国内尚无明确的专家共识或相关指南,本研究无病例纳入产前治疗。对于产后危重先心病治疗,体循环或肺循环动脉导管和(或)房间隔缺损依赖的危重型先心病,早期给予重症监护及干预,禁止吸氧,药物或支架维持动脉导管开放、球囊房隔造口术、球囊扩张肺或主动脉瓣等介入治疗或急诊外科手术治疗。综合评价新生儿期急诊心导管检查术、心脏介入手术(包括镶嵌手术)、心脏外科手术的风险与利弊,选择最佳个体化干预的时机及方式。
结果 一、基本情况70 805例建卡孕妇中,孕早期体检阳性821例(1.16%),其中颈后透明层(nuchal translucency, NT)阳性525例,NT阳性病例中心脏筛查阳性41例,其他阳性296例。孕中期整体发现NT阳性病例1 326例(1.88%),其中心脏筛查阳性729例,包括孕早期发现心脏畸形继续妊娠病例,由于心脏畸形引产291例,其他系统阳性597例,非心脏畸形引产119例。晚孕期新发现心脏筛查阳性病例22例。双指标法先心病筛查率99.98%,筛查阳性率2.1%(1 470/69 996)。95%的筛查阳性病例及所有产前心脏畸形病例进行了超声心动图的检查评估,见图 2。
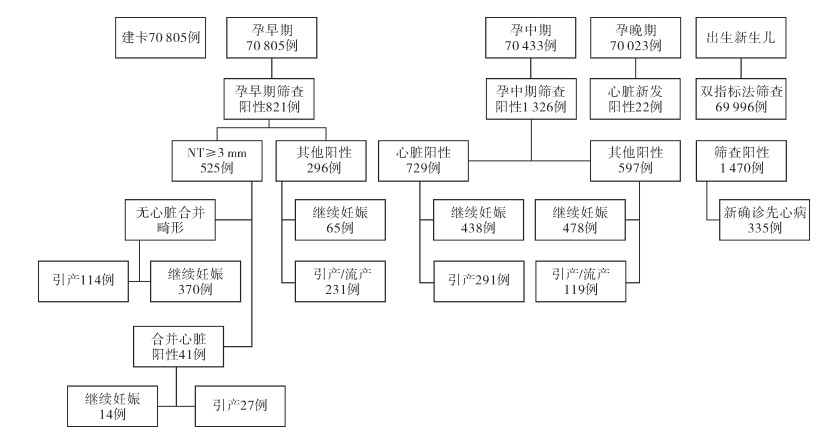
|
图 2 围产期先心病筛查结果 Fig.2 Screening results of perinatal congenital heart diseases |
围产期心脏筛查阳性及转归见表 1。由于本研究未对所有出生新生儿进行超声心动图检查,因此可能存在双指标法筛查阴性(假阴性)的先心病患者,本研究中没有将这部分患者剔除。如表 1所示,引产主要发生于法洛四联征及更为严重的复杂先心病,特别是单心室类预后不佳的复杂先心病,其引产率达100%。保留的疾病多为房间隔缺损、室间隔缺损等简单先心病及主动脉缩窄等预后相对较好的复杂先心病。但是对于部分简单先心病和部分正常心脏结构变异仍有一定的引产率。
| 表 1 围产期心血管阳性事件及转归 Table 1 Positive events and outcomes of cardiovascular diseases during perinatal period |
|
|
1. 围产期心脏筛查阳性产前咨询、转运:自2018年1月起,根据孕妇及家属意愿,共进行围产期先心病产前咨询220人次,进行咨询后未引产人数为164人次,保留率为74.5%。同期未进行产前先心病相关咨询人数572例,引产262例,保留率54.2%,差异有统计学意义(χ2=27.38,P=0.001)。
共宫内转运先心病胎儿及孕妇13例,8例剖宫产,5例自然分娩,分娩同时由新生儿重症医学医生、儿童心血管专科医生在产房待命,产后即转运至本单位,绿色通道进入新生儿重症病区监护,同时进行完善的术前评估。经产前诊断,产后新生儿转运37例,无一例转运中发生死亡。37例新生儿先心病包括主动脉缩窄22例,肺动脉瓣狭窄11例,法洛四联征2例,室间隔缺损2例。
2. 治疗结果:13例产前诊断Ⅳ级及部分Ⅲ级危重病例将孕妇转运至本单位后,完善术前评估,均接受急诊/亚急诊手术治疗[9]。13例中男8例,女5例,体重2.3~3.6 kg,手术前诊断为完全性大动脉转位/室间隔完整4例,肺动脉闭锁/室间隔完整2例,完全性肺静脉异位引流3例,主动脉弓离断1例,极重度肺动脉瓣狭窄3例。全组手术年龄16 h至4 d,手术方式:大动脉调转术4例、肺静脉异位引流纠治术3例,主动脉弓重建1例,肺动脉瓣经皮穿刺球囊扩张术5例。全组无手术死亡病例,住院14~32 d,无严重手术并发症。37例产后转运新生儿中25例进行了亚急诊手术治疗,包括13例外科主动脉缩窄纠治术,9例主动脉缩窄球囊扩张术,3例肺动脉瓣狭窄球囊扩张术。25例手术年龄7~14 d,无手术死亡病例,全组住院18~28 d,无严重手术并发症。
讨论随着产前诊断技术飞速发展,先心病内外科治疗技术愈发成熟,产前产后一体化诊治模式符合先心病早发现、早诊断、早治疗的模式。由于目前绝大多数先心病产后可以治疗并且有一定的疗效,引产已不再成为产前诊断先心病的唯一抉择[3, 4]。国内已有一些文献对产前诊断为先心病的患者进行随访研究,但尚缺乏大样本的关于围产期先心病前瞻性队列研究[10]。本研究历时3年,为首个较大样本的双中心研究,对七万余例孕妇胎儿进行全孕期至出生后42天的随访研究,得到了胎儿期先心病的疾病谱。国内的现状在于产前诊断先心病的家庭接收来自产科医生有关先心病治疗的信息有限,且由于对心脏先天性畸形的恐惧,造成引产率居高不下;此外,由于边远贫困地区产前筛查和救治手段的不足,危重复杂先心病产后不能得到及时救治,放弃率和病死率难以控制。有文献表明,多学科咨询是是胎儿先心病围产期管理最理想的方式[7]。但是否继续妊娠,除了多学科会诊、一体化诊疗模式外,先心病胎儿的转归由其自身状况、孕妇和家庭的态度、当地先心病救治水平决定。据文献报道胎儿遗传性疾病往往合并包括先心病在内的多发畸形,而且许多先心病患者也会合并其他综合征[11]。诊断先心病的胎儿需要通过羊水或脐血检查,排除遗传性疾病和多发畸形,才能考虑是否保留胎儿。本研究同样采用多学科一体化管理模式,对有咨询意愿的孕妇家庭提供相关咨询服务。由于先心病病种繁多,严重程度跨度大,且存在伴发遗传性疾病或心外畸形的可能,或是某些综合征的部分表现,检出后应如何应对?本研究中心多学科团队由超声诊断医师、产科医师、儿童心血管医师、新生儿医师、遗传咨询医师等组成,有助于科学合理解决先心病的胎儿期进展、产后治疗方式及预后、随访等问题,与未进行多学科咨询的孕妇组相比,切实降低了先心病胎儿的引产率。但是对于产前诊断的复杂先心病,保留率与国外相比仍然非常低,例如单心室类引产率100%,随着国内经济的发展,人群思维方式的转变,经过多学科会诊这部分病例的保留率会逐渐得到提高。
国内各级医疗单位的先心病诊治水平参差不齐,对于怀疑胎儿先心病的孕妇应到专业的先心病治疗中心进行诊断和咨询,在与先心病治疗中心有密切联系的产科分娩,使危重、复杂先心病新生儿的紧急护送转变为平稳的孕妇转运[12]。对于危重型先心病选择宫内转运的预后要优于产后转运,故宫内转运是目前提高危重型先心病生存率的有效方法。产后通过复查超声心动图可以尽早明确诊断,不仅可以验证产前诊断的准确性,还可以为产后指导治疗提供参考。如果产后才发现新生儿患有先心病,尤其是患有复杂先心病的患者,就诊时多存在严重缺氧、酸中毒、心力衰竭等急危症情况,这样会增加手术风险[13, 14]。由此可见,基于多学科模式分析孕妇和胎儿状况进行有效评分,有利于协助产科、心血管专科等医师判断患者的疾病状态和整体情况,做出是否继续妊娠或引产的决定,以及选择恰当的分娩、转运和治疗方式。对于部分严重复杂先心病的胎儿,在有效产前评估的前提下,也可以进行产后转运。本研究共进行宫内转运13例,全部进行了急诊/亚急诊手术治疗;产后转运37例,对其中25例进行了亚急诊手术治疗,并取得了满意的疗效,这要归结于病情的准确评估、手术时机的准确把握和手术方法的合理选择。
由于目前产前胎儿超声心动图的先心病诊断率在90%左右[5],仍有一定比例的先心病被误诊、漏诊,本课题组利用已有的双指标法筛查新生儿先心病,可以有效弥补这一不足[9]。本研究产后先心病的双指标法筛查率为99.98%,阳性率2.1%,超声心动图复核率为95%,基本达到了胎儿及新生儿的全覆盖。除了产前难以诊断的房间隔缺损、动脉导管未闭类畸形外,主动脉弓病变和肺静脉异位引流产前漏诊率较高,而此类患者产后病情危重,需要尽早治疗。因此双指标法的产后筛查是产前胎儿超声检查对先心病诊断的有效补充。
本组患者在一体化管理模式下取得了新生儿零死亡的良好结果,与其他危重先心病早期手术研究以及本单位既往研究相比,本组危重病例的手术时间更为提前,术前无严重器官功能不全等并发症,且缩短了术前缺血、缺氧的时间,临床效果确切[15, 16]。因此先心病产前诊断和产后治疗一体化的诊治流程,有助于尽早发现胎儿心脏畸形,对严重复杂畸形予及时终止妊娠,对保留的先心病患者进行尽早评估干预,可以取得良好的治疗结果,同时可以减少先心病对个人、家庭、社会的影响。
| [1] |
《中国出生缺陷防治报告》[D]. 中华人民共和国卫生部, 2012-09-12[2021-03-29]. http://www.gov.cn/gzdt/2012-09/12/content_2223373.htm. National Report of Birth Defect Control[D]. Ministry of Health of the People's Republic of China, 2012-09-12[2021-03-29]. http://www.gov.cn/gzdt/2012-09/12/content_2223373.htm. |
| [2] |
《中国妇幼健康事业发展报告(2019)》[D]. 国家卫生健康委员会妇幼健康司, 2019-05-27. [2021-03-29]. http://www.nhc.gov.cn/fys/jdt/201905/bbd8e2134a7e47958c5c9ef032e1dfa2.shtml. National Development Report of Women and Children Healthcare Undertakings (2019)[D]. Division of Women and Children Health, National Commission of Health, 2019-05-27. [2021-03-29]. http://www.nhc.gov.cn/fys/jdt/201905/bbd8e2134a7e47958c5c9ef032e1dfa2.shtml. |
| [3] |
Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association[J]. Circulation, 2014, 129(21): 2183-242. DOI:10.1161/01.cir.0000437597.44550.5d |
| [4] |
Quartermain MD, Hill KD, Goldberg DJ, et al. Prenatal diagnosis influences preoperative status in neonates with congenital heart disease: An Analysis of the Society of Thoracic Surgeons Congenital Heart Surgery Database[J]. Pediatr Cardiol, 2019, 40(3): 489-496. DOI:10.1007/s00246-018-1995-4 |
| [5] |
Marek J, Tomek V, Skovranek J, et al. Prenatal ultrasound screening of congenital heart disease in an unselected national population: a 21-year experience[J]. Heart, 2011, 97(2): 124-130. DOI:10.1136/hrt.2010.206623 |
| [6] |
洪海筏, 张玉奇, 王剑, 等. 中国心脏出生缺陷围产期诊断和临床评估处置专家共识[J]. 中华小儿外科杂志, 2018, 39(3): 163-170, 195. Hong HF, Zhang YQ, Wang J, et al. National consensus on perinatal diagnosis, evaluation and clinical disposal of cardiac birth defects[J]. Chin J Pediatr Surg, 2018, 39(3): 163-170, 195. DOI:10.3760/cma.j.issn.0253-3006.2018.03.002 |
| [7] |
孙锟, 陈树宝, 韩玲, 等. 胎儿先天性心脏病诊断及围产期管理专家共识[J]. 中华儿科杂志, 2015, 53(10): 728-733. Sun K, Chen SB, Han L, et al. Expert consensus on diagnosis and perinatal management of fetal congenital heart disease[J]. Chin J Pediatr, 2015, 53(10): 728-733. DOI:10.3760/cma.j.issn.0578-1310.2015.10.004 |
| [8] |
Zhao QM, Ma XJ, Ge XL, et al. Pulse oximetry with clinical assessment to screen for congenital heart disease in neonates in China: a prospective study[J]. Lancet, 2014, 384(9945): 747-754. DOI:10.1016/S0140-6736(14)60198-7 |
| [9] |
宓亚平, 贾兵. 新生儿危重先天性心脏病术前评估中国专家共识[J]. 中华小儿外科杂志, 2017, 38(3): 164-169. Mi YP, Jia B. Chinese expert consensus on preoperative assessment of neonates with critical congenital heart disease[J]. Chin J Pediatr Surg, 2017, 38(3): 164-169. DOI:10.3760/cma.j.issn.0253-3006.2017.03.002 |
| [10] |
Qiu X, Weng Z, Liu M, et al. Prenatal diagnosis and pregnancy outcomes of 1492 fetuses with congenital heart disease: role of multidisciplinary-joint consultation in prenatal diagnosis[J]. Sci Rep, 2020, 10(1): 7564. DOI:10.1038/s41598-020-64591-3 |
| [11] |
Ailes EC, Gilboa SM, Riehle-Colarusso T, et al. Prenatal diagnosis of nonsyndromic congenital heart defects.National Birth Defects Prevention Study[J]. Prenat Diagn, 2014, 34(3): 214-222. DOI:10.1002/pd.4282 |
| [12] |
潘微, 张智伟, 庞程程, 等. 产前诊断与生后治疗一体化模式救治新生儿重症先天性心脏病的研究[J]. 中华临床医师杂志(电子版), 2012, 6(22): 7079-7081. Pan W, Zhang ZW, Pang CC, et al. Integrated prenatal diagnosis and postnatal treatment for congenital heart disease in neonates[J]. Chin J Clinicians, 2012, 6(22): 7079-7081. DOI:10.3877/cma.j.issn.1674-0785.2012.22.018 |
| [13] |
Khalil M, Jux C, Rueblinger L, et al. Acute therapy of newborns with critical congenital heart disease[J]. Transl Pediatr, 2019, 8(2): 114-126. DOI:10.21037/tp.2019.04.06 |
| [14] |
Vijayaraghavan A, Sudhakar A, Sundaram KR, et al. Prenatal diagnosis and planned peri-partum care as a strategy to improve pre-operative status in neonates with critical CHDs in low-resource settings: a prospective study[J]. Cardiol Young, 2019, 29(12): 1481-1488. DOI:10.1017/S104795111900252X |
| [15] |
石磊, 翟波, 杨房, 等. 婴幼儿危重先天性心脏病急诊根治手术时机的初步探讨[J]. 临床小儿外科杂志, 2018, 17(12): 931-934. Shi L, Zhai B, Yang F, et al. Emergency primary repair of critical congenital heart disease in neonates and infants[J]. J Clin Ped Sur, 2018, 17(12): 931-934. DOI:10.3969/j.issn.1671-6353.2018.12.012 |
| [16] |
艾陈晨, 贾兵. 新生儿危重先天性心脏病的早期干预[J]. 中华胸心血管外科杂志, 2016, 32(2): 76-79. Ai CC, Jia B. Early intervention of neonates with critical congenital heart diseases[J]. Chin J Thorac Cardiovasc Surg, 2016, 32(2): 76-79. DOI:10.3760/cma.j.issn.1001-4497.2016.02.004 |
 2021, Vol. 20
2021, Vol. 20


