先天性主动脉瓣狭窄(congenital aortic stenosis, AS)是较为常见的先天性心脏病(简称先心病),存活新生儿中AS的发生率为0.03/1 000~0.34/1 000,占先心病的3% ~5%[1]。年长儿AS由于发现较晚,瓣叶发育形态尚可,梗阻往往呈缓慢进展型,目前外科治疗能取得较满意的效果[2]。小年龄AS患者主动脉瓣病变程度往往比较严重,可累及多个瓣叶,且主动脉瓣的解剖和形态个体差异大,需要尽早行手术治疗[3]。此外,小年龄AS患者由于出现症状早且严重,手术风险相对较大。尤其新生儿(或者一些需要紧急早期干预的患者)更需要进行综合评估和干预,应与年长儿渐进性主动脉瓣狭窄区分开来[4]。外科如何进行纠治、选择什么方法进行干预,国内外尚无明确定论[3, 7]。本中心一直以来致力于复杂瓣叶成形术,故本研究回顾性分析近12年来1岁以内AS患者的外科治疗结果,评估复杂瓣叶成形术的近远期疗效,总结治疗经验。
材料与方法 一、研究对象收集2008年1月至2020年12月由上海儿童医学中心收治的1岁以内的AS患者作为研究对象,病例纳入标准:①在出生后被诊断为AS,跨瓣峰值压差>50 mmHg,或有明显症状的AS;②有足够大的左心室[二尖瓣环Z值>-2和左室舒张末前后径(left ventricular end diastolic diameter, LVEDD) Z值>-2];③AS压差<50 mmHg,伴有显著左心功能不全,或内科保守治疗症状不能改善;④首次在本院接受手术。排除标准:手术年龄>1岁、接受单心室姑息治疗、风湿性心脏病、左心发育不良综合征、Shone综合征、Williams综合征和肥厚性心肌病等。最终纳入67例AS患者,男40例,女27例,中位年龄140(107~246)d,中位体重6.2(4.6~7.5)kg,新生儿5例(7.5%),两叶瓣患者27例(40.3%)。入院时心脏彩超检查提示:平均跨瓣峰值压差(70.2±24.5)mmHg,中度主动脉瓣反流(aortic insufficiency, AI)1例,平均左室射血分数(left ventricular ejection fraction, LVEF)(70.2±13.0)%,平均左室舒张末期内径(left ventricular diastolic diameter, LVDD)及Z值分别为(2.7±0.6)cm和1.6±2.3,主动脉瓣环直径(0.8±0.3)cm,Z值为0.4±1.5。其他病史和合并心脏畸形详见表 1。
| 表 1 67例AS患者的临床资料 Table 1 Clinical data of 67 children of aortic stenosis |
|
|
AS主要通过心脏彩超诊断。主动脉瓣形态学包括瓣叶数目、瓣环直径和瓣叶收缩期活动度。将AI分为无/轻微、轻度、中度和重度。中度及以上的AI定义为显著AI。超声心动图检测LVDD、LVEF、二尖瓣狭窄/反流(mitral stenosis/regurgitation, MS/MR)、升主动脉直径等心脏功能性和解剖特征。将一些测量值与体表面积进行比较,将其转换为Z值。
所有患者通过胸骨正中切口并建立体外循环,经升主动脉Ice-Hockey切口切开至无冠窦底部,精确暴露主动脉瓣(图 1A)。检查主动脉瓣瓣叶形态和功能,保守切开粘连的交界(切开至距离主动脉瓣环1~2 mm)(图 1B、图 1C)。两叶瓣的假嵴基本很少切开,一味切开容易造成严重反流。必要时切除沉积在瓣叶上和瓣叶间的结节及纤维组织,削薄瓣叶,增加瓣叶活动度和对合度(图 1D)。操作完毕后检查瓣叶形态和对合度(图 1E、图 1F)。术中常规应用经食管超声心动图评估术中瓣叶功能。如果残余压差持续保持在40 mmHg以上,下降<50%或AI轻中度以上,则需要重新阻断进行再次修复。该年龄段没有患者Ⅰ期接受主动脉瓣置换术,随访中如瓣叶最终变得不可修补,则首选Ross手术。
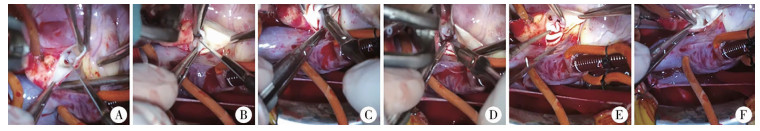
|
图 1 婴儿AS外科修复术过程 注 A: 升主动脉Ice-Hockey切口暴露主动脉瓣叶; B: 主动脉瓣瓣叶交界切开; C: 对侧主动脉瓣瓣叶交界切开; D: 瓣叶削薄; E: 操作完毕后检查瓣叶; F: 注水可见瓣叶对合良好,反流不明显 Fig.1 Surgical repair of aortic stenosis in infants |
患者分别在出院后1个月、3个月、6个月至本中心门诊进行常规术后随访,接下来的18个月中每6个月门诊随访一次,之后每年门诊随访一次。记录随访过程中各项检查结果,如心脏超声、心电图、pro-BNP、心脏磁共振等。
四、统计学方法采用软件IBM SPSS 22.0进行数据分析。对于术前跨瓣压差、LVEF、LVDD、主动脉瓣环直径及Z值等服从正态分布的连续变量采用均数加减标准差(x±s)表示,对于不服从正态分布的计量资料(如年龄、体重等)采用中位数和四分位间距[M, (P25, P75)]表示。单因素分析采用Cox比例风险模型,纳入单因素分析的因素包括患者基线特征(年龄、体重、性别等)、患者临床条件(术前LVEF、主动脉瓣环发育大小、左心室发育大小)、瓣叶发育情况(瓣叶数量、主动脉瓣狭窄程度、主动脉瓣反流程度)和手术相关特征(术中是否使用补片、术后残余梗阻等)。多因素分析采用二元Logistic回归来评估死亡、再手术和主动脉瓣置换的危险因素,P<0.10则被纳入多因素分析。Kaplan-Meier和GraphPad用于分析和绘制生存曲线和免于再手术曲线。以P<0.05为差异有统计学意义。
结果 一、总体情况67例AS患者均接受了主动脉瓣瓣叶交界切开术,10例接受了瓣叶削薄术,7例切除瓣叶上的纤维组织团块,4例行瓣上或者瓣下扩大术,5例行瓣叶的折叠、悬吊术,3例术中使用心包补片修补瓣叶,2例术前伴严重左心功能不全患者术后安置了体外膜肺氧合(extracorporeal membrane oxygenation, ECMO),见表 2。7例术前合并心功能不全;3例术前经历过抢救、插管史;5例术前接受过内科球囊扩张术,其中3例均在新生儿期因为低LVEF(中位LVEF为46.3%),接受了首次球囊扩张术,平均球囊/瓣环直径为0.8,出院后平均LVEF为69.8%,平均压差为33.8 mmHg,主动脉瓣反流均维持轻度,后因梗阻加重并轻中度及以上AI遂至外科行二次手术。1例因严重梗阻(峰值跨瓣压差为140 mmHg)首次接受了球囊扩张术,因术后梗阻解除不明显(118 mmHg)转外科行瓣叶交界切开术。最后1例患者6月龄时首次接受了球囊扩张术,术后跨瓣压差降低不明显,随访6个月后因残余梗阻逐渐加重至86 mmHg,于1岁时接受了瓣叶交界切开术。
| 表 2 67例AS患者再手术风险因素分析 Table 2 Univariable and multivariable analysis of predictors for reoperation |
|
|
全组平均跨瓣峰值压差从术前的(70.2±13.0)mmHg成功降到(35.2±14.8)mmHg,差异有统计学意义(t=9.896,P=0.001)。平均LVDD从术前的(2.7±0.6)cm下降到(2.2±0.5)cm,差异有统计学意义(t=6.162,P=0.03)。术后早期LVEF与术前差异无统计学意义(t=0.705,P=0.484)。术后显著AI患者只有1例,随访中保持在轻中度AI。67例中有60例仍在随访,平均随访时间为(5.4±3.2)年,平均跨瓣峰值压差为(37.3±18.5)mmHg,1例伴显著AI。
二、病死率早期死亡(院内或者出院后<30 d)1例,远期死亡1例,总病死率3.3%。早期死亡的1例为220 d的患者,瓣叶为两叶瓣畸形合并中度MR和重度AS,一期接受了主动脉瓣成形术(使用心包补片扩大无冠瓣),术后循环欠佳,2 d后因急性心力衰竭死亡。晚期死亡的1例为268日龄时接受一期外科瓣叶成形术,分别于术后2.5年和7年接受了再次交界切开和主动脉置换术(aortic valve replacement, AVR),由于心肌肥厚严重,术后反复室颤,死于左心衰竭。
Kaplan-Meier分析提示10年生存率95.8%(图 2)。由于早期死亡病例数少,多因素分析尚没有发现独立的死亡危险因素。
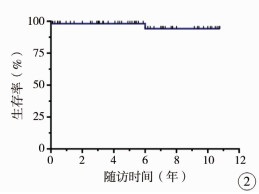
|
图 2 67例AS患者10年生存曲线图 Fig.2 Time-related survival curve |
6例接受了8次再手术,出院至再次手术时间为(4.4±2.1)年。87.5%的再手术是因为再梗阻。Kaplan-Meier分析提示5年免于再手术率为93.2%,10年为72.7%(图 3)。多因素分析发现术前主动脉瓣环直径Z值(HR:0.304, 95%CI:0.104~0.891)是再手术的危险因素(P=0.031),见表 2。
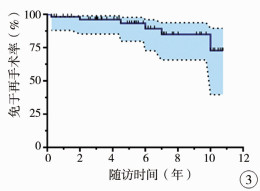
|
图 3 67例AS患者10年免于再手术率 Fig.3 Time-related freedom from reoperations |
3例因最终瓣叶变得不可修补而接受主动脉瓣置换(aortic valve replacement, AVR),中位时间为7年。Kaplan-Meier分析提示10年免于AVR的率为78.9%(图 4)。单因素风险分析发现术中用补片(P=0.022)会增加接受主动脉瓣换瓣的风险,但是多因素分析尚没有发现危险因素(表 3)。

|
图 4 67例AS患者10年免于主动脉瓣置换率 Fig.4 Time-related freedom from aortic valve replacement |
| 表 3 67例AS患者主动脉瓣置换危险因素分析 Table 3 Univariable analysis of predictors for aortic valve replacement |
|
|
自二十世纪八十年代报道了第一例主动脉瓣球囊扩张术以来,随后在全球各个心脏中心得到了广泛开展。截止目前,主动脉瓣交界切开术在解除梗阻、术后免于再手术和生存率方面已经取得了巨大的进展[5, 6]。有文献报道,使用球囊扩张术作为Ⅰ期治疗方法的远期结果不是特别令人满意,尤其是在年长的AS患者中更容易造成瓣叶的撕裂, 从而导致显著AI[7]。因此,外科瓣叶成形术仍是各年龄阶段AS患者的首选治疗方法。尤其是在婴儿AS这部分特殊的人群中,患者出现症状早,瓣叶发育较差,较容易引起心功能下降。再加上手术视野小,增加了手术操作的难度,外科手术的经验需要进一步总结和分析。本研究报道了超过10年的婴儿主动脉瓣修复术的中远期结果。本研究发现外科瓣叶交界切开术治疗婴儿AS患者的效果满意、近远期病死率低、再手术率低,能够使婴儿AS患者的瓣叶及瓣环继续生长发育到一定程度再接受进一步治疗。
一、病死率据文献报道,婴儿AS和新生儿AS(往往存在严重的左室流出道梗阻和左心室功能不全)术后10年生存率明显低于1岁以上AS患者(82% vs.93%)[9]。本中心目前无新生儿AS死亡病例,且10年生存率(96.7%,65/67)达到了年长儿存活率水平。Siddiqui等[5]认为新生儿、低体重是AS患者早期死亡的危险因素。然而本中心在这部分AS患者中没有发现死亡的危险因素,这可能是随着重症监护水平提高、体外循环ECMO的普及以及外科操作理念的进步,新生儿和低体重患者不再是AS外科治疗的难点。本研究认为对于年龄<1岁(尤其是3月龄以下)的AS患者,术前可以适当使用正性肌力药物、降低左心后负荷药物后再行手术治疗。新生儿期即使出现严重临床症状也无需立即行急诊手术,可以使用药物治疗维持动脉导管开放甚至行气管插管待情况稳定后再行手术解除左室流出道梗阻。这种策略可以改善低LVEF患者的体循环灌注,降低早期病死率,为后续进一步治疗赢得时机。
本研究中有2例术前有显著的慢性心衰病史,LVEF均不到30%,左心扩张明显,术后因左室低排出量、反复室颤安置了ECMO,分别于安置ECMO后9 d和16 d后成功撤机。出院后3个月、6个月随访LVEF分别恢复至62%和75%。ECMO治疗保障了左心功能的恢复(尤其是肥厚梗阻性先心病术后),大大提高了早期生存率。对于左心功能不全、心室肌肉肥厚的AS患者,虽然过度使用正性肌力药物可以增强心肌收缩力,但可能会影响冠状动脉灌注,引起术后早期发生室颤。由此可见,心功能恢复不仅仅依赖于解除左室流出道的梗阻,还需要关注冠状动脉的灌注情况。
Hochstrasser等[8]报道在小年龄AS患者中过度使用补片会影响近远期生存率。虽然本研究发现术中使用补片不会显著增加AS患者的早期病死率,但结合本中心之前的经验发现[2],小年龄AS患者在术中使用心包补片,受限于狭小的手术视野,会显著增加手术难度,甚至可能会导致术后瓣叶活动度变差,影响冠脉灌注。d'Udekem等[10]也得出了类似的观点,详细描述了两叶瓣患者行三叶瓣成形手术时,谨慎使用补片,因为补片会堵塞冠脉开口而增加早期病死率。本研究中早期死亡1例也是两叶瓣合并轻中度AI,术中使用心包补片延长瓣叶游离缘、重新构建三个瓣叶交界,导致其术后AI程度没有减轻反而加重至中度,推测可能与延长后的瓣缘过高导致脱垂,非对称分布的瓣窦有关[14]。
二、再手术Brown等[6]报道了婴幼儿AS术后10年免于再手术率为72%。同样Vergnat等[7]报道新生儿AS术后10年免于再手术率为66%。本研究结果与其相近,术后10年总体免于再手术率达到了72.7%。另外,上述研究报道瓣叶交界切开术将二次手术时间推迟了约2.4年,本中心距离二次手术的时间达到了(4.4±2.1)年。第一,这与本研究术中尽量保护瓣叶原有结构,避免使用补片的策略有关。再者,本研究中再手术主要原因87.5%(7/8)是残余梗阻,与目前国际上再手术原因相似[7, 10, 11]。这与本中心保守治疗策略有关,即尽可能地保证瓣叶的抗反流功能,即使术后可能残留一定程度的狭窄。因为相比容量负荷左心室,更能耐受压力负荷,且在婴儿中术后AI相比术后残余梗阻,更容易导致再手术[12]。本院AS患者出院时跨瓣峰值平均压差为35.2 mmHg,换算后跨瓣峰值流速约为3 m/s,稍高于德国心脏中心的结果(26 mmHg)[7]。因为根据以往经验, 由于AS疾病本身特质,患者术后左室流出道的狭窄往往会不断加重,直至出现梗阻合并显著AI,届时行AVR就不可避免了[13]。本研究还发现主动脉瓣环发育过小会增加再手术风险。瓣环发育较小,即使切开瓣叶黏连的交界,左室流出道的血流速度依旧是偏快的。考虑到这部分患者可能存在显著的左侧心室系统先天发育不良的因素,随访中残余梗阻进展更快,术后接受二次手术的时间可能会提前。
三、主动脉瓣置换目前国际上报道AS术后10年免于再手术率为70% ~81%[2, 6, 15],本研究结果亦是如此。Hill等[16]认为使用球囊扩张术会破坏瓣叶原本结构,从而提前了换瓣的时间点。本研究认为保守的球囊扩张术可作为婴儿一期的AS治疗选择,将球囊和瓣环直径比控制在0.7~0.8,先解除左室流出道梗阻导致的左心功能不全,再根据瓣叶功能择期行手术治疗[7]。本研究还发现术前行球囊扩张术不是导致最终AVR的独立风险因素。首先,球囊扩张术作为介入方法,创伤小,恢复快,不经历体外循环,适合小婴儿AS患者。其次,由于AS的病理生理学特征,梗阻和AI会随着年龄的增长而不断加重[14],沉积在瓣叶交界处的瘢痕纤维组织会变得更硬、更厚,若在大年龄患者中再行球囊扩张术则易导致瓣叶撕裂。最后,年龄较大的AS患者(常伴AI、两叶瓣畸形)更适合外科瓣叶成形术或AVR。Vergnat等[5]指出主动脉瓣交界切开术作为一种姑息方法,尽可能地保留自身的主动脉瓣更能延缓最终AVR的时间,且可以提供更好的流体动力学,再手术率更低。本研究也发现,这阶段所有患者第一次手术均保留自己原有的瓣叶,通过随访发现,约90%的AS患者瓣膜功能良好,约10%的患者由于自身瓣膜发育欠佳,最终接受了AVR。
总之,对于婴儿AS,主动脉瓣修复术可以有效、安全地解除主动脉瓣狭窄,提高AS患者近远期生存质量。主动脉瓣修复术可以作为一种姑息的治疗策略,待患者生长发育至一定程度再行进一步治疗。手术中只做单纯交界切开,过度使用心包补片可能会影响瓣叶功能。主动脉瓣环发育过小会增加二次手术风险。当瓣叶变得不可修补,AVR是不可避免的,但以上观点仍需进一步研究证实。
| [1] |
Cambell M, Kauntze R. Congenital aortic valvular stenosis[J]. British Heart J, 1953, 15(2): 179-194. DOI:10.1136/hrt.15.2.179 |
| [2] |
Zhu Y, Hu R, Zhang W, et al. Surgical and transcatheter treatments in children with congenital aortic stenosis[J]. Thorac Cardiovasc Surg, 2020. DOI:10.1055/s-0040-1715437 |
| [3] |
Mccrindle BW, Blackstone EH, Williams WG, et al. Are outcomes of surgical versus transcatheter balloon valvotomy equivalent in neonatal critical aortic stenosis?[J]. Circulation, 2001, 104(12 Suppl 1): 152-158. DOI:10.1161/hc37t1.094837 |
| [4] |
刘宇航, 文平, 刘启龙, 等. 75例低龄低体重先心病急诊、亚急诊心内直视手术疗效分析[J]. 临床小儿外科杂志, 2019, 18(9): 779-783. Liu YH, Wen P, Liu QL, et al. Emergency and sub-emergency operations for congenital heart disease in 75 infants with a low age and a low body weight[J]. J Clin Ped Sur, 2019, 18(9): 779-783. DOI:10.3969/j.issn.1671-6353.2019.09.015 |
| [5] |
Siddiqui J, Brizard CP, Konstantinov IE, et al. Outcomes after operations for bicuspid aortic valve disease in the pediatric population[J]. Ann Thorac Surg, 2013, 96(6): 2175-2183. DOI:10.1016/j.athoracsur.2013.07.130 |
| [6] |
Brown JW, Rodefeld MD, Ruzmetov M, et al. Surgical valvuloplasty versus balloon aortic dilation for congenital aortic stenosis: are evidence-based outcomes relevant?[J]. Ann Thorac Surg, 2012, 94(1): 146-155. DOI:10.1016/j.athoracsur.2012.02.054 |
| [7] |
Vergnat M, Asfour B, Arenz C, et al. Aortic stenosis of the neonate: A single-center experience[J]. J Thorac Cardiovasc Surg, 2019, 157(1): 318-326. DOI:10.1016/j.jtcvs.2018.08.089 |
| [8] |
Hochstrasser L, Ruchat P, Sekarski N, et al. Long-term outcome of congenital aortic valve stenosis: predictors of reintervention[J]. Cardiol Young, 2015, 25(5): 893-902. DOI:10.1017/S1047951114001085 |
| [9] |
Benson L. Neonatal aortic stenosis is a surgical disease: an interventional cardiologist view[J]. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu, 2016, 19(1): 6-9. DOI:10.1053/j.pcsu.2015.11.008 |
| [10] |
d'Udekem Y, Siddiqui J, Seaman CS, et al. Long-term results of a strategy of aortic valve repair in the pediatric population[J]. J Thorac Cardiovasc Surg, 2013, 145(2): 461-469. DOI:10.1016/j.jtcvs.2012.11.033 |
| [11] |
Alexiou C, Langley SM, Dalrymple-Hay, et al. Open commissurotomy for critical isolated aortic stenosis in neonates[J]. Ann Thorac Surg, 2001, 71(2): 489-493. DOI:10.1016/S0003-4975(00)02232-3 |
| [12] |
Prijic SM, Vukomanovic VA, Stajevic MS, et al. Balloon dilation and surgical valvotomy comparison in non-critical congenital aortic valve stenosis[J]. Pediatric Cardiology, 2015, 36(3): 616-624. DOI:10.1007/s00246-014-1056-6 |
| [13] |
潘燕军, 张海波, 郑景浩, 等. 49例儿童先天性主动脉瓣狭窄的外科治疗[J]. 中华胸心血管外科杂志, 2012, 28(10): 588-590. Pan Y, Zhang H, Zheng J, et al. Surgical repair for congenital aortic stenosis in children: results of 49 cases[J]. Chinese Journal of Thoracic and Cardiovascular Surgery, 2012, 28(10): 588-590. DOI:10.3760/cma.j.issn.1001-4497.2012.10.004 |
| [14] |
Petit CJ, Gao K, Goldstein BH, et al. Relation of aortic valve morphologic characteristics to aortic valve insufficiency and residual stenosis in children with congenital aortic stenosis undergoing balloon valvuloplasty[J]. Am J Cardiol, 2016, 117(6): 972-979. DOI:10.1016/j.amjcard.2015.12.034 |
| [15] |
Buratto E, Shi WY, Wynne R, et al. Improved survival after the Ross procedure compared with mechanical aortic valve replacement[J]. J Am Coll Cardiol, 2018, 71(12): 1337-1344. DOI:10.1016/j.jacc.2018.01.048 |
| [16] |
Hill GD, Ginde S, Rios R, et al. Surgical valvotomy versus balloon valvuloplasty for congenital aortic valve stenosis: a systematic review and meta-analysis[J]. J Am Heart Assoc, 2016, 5(8): e003931. DOI:10.1161/JAHA.116.003931 |
 2021, Vol. 20
2021, Vol. 20


