低体重新生儿指出生1 h内体重不足2 500 g的新生儿,早产儿是指孕龄小于37周的新生儿,低体重新生儿中,早产儿占69.6%[1]。低体重早产儿心肺、食管等脏器的解剖与功能发育不完善,且动脉导管保留着左向右分流的胎儿式循环,容易并发肺动脉高压、呼吸窘迫综合征、胃食管反流等,出生后即刻手术的麻醉风险大,术中和术后意外的发生率高,而目前临床报道较少。本文对武汉大学中南医院2例低体重早产儿出生后即刻接受手术的病例资料进行分析,并结合文献总结麻醉经验,以期为今后的小儿手术麻醉提供参考。
病例1:患者男,其母孕26+3周时超声提示双活胎(图 1),于孕35+2周行剖宫产娩出,体重2.1 kg,生后脐部偏右侧可见一腹裂口,约10 cm×8 cm肠管暴露于腹壁外,拟于出生后即刻在气管插管全麻下行“一期腹裂修补术+Ladd's术+阑尾切除术”。病例2:患者女,其母孕16+4周时超声提示双活胎(图 2),于孕32+1周行剖宫产娩出,体重1.5 kg,生后脐部突出约8 cm×6 cm大小的包块,皮肤菲薄,可透见脏器,行“腹壁缺损修补+肠粘连松解+腹腔引流术”。
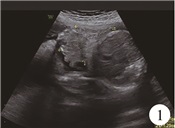
|
图 1 孕26+3周超声提示胎儿腹裂, 可见6.87 cm×4.29 cm的肠管脱出 Fig.1 Ultrasoundgraphy at 26+3 weeks of gestation showed the fetal gastroschisis, the visible range of the bowel was 6.87 cm×4.29 cm |
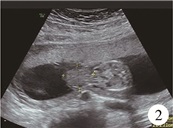
|
图 2 孕16+4周超声提示胎儿脐膨出, 可见2.75 cm×2.21 cm的肿块向外膨出 Fig.2 Ultrasoundgraphy at 16+4 weeks of gestation showed the fetal omphalocele, the visible outward range of the mass bulges was 2.75 cm×2.21 cm |
2例出生后均立即使用手术贴膜包裹外露脏器,并用辐射保暖台转至预设28 ℃的相邻手术间,麻醉药品、抢救药品及气道管理装置备用。将患者置于加温水毯上,行心电监护及体温监测,面罩吸氧,开放前臂静脉和足背静脉通道(图 3),置胃管及导尿管。麻醉诱导:调节七氟烷浓度至5%,氧流量6 L/min,依次静脉给予舒芬太尼0.1 μg/kg,顺式苯磺酸阿曲库铵0.1 mg/kg,生理盐水0.5 mL冲管。病例1置入内径(internal diameter, ID)3.0 mm气管导管,深度10 cm;病例2置入ID 2.5 mm气管导管,深度9 cm,听诊双肺呼吸音对称后固定导管。采用压力控制通气模式,设置潮气量(tidal volume, VT)10 mL/kg,呼吸频率(respiratory rate, RR)30~40次/min,吸入70%的空氧混合气体2 L/min。用棉垫包绕患者四肢,体表覆盖热气垫,鼓风机送热风。术中使用输液泵输注生理盐水与5%葡萄糖配置的混合液体,吸入七氟烷+泵入瑞芬太尼维持麻醉。根据患者生命体征、手术操作等情况调节麻醉深度,根据需要追加肌松药物。
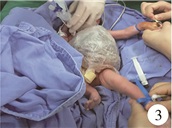
|
图 3 面罩给氧,开放静脉通道 Fig.3 Oxygen was supplied by mask,and venous accesses were opened |
2例均顺利完成手术,病例2在还纳脏器后出现经皮血氧饱和度(percutaneous oxygen saturation, SpO2)及平均动脉压(mean arterial pressure, MAP)下降,心率(heart rate, HR)升高,经手控麻醉机辅助呼吸、应用血管活性药物、追加肌松药、及时升温等处理后恢复正常。术毕均带气管导管送新生儿重症监护病房(neonatal intensive care unit, NICU),继续呼吸机治疗,见图 4。病例1麻醉时间90 min,术后9 h拔除气管导管,术后23 d出院。病例2麻醉时间185 min,术后3 d拔除气管导管,术后30 d出院。两例均无严重并发症,随访至9月龄,生长发育良好。
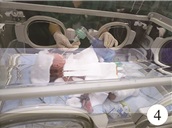
|
图 4 带气管导管送NICU Fig.4 Delivered to NICU with endotracheal tube |
随着产前诊断技术的进步,很多患者在胎儿期就可诊断明确。腹裂和脐膨出是最常见的先天性腹壁缺损[2],其发病率分别为2/10 000~3/10 000[3]和1/10 000~3/10 000[4]。腹裂的发生机制目前尚不明确,可能与右侧脐静脉退化有关,脐右侧相对薄弱,导致右侧腹壁缺陷[5]。脐膨出是由于胚胎期侧褶发育停顿或发育不良,脐部未融合,腹腔脏器未回纳入腹,被囊膜覆盖所形成的腹壁畸形。目前先天性腹壁缺损的治疗以手术修复为主,产时手术可以最大限度缩短脏器暴露时间。出生后即刻接受修复手术,可降低感染发生率,缩短手术时间、肠外营养时间和住院时间,显著改善中国新生儿先天性脐膨出的短期预后[6]。有学者提出了“产房外科”的概念,即在产房分娩的患者直接在产房内手术[7]。本文2例均为双胎妊娠合并一胎腹裂或脐膨出,且患者系低体重早产儿,术前多学科会诊后行产房外科手术,由于患者病情变化快及术前检查困难,给手术评估和麻醉管理带来极大困难。
本文2例均先娩出健康新生儿,然后娩出腹壁缺损患者,若出生时状况差则行气管插管后再断脐,但患者出生后5 min Apgar评分均达8分,因此选择断脐后再插管。新生儿气道最狭窄部分位于声门下环状软骨水平,此处上皮组织与周围结合疏松,损伤后易水肿,且患者呼吸储备功能不完善,对缺氧耐受差,因此气管插管时既要动作轻柔,又要快速、准确。低体重早产儿脏器功能尚未发育成熟,其药物半衰期比成熟儿长,达到相同的麻醉深度所需要的麻醉药更少。瑞芬太尼联合七氟烷可以减少吸入麻醉药的用量,提供理想的麻醉过程和镇痛效果。术中联合应用七氟烷和肌松药为探查是否合并其他先天性畸形提供了条件,并且松弛的腹壁有利于回纳脏器、缝合缺损以及防止腹压过高影响呼吸和循环。低体重早产儿视网膜病变发生率较高,术中应尽可能采用空氧混合气体吸入。
患者脏器还纳后腹内压增高,回心血量减少,横膈抬高可导致肺扩张受限及肺顺应性降低[8]。病例2在还纳脏器后出现SpO2及MAP下降,HR升高,可能与腹内压增高相关。术中评估通气压力小于25 cm H2O,对于脏器回纳是相对安全的[9]。术后继续机械通气过渡一段时间,有利于腹壁伸展容纳其内容物,防止患者哭闹、活动时腹压增加,导致切口裂开。由于内脏暴露及部分性肠梗阻致液体丢失,可引起缺水和电解质紊乱,并且新生儿心室顺应性差,心脏对容量负荷敏感,需要根据患者HR、MAP和尿量变化,调节输液泵的输注速度。术前行胃肠减压及尿管引流可以减轻腹腔压力,有利于脏器还纳、防止反流误吸及高腹压对心肺和大血管的影响。
此类手术的麻醉处理存在一些挑战:①手术区域相对低体重早产儿的体表面积过大,脏器暴露及手术造成深部热量丢失,体温维持相对困难,较高的室温对医务人员的工作环境提出挑战;②由于患者太小,外科医师操作时可能压到头部,监护线路及气道管路极易受压,需警惕患者皮肤受压伤及气管导管位置变动,可自行设计一些防压装置保护患者。
| [1] |
Chen Y, Li G, Ruan Y, et al. An epidemiological survey on low birth weight infants in China and analysis of outcomes of full-term low birth weight infants[J]. BMC Pregnancy Childbirth, 2013, 13: 242. DOI:10.1186/1471-2393-13-242 |
| [2] |
Faugstad TM, Brantberg A, Blaas HG, et al. Prenatal examination and postmortem findings in fetuses with gastroschisis and omphalocele[J]. Prenat Diagn, 2014, 34(6): 570-576. DOI:10.1002/pd.4350 |
| [3] |
Yan W, Wu Y, Wu Z, et al. Gastroschisis in monochorionic male twins[J]. Pediatr Surg Int, 2017, 33(5): 627-629. DOI:10.1007/s00383-017-4071-x |
| [4] |
Kong JY, Yeo KT, Abdel-Latif ME, et al. Outcomes of infants with abdominal wall defects over 18 years[J]. J Pediatr Surg, 2016, 51(10): 1644-1649. DOI:10.1016/j.jpedsurg.2016.06.003 |
| [5] |
黄晶晶. 先天性腹裂围手术期处理进展及争议[J]. 中华小儿外科杂志, 2014, 35(11): 869-872. Huang JJ. Progress and controversy in perioperative management of congenital gastroschisis[J]. Chin J Pediatr Surg, 2014, 35(11): 869-872. DOI:10.3760/cma.j.issn.0253-3006.2014.11.016 |
| [6] |
Na Q, Liu C, Cui H, et al. Immediate repair compared with delayed repair of congenital omphalocele: short-term neonatal outcomes in China[J]. J Int Med Res, 2011, 39(6): 2344-2351. DOI:10.1177/147323001103900634 |
| [7] |
施诚仁, 蔡威, 王俊, 等. 小儿外科畸形早期外科干预新途径-产房外科的可行性[J]. 临床儿科杂志, 2005, 23(2): 98-100. Shi CR, Cai W, Wang J, et al. A novel approach to treat neonatal abnormalities in their earlier stage-Feasibility of the delivery room surgery system[J]. J Clin Pediatr, 2005, 23(2): 98-100. DOI:10.3969/j.issn.1000-3606.2005.02.012 |
| [8] |
叶海蓉, 杜溢, 陈怡绮, 等. 先天性腹裂外科治疗的麻醉体会[J]. 临床小儿外科杂志, 2009, 8(5): 63-64. Ye HR, Du Y, Chen YQ, et al. Anaesthetic experience in surgical treatment of congenital gastroschisis[J]. J Clin Ped Sur, 2009, 8(5): 63-64. DOI:10.3969/j.issn.1671-6353.2009.05.024 |
| [9] |
Petrosyan M, Sandler AD. Closure methods in gastroschisis[J]. Semin Pediatr Surg, 2018, 27(5): 304-308. DOI:10.1053/j.sempedsurg.2018.08.009 |
 2021, Vol. 20
2021, Vol. 20


