2. 上海交通大学医学院附属上海儿童医学中心血液肿瘤科(上海市, 200127);
3. 上海交通大学医学院附属上海儿童医学中心病理科(上海市, 200127)
2. Department of Hematological Oncology, Shanghai Children's Medical Center, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China;
3. Department of Pathology, Shanghai Children's Medical Center, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China
肾母细胞瘤(Wilms tumor, WT)是儿童最常见的恶性实体肿瘤之一,通过现代肿瘤多学科综合治疗,目前生存率可达90%以上[1]。上海交通大学医学院附属上海儿童医学中心肿瘤外科、血液科、病理科以及影像科等协同规范治疗方案研究表明,该中心肾母细胞瘤5年生存率超过80%,但仍存在一定的复发率[2]。本文就儿童复发肾母细胞瘤的治疗方案及影响预后的相关因素进行探讨。
材料与方法 一、临床资料回顾性分析2006年4月至2019年12月上海交通大学医学院附属上海儿童医学中心肿瘤外科收治的23例复发肾母细胞瘤患者资料,其中男11例,女12例,初发肾母细胞瘤诊断时年龄6~109个月(中位年龄42个月),其中右侧13例,左侧10例。23例均行手术治疗,其中5例于我院接受首次手术,18例于外院接受首次手术。首次手术方式:除1例(病例23)为保留肾单位手术外,其余均为根治性肾肿瘤切除术。病理分型:肾母细胞瘤组织满意型FH型17例(73.91%),UFH型3例(13.04%),未注明FH型/UFH型3例(13.04%)。临床分期采用美国国家肾母细胞瘤研究组(National Wilms' Tumor Study, NWTS)分期标准,其中Ⅰ期1例(4.34%)、Ⅱ期11例(47.82%)、Ⅲ期10例(43.48%)、Ⅳ期1例(1/23, 4.34%)。通过腹部超声进行术后腹部随访,如发现异常病灶需进一步行腹部增强CT检查,以病理结果明确是否复发。以胸部CT影像学和/或PET-CT结果诊断是否复发。初次手术后进行化疗者21例(21/23,93.1%),未行化疗的2例均为原位复发。初次手术后进行放疗者7例,均为Ⅲ期患者,还有4例Ⅲ期患者未进行放疗。复发时间最短为术后3个月,最长为术后111个月。复发部位:原位复发11例(11/23,47.82%),单纯肺部6例(6/23,26.08%),肝转移5例(5/23,21.74%),纵膈转移1例(1/23,4.34%)。1例肝转移病例为UFH型患者,原发部位及肝、肺均有转移。
二、治疗方法11例原发部位、后腹膜及盆腔肿瘤复发病例,除1例未进行化疗外,复发后全部采用IEV方案(前异环磷酰胺+长春新碱+依托泊苷)化疗2个疗程,再行手术切除原位肿瘤复发灶。6例单纯肺部复发病例的治疗首先评估肺部转移病灶,给予2个疗程的IEV方案(前异环磷酰胺+长春新碱+依托泊苷)化疗,复查胸部CT如果病灶消失,按原来的化疗方案继续4~6个疗程;如果病灶没有完全消失,需行PCT-CT检查明确是否具有肿瘤活性;如具有肿瘤活性、单侧肺转移灶数量小于3个且转移灶位于肺边缘,则采用胸腔镜切除肺部转移灶,本文中病例均符合以上条件。复发后是否进行放疗取决于复发前是否放疗,如已进行放疗,则视首次放疗与末次放疗的间隔时间决定。1例纵膈转移病例化疗过程中出现电解质紊乱,肺部感染,病情恶化后死亡。5例出现肝脏转移病灶的病例中,4例在2个疗程IEV方案化疗后予手术完整切除。1例为原发部位复发及肝、肺转移,给予IEV方案(前异环磷酰胺、长春新碱和依托泊苷)化疗2周后手术完整切除原发部位肿瘤及肝脏转移灶,术后化疗(阿霉素、长春新碱、依托泊苷、环磷酰胺)25周并予胸部放疗,随访23个月后发现肝脏转移,予以肝脏转移灶切除术后进行自体造血干细胞移植,随访111个月再次发现后腹膜肿瘤复发,经手术完整切除后病情恶化死亡。化疗结束时综合患者家长意见、患者对化疗的敏感度及选择性行自体造血干细胞移植,23例复发病例中13例接受复发后放疗,5例接受了复发后自体骨髓移植。所有病例复发2年内每3个月进行一次腹部超声及胸部CT检查,如腹部超声有异常表现则进一步行腹部CT增强检查,2年后改为每半年1次,4年后改为每年1次。
三、统计学方法使用GraphPadprism 6.0统计学软件进行统计学分析, 正态分布计量资料采用(x ±s)描述,采用非成对t检验比较组间差异;非正态分布的计量资料采用中位数描述,采用Mann-Whitney U检验比较组间差异;计数资料采用频数和率描述,使用χ2检验比较组间差异,生存分析采用Kaplan-Meier生存曲线进行描述,使用Log Rank检验比较生存曲线间的差异。P < 0.05表示差异具有统计学意义。
结果23例复发肾母细胞瘤患者再次治疗后随访结果见表 1。随访时间29~172个月(中位时间39个月)。随访期间,6例肺转移患者存活4例,随访时间10个月至8年;5例肝脏转移患者存活4例,随访时间6个月至10年。11例原位、后腹膜及盆腔复发病例中9例存活(其中1例再次肝转移,1例再次胸转移),随访时间8个月至10年。1例原发部位及肝、肺转移病人经多次复发后病情恶化死亡。1例纵膈转移病人化疗过程中病情恶化死亡。复发后再行放疗13例,死亡4例(其中1例再次复发2次,最终死亡)。复发后再行骨髓干细胞移植的5例中,死亡3例(3/5, 60%),存活2例(2/5, 40%)。患者总体生存时间(43.83±40.30)个月(中位生存时间28个月);Ⅱ期总体生存时间为(37.91±31.27)个月(中位生存时间37个月),Ⅲ期患者的总体生存时间为(44.60±45.71)个月(中位生存时间26.5个月);Ⅱ期、Ⅲ期无复发生存时间分别为(34.72±33.07)个月(中位生存时间28.00个月),(41.60±47.58)个月(中位生存时间23.5个月)。
| 表 1 23例复发肾母细胞瘤患者临床资料 Table 1 Clinical data of 23 recurrent children |
|
|
本研究显示,原发肿瘤为Ⅱ期和Ⅲ期患者的复发时间和总体生存时间差异没有统计学意义;而在总体生存时间方面,初次手术后病理是否是FH型、是否做过骨髓干细胞移植以及复发后是否做过放疗没有统计学意义(P>0.05)。同时,初次治疗后不同复发时间的3组之间差异也没有统计学意义(P>0.05)。见图 1。
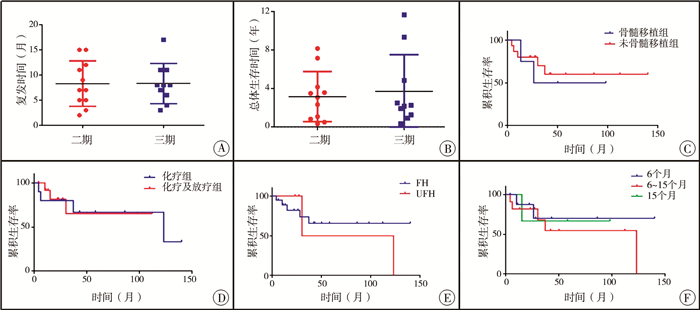
|
图 1 儿童肾母细胞瘤患者预后相关因素的生存分析 A: 在复发时间方面,肿瘤Ⅱ期和Ⅲ期之间差异无统计学意义,H=57,P=0.918;B: 在总体生存时间方面,肿瘤Ⅱ期和Ⅲ期之间差异无统计学意义,H=55.5,P=1.000; C: 在总体生存时间方面,复发后骨髓移植组和未进行骨髓移植组之间差异无统计学意义,χ2=0.160,P=0.697;D: 在总体生存时间方面,再次复发进行手术后单纯化疗组与化疗+放疗组之间差异无统计学意义,χ2=0.061,P=0.657;E: 在总体生存时间方面,病理类型FH和UFH两组之间差异无统计学意义,χ2=0.303,P=0.738;F: 在总体生存时间方面,初次治疗后不同复发时间组之间差异无统计学意义,χ2=0.346,P=0.732 Fig.1 Survival curve analysis of prognostic factors in children with Wilms' tumor |
1例肾母细胞瘤术后出现肿瘤肝转移,行再次手术+化疗后获得治愈(图 2);外院1例肾母细胞瘤挖除术后肿瘤原位复发病例,行再次手术+化疗+放疗后治愈(图 3)。23例复发肾母细胞瘤患者的EFS和OS生存曲线见图 4。
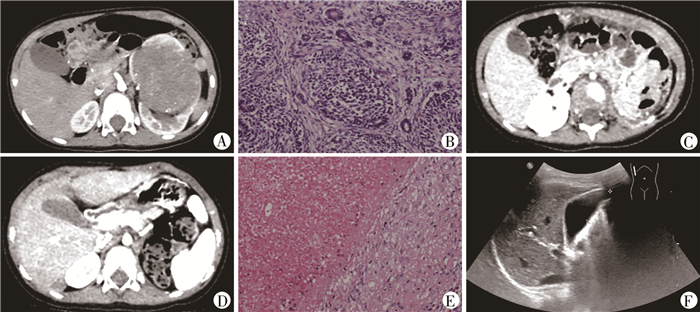
|
图 2 1例27月龄女性肾母细胞瘤患者的检查结果 注 该患者于我院行左肾肿瘤切除术+肾蒂淋巴结清扫术,病理提示肾母细胞瘤FH型,送检淋巴结未见肿瘤细胞,术后行化疗,未行放疗。术后7个月复查增强CT发现右肝后叶下段低密度灶并于我院行右肝后叶病灶切除术,病理提示病灶内可见结节,大部分坏死,再次术后行化疗,未行放疗。随访28个月,未见复发 A: 初次手术时CT见左肾巨大肿瘤;B: 初次手术病理切片,提示为FH型肾母细胞瘤,肿瘤位于肾包膜内,肾窦纤维脂肪组织中见肿瘤细胞;C: 初次术后2周复查CT腹腔内未见复发及转移;D: 初次手术后7个月复查CT见右肝后叶下段低密度病灶;E: 我院二次手术病理切片见结节,大部分坏死伴炎细胞浸润,见少量肿瘤细胞;F: 我院二次手术后24个月复查超声未见腹腔内复发及转移 Fig.2 Examination results of a 27-month-old patient with Wilms' tumor |
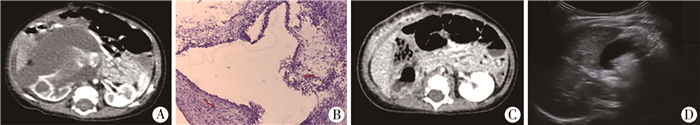
|
图 3 1例7月龄肾母细胞瘤患者的检查结果 注 患者男,7月龄时于外院行右肾肿瘤挖除术,病理提示肾母细胞瘤,进一步分型不详,术后未进行化疗及放疗。术后2个月复查增强CT提示右肾母细胞瘤复发,并于我院行右肾肿瘤切除+后腹膜淋巴结清扫术,病理提示肾母细胞瘤,淋巴结未见肿瘤细胞,再次术后行化疗+放疗。于我院术后随访4个月,未见复发 A: 初次手术后2个月时CT见右肾巨大肿瘤;B: 手术病理切片诊断为部分囊状分化的肾母细胞瘤,肾盂上皮下和肾窦纤维组织中见肿瘤组织;C: 术后2周复查CT腹腔内未见复发及转移;D: 术后4个月复查超声未见腹腔内复发及转移 Fig.3 Examination results of a 7-month-old patient with Wilms' tumor |
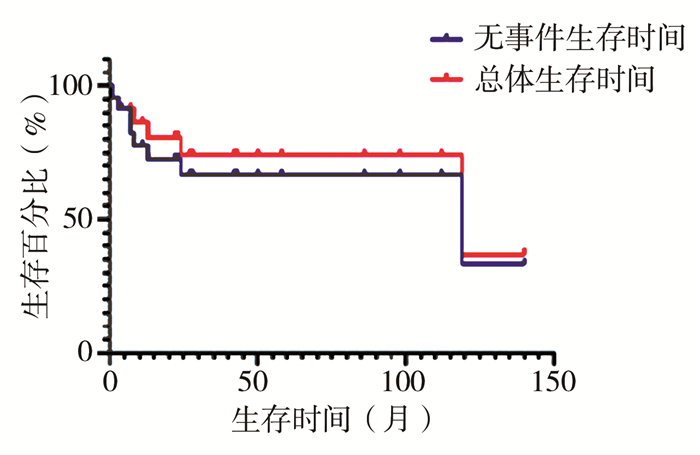
|
图 4 23例复发肾母细胞瘤的生存曲线 Fig.4 Survival curve of 23 recurrent children |
肾母细胞瘤是儿童最常见的肾脏恶性实体肿瘤之一,随着治疗方案逐渐规范,手术及放化疗技术逐步提高,肾母细胞瘤在发达国家的总体生存率已达90%以上,国内也达75%以上[1-3]。虽然通过多学科的联合治疗,儿童肾母细胞瘤生存率已大幅提高,但复发率仍在15%左右,复发后再治疗生存率仅30%左右,如何识别复发肾母细胞瘤的临床特征、降低其复发率以及解决复发后的再治疗问题是目前的研究热点。现有研究表明:术中肿瘤破溃、术中未作淋巴结活检致肿瘤分期不准确、病理为弥漫性间变型、化疗强度不够、化疗不敏感、未进行正规术后化疗等均为肾母细胞瘤复发的高危因素[4-7]。本文中4例Ⅲ期患者初次手术后未进行放疗(病例14、病例19、病例20及病例22),各有1例Ⅱ期及Ⅳ期患者未进行化疗(病例20、病例23)。同时,原手术单位术中操作是否规范、分期是否正确以及术后是否进行正规有效的放化疗也是影响复发的重要因素;因本文中多数病例为外院手术后复发病例,手术操作、分期及术后放化疗正规与否尚存疑问。关于复发肾母细胞瘤的治疗,国际上肾脏肿瘤以美国儿童肿瘤协作组和国际小儿肿瘤协会为主流,COG目前肾母细胞瘤诊断与治疗的主要进展包括:将基因变异1p和16q纳入临床分组、将6周治疗反应作为调整治疗方案的依据[8-10]。
本研究显示初发肿瘤为Ⅱ期和Ⅲ期者,在复发时间、总生存时间方面没有显著性差异,这可能与目前肿瘤标本1p/16q的杂合性丢失情况尚不明确以及1q扩增数据的缺失有关;而在总体生存时间方面,复发后是否进行放疗以及是否进行骨髓干细胞移植等均无显著性差异,表明肿瘤分期、是否进行骨髓干细胞移植、复发后是否进行放疗可能不是影响复发肾母细胞瘤预后的独立危险因素。NWTS-1研究表明,经15个月治疗后复发者存活率为90%,经治疗后6个月内复发者存活率仅为28%[12]。但是本研究显示不同复发时间组(6个月内复发,6~15个月复发,15个月以后复发)之间生存曲线差异不具有统计学意义,但复发时间大于15个月组相较于6~15个月组也逐渐表现出较好的预后,统计学的阴性结果可能与本组病例数较少以及6个月内复发病例多为肺部转移、预后相对较好有关。
按照儿童肾母细胞瘤诊断治疗建议(CCCG-WT-2016)中Ⅰ期、Ⅱ期FH型WT不需放疗的原则,Ⅱ期UFH型和Ⅲ期、Ⅳ期WT全部类型均须术后放疗[11]。但本研究显示,复发的患者是否进行放疗与总生存时间无关,还需要更多的病例来证实放疗对减少术后复发的影响。Shamberger等[13]统计了NWTS-4局部复发的100例WT病例,观察到与局部复发最相关的危险因子是Ⅲ期、组织不良型病理型和术中肿瘤播散病例。该文献提示,肿瘤播散和淋巴结活检阳性与肿瘤复发危险性增高相关,肿瘤复发后存活率差,2年存活率为43%,复发前已接受多次治疗的患者预后差。本研究显示23例复发WT接受再次治疗后,3年存活率为73.9%(其中CR为65.2%,带瘤生存率为8.7%),相比该报道明显偏高,可能与我们医院血液肿瘤科对复发WT采用强度较高的化疗方案有关[2]。
WT复发后的再治疗仍需要肿瘤外科、血液肿瘤内科、影像科以及病理科等共同协作的综合治疗,而肿瘤复发病灶的完整切除对改善复发肾母细胞瘤患者的预后至关重要[14]。Ruys等[15]认为,完整切除复发肿瘤的预后会好于部分切除,将肝脏转移肿瘤切除的患者预后也好于仅进行放疗或化疗的患者,所以对于原位复发以及肝脏转移的病灶,如影像学评估能够切除则应首先进行手术切除,术后无放疗史且适合放疗者予以放疗,并同时给予Ⅰ方案(阿霉素、长春新碱、依托泊苷、环磷酰胺治疗25周)治疗[16]。如不能完全切除,先给予2个疗程IEV方案(异环磷酰胺、长春新碱和依托泊苷)化疗,待手术条件成熟时可行再次手术。虽然NWTSG-5认为“肺部转移灶切除+术后化疗”的预后与“化疗+放疗”的预后无明显差异,但由于胸腔镜技术的快速发展,胸腔镜下行肺转移灶切除术安全可行,且具有肺功能影响小、术后恢复快的优点,所以对于单个或多个肺部转移灶的患者,我们首先进行化疗,复查胸部CT后如病灶持续存在,PCT-CT提示具有肿瘤活性,单侧肺转移灶数量小于3个且位于肺的边缘,则进行胸腔镜切除肺部转移灶[17]。与胸片检查相比,胸部CT可更加清晰地显示可疑结节。
自体造血干细胞移植(autologous bone marrow transplantation, ABMT)现在也已作为复发难治WT的一种治疗选择,但疗效尚不明确。Illhardt等[18]发现ABMT可延长患者生存时间,改善预后,但Filippo等[19]报道ABMT与传统治疗相比并未让患者获益,Malogolowkin等[20]亦报道接受ABMT的复发WT患者的EFS、OS并未显著提高,但是Ha等[21]报道大剂量化疗联合ABMT可能使难治复发的WT患者受益。在本研究中,进行ABMT的5例中仅2例完全治愈,并未显示出其疗效优势。当然,目前进行ABMT的病例相对较少,且需要接受ABMT的病例病情往往更为危重,因此其疗效尚需通过病例的增加进一步明确。
综上,目前复发WT的治疗仍面临诸多挑战[22, 23]。我院儿童复发性肾母细胞瘤FH型采用手术+放化疗综合治疗后仍可出现50%以上的远期EFS[24]。因此对于复发WT不应轻易放弃治疗,而应识别其临床特征,复发后积极再治疗,不断提高复发肿瘤的完整切除率以及复发后规范化的化疗及放疗,可进一步提高复发肿瘤的治愈率。而基因变异1p和16q等分子生物学指标的引入将有助于判别是否为复发WT的分子分型提供新依据。同时,初次手术时规范的手术操作与分期、术后化疗及放疗的合理选择与应用也是有效避免复发的重要举措,也建议在初次手术前转至有经验的儿童肿瘤中心进行治疗。
| [1] |
Termuhlen AM, Tersak JM, Liu Q, et al. Twenty-five year follow-up of childhood Wilms tumor: a report from the Childhood Cancer Survivor Study[J]. Pediatr Blood Cancer, 2011, 57(7): 1210-1216. DOI:10.1002/pbc.23090 |
| [2] |
Pan C, Cai JY, Xu M, et al. Renal tumor in developing countries: 142 cases from a single institution at Shanghai, China[J]. World J Pediatr, 2015, 11(4): 326-330. DOI:10.1007/s12519-015-0041-3 |
| [3] |
张国锋, 王家祥. 肾母细胞瘤78例临床特点及生存分析[J]. 中华实用儿科临床杂志, 2011, 26(9): 713-715. Wang GF, Wang JX. Clinical features and survival analysis of nephroblastoma in 78 children[J]. J Appl Clin Pediatr, 2011, 26(9): 713-715. |
| [4] |
Reinhard H, Schmidt A, Furtwangler R, et al. Outcome of relapses of nephroblastoma in patients registered in the SIOP/GPOH trials and studies[J]. Oncol Rep, 2008, 20(2): 463-467. DOI:10.3892/or_00000029 |
| [5] |
Grundy P, Breslow N, Green DM, et al. Prognostic factors for children with recurrent Wilms' tumor: results from the Second and Third National Wilms' Tumor Study[J]. J Clin Oncol, 1989, 7(5): 638-647. DOI:10.1200/JCO.1989.7.5.638 |
| [6] |
Shamberger RC, Guthrie KA, Ritchey ML, et al. Surgery-related factors and local recurrence of Wilms tumor in National Wilms Tumor Study 4[J]. Ann Surg, 1999, 162(4): 1556-1557. DOI:10.1097/00000658-199902000-00019 |
| [7] |
Aoba T, Urushihara N, Fukumoto K, et al. Relapse of unilateral favorable histology Wilms' tumor: significant clinicopathological factors[J]. J Pediatr Surg, 2012, 47(12): 2210-2215. DOI:10.1016/j.jpedsurg.2012.09.010 |
| [8] |
Dome JS, Perlman EJ, Graf N. Risk stratification for wilms tumor: current approach and future directions[J]. Am Soc Clin Oncol Educ Book, 2014, 215-223. DOI:10.14694/EdBook_AM.2014.34.215 |
| [9] |
Dome JS, Fernandez CV, Mullen EA, et al. Children's Oncology Group's 2013 blueprint for research: renal tumors[J]. Pediatr Blood Cancer, 2013, 60(6): 994-1000. DOI:10.1002/pbc.24419 |
| [10] |
Pritchard-Jones K, Bergeron C, de Camargo B, et al. Omission of doxorubicin from the treatment of stage Ⅱ-Ⅲ, intermediate-risk Wilms' tumour (SIOP WT 2001): an open-label, non-inferiority, randomised controlled trial[J]. Lancet, 2015, 386(9999): 1156-1164. DOI:10.1016/S0140-6736(14)62395-3 |
| [11] |
中国抗癌协会小儿肿瘤专业委员会. 儿童肾母细胞瘤诊断治疗建议(CCCG-WT-2016)[J]. 中华儿科杂志, 2017, 55(2): 90-94. Chinese Children Cancer Group. Chinese Anti-Cancer Association: Recommendations on Diagnosing & Treating Wilm's Tumor in Children (CCCG-WT-2016)[J]. Chin J Pediatr, 2017, 55(2): 90-94. DOI:10.3760/cma.j.issn.0578-1310.2017.02.007 |
| [12] |
Sutow WW, Breslow NE, Palmer NF, et al. Prognosis in children with Wilms' tumor metastases prior to or following primary treatment: results from the first National Wilms' Tumor Study (NWTS-1)[J]. Am J Clin Oncol, 1982, 5(4): 339-347. DOI:10.1097/00000421-198208000-00001 |
| [13] |
Shamberger RC, Guthrie KA, Ritchey ML, et al. Surgery-related factors and local recurrence of Wilms tumor in National Wilms Tumor Study 4[J]. Ann Surg, 1999, 229(2): 292-297. DOI:10.1097/00000658-199902000-00019 |
| [14] |
陈嘉波, 杨体泉, 董昆, 等. 儿童复发性肾母细胞瘤临床特点和治疗经验[J]. 中华实用儿科临床杂志, 2011, 26(21): 1682-1684. Chen JB, Yang TQ, Dong K, et al. Clinical characteristics and experience of treatment in children with relapsed Wilms' Tumor[J]. J Appl Clin Pediatr, 2011, 26(21): 1682-1684. DOI:10.3969/j.issn.1003-515X.2011.21.024 |
| [15] |
Ruys AT, Tanis PJ, Nagtegaal ID, et al. Erratum to: Surgical treatment of renal cell cancer liver metastases: a population-based study[J]. Ann Surg Oncol, 2014, 21(4): 784-784. DOI:10.1245/s10434-014-3645-2 |
| [16] |
Malogolowkin MH, Cotton CA, Green DM, et al. Treatment of Wilms tumor relapsing after initial treatment with vincristine, actinomycin D, and doxorubicin.A report from the National Wilms Tumor Study Group[J]. Pediatr Blood Cancer, 2008, 50(2): 236-241. DOI:10.1002/pbc.21267 |
| [17] |
Spreafico F, Pritchard JK, Malogolowkin MH, et al. Treatment of relapsed wilms tumors: Lessons learned[J]. Expert Rev Anticancer Ther, 2009, 9(12): 1807-1815. DOI:10.1586/era.09.159 |
| [18] |
Illhardt T, Ebinger M, Schwarze CP, et al. Children with relapsed or refractory nephroblastoma: favorable long-term survival after high-dose chemotherapy and autologous stem cell transplantation[J]. Klin Padiatr, 2014, 226(6-7): 351-356. DOI:10.1055/s-0034-1390504 |
| [19] |
Spreafico F, Bisogno G, Collini P, et al. Treatment of high-risk relapsed Wilms tumor with dose-intensive chemotherapy, marrow-ablative chemotherapy, and autologous hematopoietic stem cell support: Experience by the Italian association of pediatric hematology and oncology[J]. Pediatric Blood Cancer, 2008, 51(1): 23-28. DOI:10.1002/pbc.21524 |
| [20] |
Malogolowkin MH, Hemmer MT, Le-Rademacher J, et al. Outcomes following autologous hematopoietic stem cell transplant Transplantation, 2017 for patients with relapsed Wilms' tumor: a CIBMTR retrospective analysis[J]. Bone Marrow, 52(11): 1549-1555. DOI:10.1038/bmt.2017.178 |
| [21] |
Tam C, Spreafico F, Graf N, et al. An international strategy to determine the role of high dose therapy in recurrent Wilms' tumour[J]. Eur J Cancer, 2013, 49(1): 194-210. DOI:10.1016/j.ejca.2012.07.010 |
| [22] |
Wilde JC, Lameris W, van Hasselt EH, et al. Challenges and outcome of Wilms' tumour management in a resource-constrained setting[J]. Afr J Paediatr Surg, 2010, 7(3): 159-162. DOI:10.4103/0189-6725.70416 |
| [23] |
Ehrlich PF. Bilateral Wilms' tumor: the need to improve outcomes[J]. Expert Rev Anticancer The, 2009, 9(7): 963-973. DOI:10.1586/era.09.50 |
| [24] |
王天怡, 潘慈, 高怡瑾, 等. 儿童肾母细胞瘤复发后再治疗长期随访研究[J]. 中华儿科杂志, 2017, 55(10): 743-747. Wang TY, Pan C, Gao YJ, et al. A long-term follow-up report of pediatric relapsed Wilms tumor after retreatment[J]. Chin J Pediatr, 2017, 55(10): 743-747. DOI:10.3760/cma.j.issn.0578-1310.2017.10.006 |
 2021, Vol. 20
2021, Vol. 20


