下丘脑错构瘤是一种罕见的非肿瘤性病变,多因先天发育异常所致。病变主要成分为分化良好的神经元结节灶及散在分布的胶质细胞。主要临床表现为中枢性性早熟和痴笑性癫痫。治疗以手术切除病灶为主,部分性早熟者可使用促性腺激素释放激素类似物控制症状。手术方法包括显微手术切除病灶、射频热凝毁损病灶两种方式。本研究旨在初步探讨显微手术治疗儿童下丘脑错构瘤的适应证、安全性及疗效。
材料与方法 一、临床资料 (一) 一般资料本研究回顾性分析了空军军医大学唐都医院神经外科2016—2020年接受手术治疗的6例患者资料。6例中男5例、女1例,年龄3.5~6.1岁,平均4.3岁。患病时间1周至5年。表现为性早熟2例;痴笑性癫痫4例,其中1例继发癫痫大发作。详见表 1。
| 表 1 患者入院时一般资料 Table 1 General admission profiles |
|
|
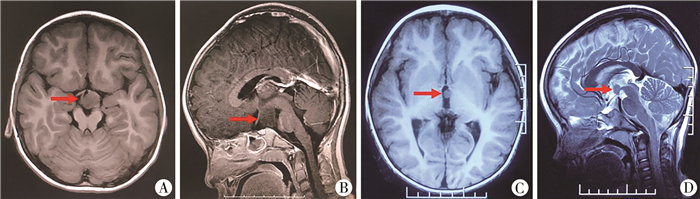
所有病例行头部MRI平扫及增强扫描,5例病灶位于脚间池,1例位于第三脑室内,病灶均无强化。病灶大小从10~30 mm不等。根据罗氏琪等[1]分型标准:Ⅱ型5例,错构瘤与下丘脑附着面大,呈宽基底型,无蒂(图 1A、图 1B);Ⅳ型1例,错构瘤完全位于三脑室内(图 1C、图 1D)。其他检查:性早熟病例查血清内分泌激素水平及骨龄,痴笑性癫痫予至少24小时视频脑电图监测。
|
图 1 儿童下丘脑错构瘤患者头部MRI平扫及增强扫描图片 A: 轴位MRI平扫示肿瘤(红色箭头,下同)位于脚间窝前方;B: 矢状位MRI示肿瘤位于下丘脑下方,有宽大瘤蒂与之相连,为罗氏Ⅱ型;C: 轴位MRI示肿瘤位于第三脑室内;D: 矢状位MRI示肿瘤位于乳头体上方,突入第三脑室,为罗氏Ⅳ型 Fig.1 Unenhanced and unenhanced MRI scan of the head of a child with hypothalamic hamartoma |
6例均通过显微手术切除或离断病灶。5例影像表现为罗氏Ⅱ型,采用翼点入路,从病灶偏多的一侧开颅。术中一侧肩膀垫起,头偏向对侧60° ~70°,头顶尽量下垂,骨窗靠近颧弓,以尽量减少对视交叉及视束的牵拉。术中充分分离近端侧裂蛛网膜,解剖颈内动脉、视交叉及视束,从血管及神经间隙显露病灶,病灶色苍白,质韧,血供不丰富,可分块或以显微CUSA切除,对于视野受限无法全切的病变,则尝试以弯的神经剥离子在错构瘤与下丘脑之间进行离断操作。1例影像学表现为Ⅳ型。采用右额部钩形切口,经纵裂- 胼胝体- 穹隆间入路切除病灶。
(二) 随访通过门诊、电话、微信等进行随访,包括临床随访和影像学随访,了解病情控制程度及治疗效果,随访时间2个月至4年。
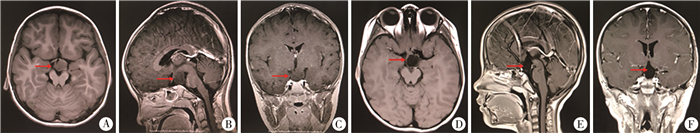
结果手术均顺利完成,无死亡、昏迷及视力障碍等并发症。术后复查MRI提示全切3例,次全切2例,大部分切除1例(图 2)。术后均出现一过性高热,持续1~2天,脑脊液化验排除感染因素,对症处理后缓解。无一例尿崩病例。
|
图 2 儿童下丘脑错构瘤患者手术前后MRI扫描图片对比 注 A-C为术前图片,肿瘤位于下丘脑下方,瘤蒂宽大(箭头指示处);D-F为术后图片,肿瘤全部切除(箭头指示处) Fig.2 Comparison of MRI scan before (A-C) and after surgery (D-F) and tumor was totally removed (red arrow) |
6例均定期随访,随访时间2个月至4年。性早熟病例(病例1、病例2)影像学复查提示全切,术后血清生长激素显著下降,并在随访过程中呈进行性下降,但仍略高于同年龄段正常值;病例1术前血清生长激素水平为305.2 ng/mL,术后1周血清生长激素水平下降至3.4 ng/mL,术后1年下降至1.3 ng/mL,术前1年身高增长约15 cm,术后1年身高增长约6 cm,手术前后声音无明显变化,随访4年,血清睾酮水平呈渐升高趋势,从0.49 ng/mL上升至1.49 ng/mL,阴茎较前无变化,阴毛较前增多,符合Tanner Ⅲ期标准。病例2呈现出类似的临床表现。4例痴笑性癫痫病例术后效果良好,其中3例癫痫无发作,疗效达Engel Ⅰ级;1例疗效达Engel Ⅲ级;癫痫发作频率降低75%以上(表 2)。
| 表 2 6例病例术后随访情况 Table 2 Follow-up profiles of 6 cases |
|
|
下丘脑错构瘤为儿童罕见病变,并非真性肿瘤,病灶由类似灰质样的异位神经组织构成,主要包含分化良好、形态各异、不规则分布的神经元结节灶及散在分布的胶质细胞[2]。有研究表明下丘脑错构瘤起源于乳头体或灰结节,与妊娠第35~40天形成下丘脑板时错位有关,是一种中线神经管闭合不全综合征。下丘脑错构瘤极为罕见,据估计其发病率为1/100万~2/100万[4]。随着神经影像学的学科发展和MRI的普及,相关文献报道逐渐增多[5-7]。
罗世琪等[1]根据错构瘤与下丘脑的位置关系,将其分为Ⅰ~Ⅳ型:Ⅰ型错构瘤与下丘脑附着面小,呈有蒂型,性早熟表现明显, 也可无任何症状;Ⅱ型错构瘤与下丘脑附着面宽大,三脑室底无明显变形,可有性早熟和(或)痴笑性癫痫;Ⅲ型为错构瘤,瘤体骑跨于三脑室底,临床表现以癫痫为主;Ⅳ型错构瘤完全位于三脑室内,症状以癫痫为主,几乎没有性早熟。本组Ⅱ型5例,Ⅳ型1例,平均发病年龄为3.5岁,手术时平均年龄为4.3岁。临床表现:性早熟2例,均为Ⅱ型;痴笑性癫痫4例,其中Ⅱ型3例,Ⅳ型1例。
中枢性性早熟是下丘脑错构瘤的主要临床表现之一,据国内最大病例组统计,43.9%的病例临床症状为性早熟,其中Ⅰ型占67%,本组2例均为Ⅱ型[1]。研究表明内源性促性激素释放激素(Endogenous gonadotropin releasing hormone,GnRH)异常增高为其主要原因。越来越多研究表明,促性腺激素释放激素类似物(Gonadotropin releasing hormone analogues,GnRHa)具有疗效确切、安全性高等优点。多项研究报道,给予性早熟病例曲普瑞林规律治疗后,患者临床症状明显得到控制,同时1例性早熟女童手术疗效欠佳[5, 7, 8]。但罗世琪[9]报道6例单纯性早熟下丘脑错构瘤患者经显微手术切除病灶后,性早熟症状消失,手术效果良好。本组2例性早熟病例均为镜下全切,术后身高增长速度显著减缓,由术前每年15 cm下降至术后每年6 cm,实验室检查提示生长激素及睾酮水平较术前大幅下降。随访过程中发现尽管睾酮水平在正常范围内,但与同年龄段儿童相比仍可能偏高,表现为声音较术前无变化,阴毛较前略增多,提示错构瘤或存在微量残留,治疗效果欠佳,仍需药物补充治疗。Romas等[10]长期随访了15例经药物治疗的由下丘脑错构瘤导致的性早熟病例,药物治疗持续时间为(7.7±2.4)年,随访结束时患者年龄为(21.5±3.2)岁,除1例药物不耐受外,其余14例最终均达到正常身高,其中3例男性患者育有正常的后代,说明药物治疗安全有效。因此,综合考虑显微手术带来的收益和风险,建议对表现为单纯性早熟型的下丘脑错构瘤患者尝试使用药物治疗,由儿科及内分泌科联合诊疗;对于药物不耐受者,可手术切除病灶。
痴笑性癫痫是下丘脑错构瘤的另一主要临床症状,除发笑或痴笑外,还可能有哭泣样发作,未经治疗则有可能出现癫痫症状的进展,表现为其他形式的药物难治性癫痫,包括强直发作、肌阵挛发作或继发性全身发作等。据统计,约49.5%的下丘脑错构瘤病例可出现癫痫及相关症状[11]。有研究表明错构瘤本身具有致癫性,癫痫波起源于错构瘤,可经乳头体、穹隆、乳头丘脑束、扣带回、杏仁核,最终达边缘系统或额叶及顶叶区域。因此除了痴笑性癫痫,还可能存在其他多种形式的癫痫症状。痴笑性癫痫多发生于Ⅲ型和Ⅳ型病例,Ⅱ型也较常见,本组3例为Ⅱ型,占比75%。痴笑性癫痫为药物难治性癫痫,多项研究均表明手术疗效确切[12, 13]。本组均采用开颅显微手术切除病灶,全切1例,次全切2例,大部分切除加离断1例,术后癫痫控制良好,3例未发作,1例发作频率降低75%以上。头顶下垂、骨窗尽量平中颅底、充分分离侧裂近端、游离颈内动脉及分支和视交叉并避免过度牵拉、保护细小血管穿支是达到全切同时避免损伤重要结构的保证。尽管如此,对于对侧生长的错构瘤,手术对侧基底部仍可能存有残留,内镜观察辅助可能是有效的解决办法。术中尤其要注意保护下丘脑,以防术后出现严重反应。本组病例术后均出现不同程度的中枢性高热,无食欲改变、尿崩及电解质紊乱等严重并发症。射频热凝毁损术(尤其是SEEG监测下的射频热凝毁损术)近年来逐步得到应用,并显示出疗效好、损伤小的优点,尤其是对于中小体积的错构瘤[12, 14]。对于显微手术无法全切或术后癫痫症状控制不佳的病例,射频毁损术也是良好的补充。但目前尚无对照研究来判断两种术式的优劣。
本组中1例为Pallister-Hall综合征(Pallister-Hall syndrome,PHS),为一4岁男童,症状为痴笑发作6个月,伴随双手尺侧多指及并指畸形,双足多趾畸形。MRI示瘤体位于三室内,左侧乳头体后上方,大小约9 mm×10 mm,为Ⅳ型。经纵裂- 胼胝体- 穹隆间入路全切病灶,术后随访3个月癫痫无发作。基因检查提示存在GLI3基因突变,无家族史,为散发病例。PHS是指与GLI3基因突变相关的,以下丘脑错构瘤伴多指/趾畸形、会厌分叉、肛门闭锁、耳蜗发育异常、循环及泌尿系统异常为特点的罕见疾病,诊断标准为下丘脑错构瘤伴发多指趾畸形,也包括直系亲属患下丘脑错构瘤或多指趾畸形中任何一项,具有常染色体显性遗传倾向[15]。临床发现下丘脑错构瘤病例时,应考虑到PHS可能,注意寻找可能存在的其他相关异常,以全面评估患者病情。
综上所述,儿童下丘脑错构瘤临床较为罕见,以痴笑性癫痫、中枢性性早熟为主要临床症状,前者手术治疗安全有效,后者宜首选药物治疗。
| [1] |
罗世琪, 李春德, 马振宇, 等. 214例下丘脑错构瘤分型与临床症状[J]. 中华神经外科杂志, 2009, 25(9): 788-792. Luo SQ, Li CD, Ma ZY, et al. Classifications and clinical manifestations of hypothalamic hamartoma: a report of 214 cases[J]. Chin J Neurosurg, 2009, 25(9): 788-792. DOI:10.3760/cma.j.issn.1001-2346.2009.09.011 |
| [2] |
Alomari SO, Houshiemy MN, Bsat S, et al. Hypothalamic hamartomas: A comprehensive review of the literature-Part 1:Neurobiological features, clinical presentations and advancements in diagnostic tools[J]. Clin Neurol Neurosurg, 2020, 197: 106076. DOI:10.1016/j.clineuro.2020.106076 |
| [3] |
Zhang HW, Li Y, Liu BF, et al. Hypothalamic hamartoma, gray matter heterotopia, and polymicrogyria in a boy: case report and literature review[J]. World Neurosurgery, 2020, 142: 396-400. DOI:10.1016/j.wneu.2020.07.098 |
| [4] |
Kerrigan JF, Ng Y, Chung S, et al. The hypothalamic hamartoma: a model of subcortical epileptogenesis and encephalopathy[J]. Semin Pediatr Neurol, 2005, 12(2): 119-131. DOI:10.1016/j.spen.2005.04.002 |
| [5] |
黎思宇, 葛明, 孙骇浪, 等. 儿童下丘脑错构瘤18例临床分析[J]. 中华实用儿科临床杂志, 2019, 34(6): 462-463. Li SY, Ge M, Sun HL, et al. Clinical analysis of hypothalamic hamartoma in 18 children[J]. Chin J Appl Clin Pediatr, 2019, 34(6): 462-463. DOI:10.3760/cma.j.issn.2095-428X.2019.06.015 |
| [6] |
华刚, 谭红平, 姜楠, 等. SEEG引导下射频热凝毁损术在癫痫外科中的应用[J]. 立体定向和功能性神经外科杂志, 2020, 33(2): 69-73. Hua G, Tan HP, Jiang N, et al. Application of SEEG-guided radiofrequency thermocoagulation during epilepsy surgery[J]. Chin J Stereotact Funct Neurosurg, 2020, 33(2): 69-73. DOI:10.19854/j.cnki.1008-2425.2020.02.0002 |
| [7] |
Ramos CO, Latronico AC, Cukier P, et al. Long-term outcomes of patients with central precocious puberty due to hypothalamic hamartoma after GnRHa treatment: anthropometric, metabolic, and reproductive aspects[J]. Neuroendocrinology, 2018, 106(3): 203-210. DOI:10.1159/000477584 |
| [8] |
Harrison VS, Oatman O, Kerrigan JF. Hypothalamic hamartoma with epilepsy: Review of endocrine comorbidity[J]. Epilepsia, 2017, 58(2): 50-59. DOI:10.1111/epi.13756 |
| [9] |
罗世琪, 李春德, 马振宇, 等. 下丘脑错构瘤所致单纯性早熟的显微外科治疗[J]. 中华神经外科杂志, 2000, 16(6): 341-343. Luo SQ, Li CD, Ma ZY, et al. Microsurgical treatment of hypothalamic hamartoma causing precocious puberty[J]. Chin J Neurosurg, 2000, 16(6): 341-343. DOI:10.3760/j.issn:1001-2346.2000.06.001 |
| [10] |
Ramos CO, Latronico AC, Cukier P, et al. Long-term outcomes of patients with central precocious puberty due to hypothalamic hamartoma after GnRH analog treatment: anthropometric, metabolic and reproductive aspects[J]. Neuroendocrinology, 2018, 106(3): 203-210. DOI:10.1159/000477584 |
| [11] |
Valentin A, Lazaro M, Mullatti N, et al. Cingulate epileptogenesis in hypothalamic chamartoma[J]. Epilepsia, 2011, 52(5): e35-e39. DOI:10.1111/j.1528-1167.2011.03060.x |
| [12] |
Wang M, Zhang Y, Xue P, et al. Optimized SEEG-guided radiofrequency thermocoagulation in the treatment of pediatric hypothalamic hamartomas[J]. Seizure, 2021, 86: 102-108. DOI:10.1016/j.seizure.2021.01.023 |
| [13] |
张宏武, 刘宝富, 高阳旭, 等. 下丘脑错构瘤所致癫痫的手术治疗[J]. 中华神经外科杂志, 2016, 32(9): 878-881. Zhang HW, Liu BF, Gao YX, et al. Surgical treatment of epilepsy caused by hypothalamic hamartomas[J]. Chin J Neurosurg, 2016, 32(9): 878-881. DOI:10.3760/cma.j.issn.1001-2346.2016.09.004 |
| [14] |
Wang D, Shan YZ, Bartolomei F, et al. Electrophysiological properties and seizure networks in hypothalamic hamartoma[J]. Ann Clin Transl Neurol, 2020, 7(5): 653-666. DOI:10.1002/acn3.51033 |
| [15] |
Ito S, Kitazawa R, Haraguchi R, et al. Novel GLI3 variant causing overlapped Greig cephalopolysyndactyly syndrome (GCPS) and Pallister-Hall syndrome (PHS) phenotype with agenesis of gallbladder and pancreas[J]. Diagn Pathol, 2018, 13(1): 1. DOI:10.1186/s13000-017-0682-8 |
 2021, Vol. 20
2021, Vol. 20


