2. 广州市妇女儿童医疗中心神经外科(广东省广州市, 510000)
2. Department of Neurosurgery, Guangzhou Women & Children's Medical Center, Guangzhou 510120, China
脑肿瘤是儿童神经系统常见疾病,也是儿童癫痫的常见病因,约13%的儿童脑肿瘤以癫痫起病。关于癫痫病理的大宗回顾性研究指出,肿瘤约占23.6%(2 244/9 523),仅次于皮质发育畸形[1]。胚胎发育不良性神经上皮肿瘤(disembryoplastic neuroepithelial tumor, DNT)好发于儿童及青少年,主要是指以癫痫起病、生长缓慢且手术预后良好的神经胶质混合性肿瘤,是长期癫痫相关脑肿瘤(long-term epilepsy associated tumor, LEAT)的常见类型[2, 3]。手术治疗的关键是在保证安全的前提下最大范围切除肿瘤及致痫皮层,而术中皮层脑电图(electrocorticography, ECoG)监测有利于周围致痫皮层的定位及切除。笔者回顾性分析广州市妇女儿童医疗中心近年来诊治的14例儿童DNT临床特点及外科治疗方案,现报告如下。
材料与方法 一、临床资料入组标准:符合国际抗癫痫联盟(International League Against Epilepsy, ILAE)癫痫诊断标准,影像学检查提示脑肿瘤改变,以癫痫起病,术后病理检查结果提示DNT。排除标准:合并遗传代谢性疾病。符合入组标准的患者共14例,其中男11例,女3例。年龄4个月至13岁,平均4.64岁。病程1周至3年,平均10.46个月。均以癫痫发作起病,其中局灶性发作9例,全面性发作5例。术前接受抗癫痫药物治疗5例,效果不佳(表 1)。
| 表 1 14例DNT患者临床资料 Table 1 Clinical data of 14 DNT children |
|
|
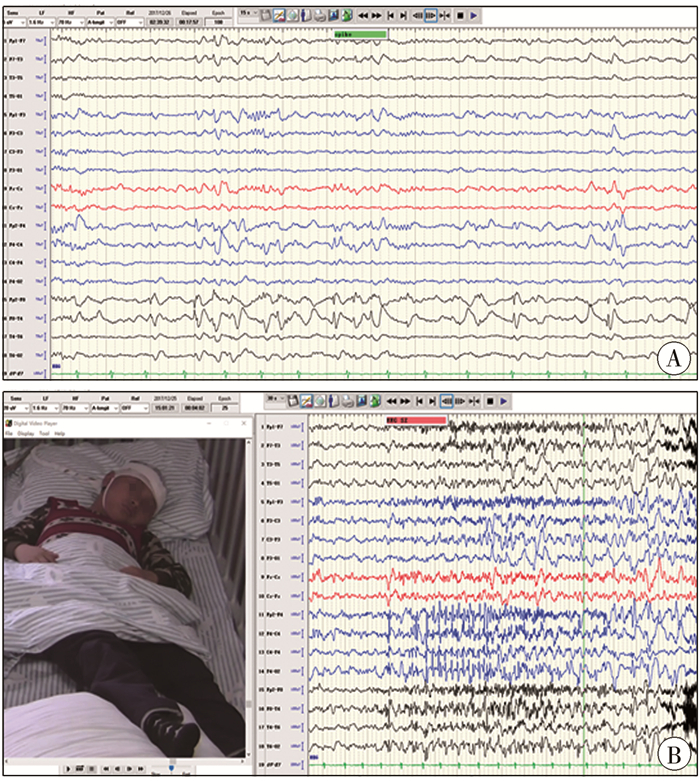
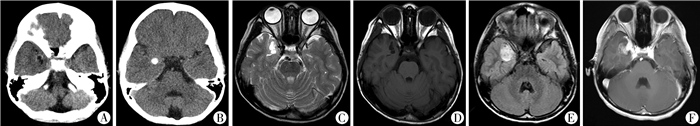
患者均接受详细的术前评估(包括症状学、脑电图、影像学、神经心理评估等。)以及长程视频脑电图检查(video-electroencephalogram, v-EEG),记录发作间期及发作期,至少捕捉惯常发作3次以上,其中发作间期局灶放电9例,全面性放电5例(图 1)。患者均行头颅MRI增强扫描检查以明确肿瘤位置,影像学检查结果提示肿瘤位于颞叶9例、额叶3例、顶叶枕叶各1例;14例MRI表现为不同程度的T1WI低信号、T2WI高信号、Flair高信号改变。增强扫描强化4例,不强化10例,出现囊性分隔7例,倒三角征1例。1例行CT检查,病变为混杂密度改变(图 2)。神经心理评估:3岁以上采用韦氏智力量表,3岁以下采用Gesell发育量表。结合病史、症状学、影像学及电生理等资料进行多学科讨论,明确肿瘤与致痫区的关系,制定手术治疗方案(包括手术入路、切除范围的设计、避免功能区损伤措施等)。
|
图 1 DNT患者术前脑电图 A: 术前发作间期脑电图提示右侧前颞区异常放电;B: 术前发作期脑电图提示发作起始于右侧前颞区 Fig.1 Preoperative electroencephalogram A: Preoperative interictal EEG indicated abnormal discharge in right anterior temporal region; B: Preoperative ictal EEG indicated the origin in right anterior temporal region |
|
图 2 DNT患者典型影像学图片 注 A: CT提示右侧颞叶低密度改变;B: CT提示右侧颞叶高密度改变;C: MRI T2WI高信号;D: MRI T1WI低信号;E: MRI Flair高信号;F: MRI+C中等强化 Fig.2 Typical DNT imaging features A: CT hinted at hypodensity changes in right temporal lobe; B: CT showed a high density change in right temporal lobe; C: MRI T2WI hyperintense signal; D: MRI T2WI hypointense signal; E: MRI Flair hyperintense signal; F: MRI+C moderate enhancement |
患者均接受手术治疗,根据肿瘤所在部位选择合适的手术入路。手术入路选择的原则:手术路径最短、充分显露术野、避开重要血管及脑功能区,必要时用神经导航辅助。开颅成功后,切开硬脑膜显露肿瘤及周围皮层,周围皮层显露至少3 cm以上。先行术中ECoG监测,以了解病变及周围皮层放电情况,解剖蛛网膜,逐渐沿肿瘤边缘分离,先切除肿瘤,再反复用ECoG指导周围致痫皮层的切除范围,直至放电明显减少或消失。如肿瘤位于运动区,周围致痫皮层采用低电流热凝处理软脑膜,以免损伤功能。
四、术后管理术后患者常规进入儿科ICU监护治疗,适当给予脱水、抗感染、营养神经、改善循环等对症支持治疗。术后继续服用抗癫痫药物,一般根据术后癫痫控制情况、肿瘤切除程度、术后3个月复查脑电图结果等综合分析,以决定是否调整药物治疗方案。术后常规行腰椎穿刺术了解有无术后感染、出血等。
五、随访及疗效评价分别于术后1个月、3个月及6个月通过电话、微信、门诊等方式进行随访,采用Engel疗效评价标准对术后疗效进行评价:Ⅰ级,无癫痫发作;Ⅱ级:极少癫痫发作;Ⅲ级:癫痫发作频率及严重程度仅有轻度改善;Ⅳ级:癫痫发作基本无改善,甚至加重[4]。
结果患者均接受手术治疗,术中均行ECoG监测(图 3)。其中肿瘤+周围致痫皮层切除术12例,单纯肿瘤切除术1例,肿瘤大部分切除术1例,术后病理均提示为DNT(图 4)。术后颅内感染4例,对侧肢体肌力下降1例,2周后恢复至正常水平,无死亡病例。

|
图 3 DNT患者术中ECoG A: 切除前先行ECoG;B: 术中ECoG提示周围皮层异常放电 图4 典型DNT患者病理特点A: 大体标本;B: 镜下见结节状神经胶质细胞增生;C: 镜下见周围皮层神经元排列紊乱 Fig.3 Intraoperative ECoG A: ECoG before resection; B: Intraoperative ECoG suggested abnormal peripheral cortex discharge Fig.4 Typical DNT pathological features A: Gross specimen; B: Nodular glial cell proliferation was evident under microscope; C: Peripheral cortical neurons were disorderly |
按Engel分级判断术后疗效,其中EngelⅠ级13例(92.86%),Ⅲ级1例(7.14%);该例Ⅲ级患者肿瘤与大脑中动脉黏连明显,无法全切,术后癫痫发作缓解,3个月后再次出现癫痫发作。目前已有7例停抗癫痫药物。
讨论1988年法国神经病理学家Daumas-Dupport首次提出DNT这一概念,并指出DNT是神经元神经胶质混合性肿瘤中的常见类型[5]。DNT好发于儿童及青少年,男性多见,反复癫痫发作通常是其唯一临床表现,局部占位效应及恶性进展罕见,部分患者伴有精神运动发育落后及认知功能损害。文献报道,DNT发病率不高,仅占神经上皮肿瘤的0.2% ~1.2%,但其伴发癫痫的比例却高达96%,通常药物治疗效果不佳,以局灶性发作为主,全面性发作多见于低龄婴幼儿,误诊为婴儿痉挛症的患者也不在少数,可能是由于脑发育未成熟早期电扩散所致[6]。本组14例中男性居多,均以癫痫起病(100%),与文献报道基本一致。
DNT常见于幕上,主要以颞叶为主,其次是额叶、顶叶、枕叶等。病变主要累及皮层及皮层下白质,罕见于基底节、中线部位及幕下[7]。DNT影像学表现具有一定的特征,CT平扫为低或等密度改变,偶见斑点状钙化[8]。本组中1例以反复肢体抽搐起病,头颅CT提示右侧颞叶低密度改变,被误诊为抽动障碍、脑软化灶长达2年。MRI具有更高的组织分辨能力及多序列扫描等特点,在DNT诊断上具有更大的优势。典型的DNT表现为T1WI低信号,T2WI高信号,边界清楚,周围无水肿,无明显占位效应;增强MRI大多数无强化,部分呈斑片状、结节状强化改变。此外,囊性变、瘤内分隔、倒三角征等也是典型DNT MRI改变[9]。值得注意的是,2岁前的儿童存在髓鞘化发育现象,DNT长T1、长T2改变可能被误认为是正常髓鞘化现象,容易漏诊。因此,对于临床表现为癫痫发作但首次MRI表现为阴性的低龄儿童患者,动态复查MRI十分必要。部分复杂型DNT病变周围可表现为Flair高信号改变,可能合并肿瘤周围皮层发育不良,该区域切除是术后癫痫控制的关键[10]。本组14例影像学检查均表现为典型的不同程度的T1WI低信号、T2WI高信号以及Flair高信号改变,术前影像学诊断符合率达85.71%。
病理结果是诊断DNT的金标准,典型的DNT大体标本呈灰白色,部分可出现结节、囊性变、出血等。镜下可见神经元、神经胶质及发育不良皮层改变,肿瘤细胞多呈小圆形,无核分裂像,无血管浸润[11]。根据肿瘤形态特征及成分不同,DNT分为3个亚型:单纯性、复杂型、非特异型;其中,非特异型缺乏典型的神经胶质成分,有时与胶质瘤难以鉴别,需要结合临床表现及影像学检查等综合判断,免疫组织化学染色对鉴别诊断有一定的帮助[12]。有文献指出,DNT存在双重病理现象,尤其是以癫痫起病的患者,肿瘤周围皮层合并皮层发育不良达100%[13]。本组14例中5例为单纯型(35.71%),9例为复杂型(64.29%),复杂型比例较文献报道略低,可能与周围致痫皮层范围的界定、病理取材有一定的关系。
DNT通常以癫痫起病,药物难以治疗,手术是唯一有效的治疗方法。手术方案的制定需要充分考虑病变的位置、脑电图特征及影像学改变等。手术方式分为单纯的肿瘤切除及周围致痫皮层的扩大切除。有文献报道DNT手术后绝大多数可获得良好的肿瘤切除及癫痫控制效果,EngelⅠ级率可达83%,术中ECoG的应用及周围致痫皮层的扩大切除有助于获得更好的癫痫控制效果[14, 15]。另外,癫痫病程时间、肿瘤切除程度均是癫痫预后的独立影响因素。DNT为WHOⅠ级,肿瘤生长缓慢,手术效果良好,复发罕见,5年OS及9年OS分别达98%及96%,但也偶见因肿瘤与周围结构关系密切不能全切而导致癫痫控制不佳的报道。本组1例Engel Ⅳ级,肿瘤与大脑中动脉关系密切,不能全切,术后3个月再次出现癫痫发作,故力争肿瘤全切是治疗的关键。
综上所述,DNT是儿童常见的长期癫痫相关脑肿瘤之一,癫痫是其主要的临床表现,影像学上具有特征性改变。手术应贯彻癫痫外科治疗理念。完全切除肿瘤、术中使用ECoG、切除周围致痫皮层是保证术后癫痫控制良好的关键因素。
| [1] |
Blumcke I, Spreafico R, Haaker G, et al. histopathological findings in brain tissue obtained during epilepsy surgery[J]. N Engl J Med, 2017, 377(17): 1648-1656. DOI:10.1056/NEJMoa1703784 |
| [2] |
Luyken C, Blümcke I, Fimmers R, et al. The spectrum of long-term epilepsy-associated tumors: long-term seizure and tumor outcome and neurosurgical aspects[J]. Epilepsia, 2003, 44(6): 822-830. DOI:10.1046/j.1528-1157.2003.56102.x |
| [3] |
Thom M, Blümcke I, Aronica E. Long-term epilepsy-associated tumors[J]. Brain Pathol, 2012, 22(3): 350-379. DOI:10.1111/j.1750-3639.2012.00582.x |
| [4] |
Scheffer IE, Berkovic S, Capovilla G, et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology[J]. Epilepsia, 2017, 58(4): 512-521. DOI:10.1111/epi.13709 |
| [5] |
Engel J. Early versus late surgery for intractable seizures[J]. Adv Exp Med Biol, 2002, 497: 99-105. DOI:10.1007/978-1-4615-1335-3_11 |
| [6] |
Daumas-Duport C, Scheithauer BW, Chodkiewicz JP, et al. Dysembryoplastic neuroepithelial tumor: a surgically curable tumor of young patients with intractable partial seizures.Report of thirty-nine cases[J]. Neurosurgery, 1988, 23(5): 545-556. DOI:10.1227/00006123-198811000-00002 |
| [7] |
方庆和, 刘世忠, 庄楠, 等. 胚胎发育不良性神经上皮肿瘤附6例病例分析[J]. 医学影像学杂志, 2013, 23(5): 669-671. Fang QH, Liu SZ, Zhuang N, et al. Dysembryoplastic neuroepithelial tumor: a report of 6 cases[J]. Journal of Medical Imaging, 2013, 23(5): 669-671. |
| [8] |
Stanescu Cosson R, Varlet P, Beuvon F, et al. Dysembryoplastic neuroepithelial tumors: CT, MR findings and imaging follow-up: a study of 53 cases[J]. J Neuroradiol, 2001, 28(4): 230-240. |
| [9] |
郭强, 张伟, 朱丹. 儿童致痫性低级别肿瘤的手术策略与切除范围设计[J]. 临床小儿外科杂志, 2019, 18(9): 719-722. Guo Q, Zhang W, Zhu D. Surgical strategies and scope of resecting epileptic low-grade tumors in children[J]. J Clin Ped Sur, 2019, 18(9): 719-722. DOI:10.3969/j.issn.1671-6353.2019.09.002 |
| [10] |
Onishi S, Amatya VJ, Kolakshyapati M, et al. T2-FLAIR mismatch sign in dysembryoplastic neuroepithelial tumor[J]. Eur J Radiol, 2020, 126(5): 108924. DOI:10.1016/j.ejrad.2020.108924 |
| [11] |
李方成, 李军亮. 小儿脑血管疾病的诊断要点及外科治疗理念[J]. 临床小儿外科杂志, 2019, 18(9): 713-718. Li FC, Li JL. Key points and concepts in the diagnosis and treatment of cerebrovascular diseases in children[J]. J Clin Ped Sur, 2019, 18(9): 713-718. DOI:10.3969/j.issn.1671-6353.2019.09.001 |
| [12] |
刘雪青, 沈艳玲, 杨文圣. 胚胎发育不良性神经上皮肿瘤4例临床病理观察[J]. 诊断病理学杂志, 2019, 26(9): 582-586. Liu XQ, Shen YL, Yang WS. Dysembryoplastic neuroepithelial tumor: a clinicopathological analysis of four cases[J]. Chinese Journal of Diagnostic Pathology, 2019, 26(9): 582-586. DOI:10.3969/j.issn.1007-8096.2019.09.008 |
| [13] |
Chassoux F, Landré E, Mellerio C, et al. Dysembryoplastic neuroepithelial tumors: epileptogenicity related to histologic subtypes[J]. Clin Neurophysiol, 2013, 124(6): 1068-1078. DOI:10.1016/j.clinph.2012.11.015 |
| [14] |
Vecht C, Royer-Perron L, Houillier C, et al. Seizures and anticonvulsants in brain tumours: frequency, mechanisms and anti-epileptic management[J]. Curr Pharm Des, 2017, 23(42): 6464-6487. DOI:10.2174/1381612823666171027130003 |
| [15] |
Fallah A, Weil AG, Sur S, et al. Epilepsy surgery related to pediatric brain tumors: Miami Children's Hospital experience[J]. J Neurosurg Pediatr, 2015, 16(6): 675-680. DOI:10.3171/2015.4.PEDS14476 |
 2021, Vol. 20
2021, Vol. 20


