2. 深圳华大生命科学研究院(广东省深圳市, 518083);
3. 首都医科大学附属北京天坛医院神经外科(北京市, 100070);
4. 首都医科大学附属北京世纪坛医院儿科(北京市, 100070);
5. 首都儿科研究所附属儿童医院神经外科(北京市, 100045)
2. BGI-Shenzhen, Shenzhen 518083, China;
3. Department of Neurosurgery, Beijing Tiantan Hospital, Capital Medical Univeristy, Beijing 100070, China;
4. Department of Pediatrics, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China;
5. Department of Neurosurgery, Capital Institute of Pediatrics, Beijing 100038, China
髓母细胞瘤是一种病变位于后颅窝的高度恶性肿瘤,约占儿童期中枢神经系统肿瘤的20%[1]。2016年版世界卫生组织病理分型系统将其分为5个病理亚型:经典型(classic)、促纤维增生/结节型(desmoplastic/nodular)、广泛结节形成型(medulloblastoma with extensive nodularity, MBEN)、大细胞型(large cell)和间变型(anaplastic)。其中大细胞型和间变型因预后较差,统称为LC/A亚型[2-4]。国内外统计显示,髓母细胞瘤患者的5年存活率为50% ~70%[5, 6]。近年来髓母细胞瘤的研究方向已经深入基因层面,根据肿瘤细胞基因突变情况、甲基化情况对髓母细胞瘤进行分子分型,共分为4个亚型:WNT亚型、SHH亚型、Group 3亚型以及Group 4亚型。临床通过分子分型、患者年龄、病理类型、是否转移等将髓母细胞瘤分为不同危险等级,给予不同放化疗组合方案。
部分髓母细胞瘤患者存在基因胚系突变,可导致遗传性综合征,最常见为Gorlin-Goltz综合征(Gorlin-Goltz syndrome,GS综合征),又称之为痣样基底细胞癌综合征(nevoid basal cell carcinoma syndrome, NBCCS,MIM #109400),属于临床少见的常染色体显性遗传性疾病[7]。GS综合征相关髓母细胞瘤属于SHH亚型髓母细胞瘤首选化疗,多预后良好[8]。国内对于髓母细胞瘤相关的GS综合征认识及治疗方案尚不统一。本研究分析了2014年1月至2021年1月首都医科大学附属北京天坛医院收治的8例GS综合征临床资料,以提高对该病的认识。
材料与方法 一、一般资料本研究获得首都医科大学附属北京天坛医院伦理委员会批准(KY2019 - 098 - 1)。8例中,男4例,女4例;7例年龄在3岁以下(9~36个月,平均19个月),1例9岁。临床表现:3例头围增大,7例呕吐,5例走路不稳。患者5及患者7被纳入本课题组既往研究中[8]。
二、手术情况及病理分型8例均行肿瘤切除手术,其中2例首次手术为大部切除术,复发后行二次手术(病例7首次手术和病例5复发后再次手术为本院手术,其他均为外院手术)。根据病理报告,7例为促纤维增生/结节型,1例为广泛结节形成型。
三、分子分型采用泛生子公司的分子分型平台,通过检测髓母细胞瘤相关的39个基因(APC/ARID1B/BCOR/CDH1/CDK6/CHD7/CREBBP/CSNK2B/CT-DNEP1/CTNNB1/DDX31/DDX3X/GABRG1/GFI1/GFI1B/GLI2/GPS2/KDM4C/KDM6A/KMT2B/LDB-1/MLL3/MYC/MYCN/NCOR2/OTX2/PIK3CA/PTC-H1/PTCH2/PTEN/SMARCA4/SMARCC2/SMARCD-2/SMO/SNCAIP/SUFU/TERT/TP53/ZMYM3) 点突变、插入、缺失和5个基因(CDK6/GLI2/MYC/MYCN/OTX2) 拷贝数变异情况,通过低深度全基因组测序检测大片段缺失/扩增结果(1p/2q/3q/4p/4q/13p/21q)预测髓母细胞瘤四种分子分型。
四、Gorlin-Goltz综合征诊断标准采用2011年修订版Gorlin-Goltz综合征诊断标准,包括6个主要标准和6个次要标准。主要标准包括:①超过2个基底细胞癌,或患者在20岁之前患有基底细胞癌;②牙源性角化囊肿;③3个及以上的掌跖坑状凹陷;④大脑镰或小脑幕钙化;⑤分叉肋或融合肋;⑥家族中一级亲属患有痣样基底细胞癌综合征(Gorlin-Goltz syndrome, GS综合征)。次要标准包括:①颅骨畸形:巨头畸形、眶距增宽;②先天性面部畸形:唇裂或腭裂;③其他骨骼畸形:高位肩胛、胸骨畸形和并指畸形;④影像学表现:脊柱畸形、手脚畸形;⑤卵巢纤维瘤;⑥髓母细胞瘤。患者需满足两条主要标准,或者一条主要标准和两条次要标准,或者一条主要标准伴基因检测结果阳性,即可诊断为Gorlin-Goltz综合征。随访从手术切除肿瘤开始,至末次随访或者患者死亡时结束,随访方法为电话随访结合门诊复诊。
五、基因检测解读标准使用4种数据库对已鉴定的变异进行频率过滤:1000 Genomes Project (http://browser.1000genomes.org/),dbSNP (http://www.ncbi.nlm.nih.gov/projects/SNP/), ESP6500(http://evs.gs.washington.edu/EVS/), ExAC (http://exac.broadinstitute.org)。潜在致病变异使用以下3种方法预测:Sorting Intolerant from Tolerant (SIFT, http://sift.jcvi.org/), Polymorphism Phenotyping v2 (PolyPhen-2, http://genetics.bwh.harvard.edu/pph2/), MutationTaster software (http://www.mutationtaster.org/)。最后,剩下的变异使用ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/), HGMD(http://www.hgmd.cf.ac.uk/ac/index.php) 数据库,结合潜在的有害性影响、基因型-表型关系分析、文献报道以及“ACMG遗传变异分类标准与指南”,将相关变异分为“致病的”、“可能致病的”、“意义不明确的”、“可能良性的”和“良性的”5类。
结果 一、临床预后截至2021年2月,患者平均随访38个月(1~78个月),1例围手术期因肺部感染死亡,其余7例均存活。7例中,手术后单纯放疗2例,单纯化疗4例,放疗+化疗1例。2例肿瘤复发,目前化疗中。1例发病时3岁,因后颅窝肿瘤手术切除,给予全脑脊髓放疗(全脑脊髓轴放疗30.6 Gy,瘤床55.0 Gy),手术后5年因颌骨囊肿于外院口腔科手术治疗,其后发现头皮基底细胞癌行切除手术。
二、基因检测和Gorlin-Goltz综合征诊断结果除病例2外,7例接受基因检测,其中SUFU基因胚系突变4例,PTCH1基因胚系突变2例,PTCH2基因胚系突变1例,均可明确诊断为Gorlin-Goltz综合征。2例无分子分型结果,其余均为SHH亚型。见表 1。
| 表 1 8例儿童髓母细胞瘤合并Gorlin-Goltz综合征患者诊治资料 Table 1 Diagnosis and treatment data of 8 children with medulloblastoma-related Gorlin-Goltz syndrome |
|
|
表 1中病例1、病例2和病例3属于同一家族(图 1至图 3),手术时年龄分别为19个月、21个月、21个月,手术前均表现出“呕吐、进食差、行走不稳”等颅内压升高、小脑受压症状,行头颅CT/MRI等检查,发现后颅窝病变,合并梗阻性脑积水,于外院行肿瘤近全切除,病理结果均为促纤维增生/结节型髓母细胞瘤。病例2手术后出现肺部感染,于围手术期死亡。病例1和病例3于外院继续化疗,定期复查,随访过程中未见肿瘤复发。病例1、病例3于我院行基因检测,明确诊断为SUFU基因胚系突变,结合发病年龄、病理诊断和基因检测,明确诊断为GS综合征。病例2手术时未行基因检测,但结合其病理诊断和家属史可确诊GS综合征。我们对以上3例患者的部分家族成员行头颅CT检查,发现颅内大脑镰、小脑幕等异常钙化,可以明确诊断为Gorlin-Goltz综合征。
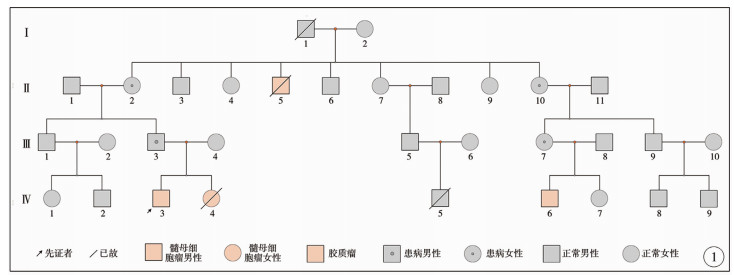
|
图 1 髓母细胞瘤合并Gorlin-Goltz综合征患者家系图 Fig.1 Family diagram of patients with Gorlin-Goltz syndrome related to medulloblastoma |
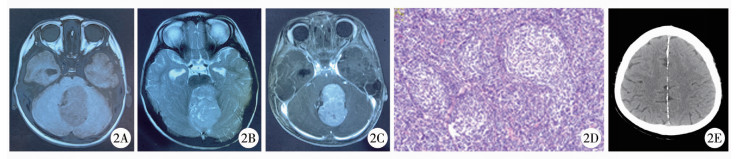
|
图 2 患者1的影像学和病理学检查图片 注 19月龄男性患者,肿瘤位于第四脑室,T1加权MRI可见病变位置呈低信号(A),T2加权MRI高信号,肿瘤强化明显(B、C);病理诊断为促纤维增生/结节型髓母细胞瘤(D); 患者父亲头颅CT见大脑镰钙化明显(E) Fig.2 Imaging and pathological examination results of patients with Gorlin-Goltz syndrome related to medulloblastoma |
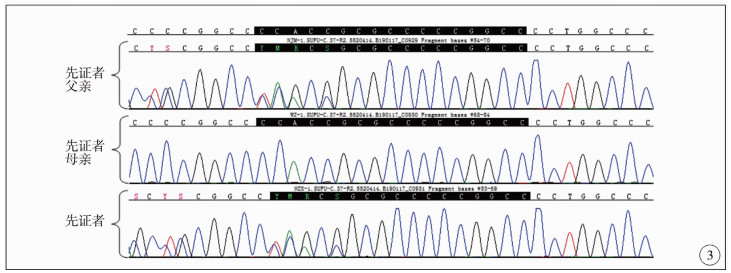
|
图 3 SUFU基因突变检测结果,先证者、先证者父亲可见突变,先证者母亲突变检测结果阴性 Fig.3 SUFU gene mutation test results |
GS综合征在婴幼儿髓母细胞瘤中主要见于SHH亚型髓母细胞瘤,和婴幼儿促纤维增生/广泛结节形成型髓母细胞瘤存在密切关联。Garre等[9]调查了82例14岁以下的髓母细胞瘤患者,共发现5例Gorlin-Goltz综合征,年龄均在3岁以下,病理结果为促纤维增生/结节型或者广泛结节形成型,预后良好。2018年,Waszak等[10]调查发现SUFU/PTCH1基因胚系突变约占婴幼儿SHH亚型髓母细胞瘤的21%。
GS综合征筛查在髓母细胞瘤诊断和治疗中有重要临床意义,对符合GS综合征的髓母细胞瘤患者以化疗为一线治疗方案多可获得良好预后;而采用放疗方案,二次肿瘤(基底细胞癌、脑膜瘤等)发生概率会明显增加,应尽量避免[9, 10]。为降低二次肿瘤发生率,此类患者应尽可能减少放射学检查(X线、CT),建议采用超声或磁共振检查;在日常生活中,也要减少紫外线照射,外出应用遮阳伞、太阳镜等防止日光照射[9]。本组中病例7行全脑脊髓放疗后5年出现头皮基底细胞癌,佐证了该观点[8];既往我院曾报道1例患者放疗后出现胸腔淋巴瘤导致死亡,符合Gorlin-Goltz综合征诊断,但暂无基因诊断结果,故未纳入本研究[11]。
Gorlin-Goltz综合征的3种典型表现为多发基底细胞癌、颌骨囊肿(keratocysts)、颅内钙化(cerebral calcifications)[12]。研究发现,该综合征的疾病或体征表现具有年龄分布特点,髓母细胞瘤多发于3岁以下儿童,而大脑镰/小脑幕钙化70% ~80%见于成年患者。本研究中的3例典型病例属于同一家族,我们对家族中部分成年人行头颅CT平扫,均可见小脑幕和大脑镰钙化,符合GS遗传性综合征的特点,有助于临床医生诊断。应当注意的是,即使钙化阴性也不能完全排除该诊断,需要进一步行基因检测后明确诊断。如前所述,合并Gorlin-Goltz综合征患者年龄大多在3岁以下,此时颅内钙化多不可见,本研究中病例均未见大脑镰/小脑幕钙化。因此对于该年龄段患者,由于多无其他症状辅助诊断,导致诊断困难,基因检测和密切随访往往是早期诊断的重要措施。
GS综合征为遗传性综合征,发生突变的基因包括PTCH1、SUFU、PTCH2等,PTCH1突变较为常见,占60% ~75%,但SUFU突变后发生髓母细胞瘤的概率是PTCH1的20倍,因此靶向治疗成为目前研究的热点[5]。SMO抑制剂(sonidegib, vismodegib等)已开始应用于SHH亚型和复发髓母细胞瘤的治疗,SHH亚型患者无进展生存期明显延长,且和PTCH1突变相比,SUFU突变患者应用靶向治疗可获得更好的效果[13-15]。同时SMO抑制剂也应用于Gorlin-Goltz综合征患者皮肤基底细胞癌的治疗。
目前国内对于髓母细胞瘤患者尚未常规进行基因检测,有关遗传性髓母细胞瘤的报道极少。2019年Bagemann等[16]报道了GPR161基因胚系突变也可以导致类似Gorlin-Goltz综合征的症状,患者均为SHH亚型,发病年龄均在3岁以下,临床预后良好,但后期可以发生基底细胞癌和放疗相关的脑膜瘤等病变。本研究采用的基因检测方法多为PANEL靶向测序,未能包含GPR161基因,目前对于该基因和髓母细胞瘤的关注较少,有待进一步研究。
| [1] |
Ostrom QT, Gittleman H, Truitt G, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2011-2015[J]. Neuro Oncol, 2018, 20(suppl_4): iv1-iv86. DOI:10.1093/neuonc/noy131 |
| [2] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [3] |
余建忠, 施伟, 赵瑞, 等. 儿童髓母细胞瘤的临床特点及预后相关因素分析[J]. 临床小儿外科杂志, 2020, 19(3): 236-240, 247. Yu JZ, Shi W, Zhao R, et al. Clinical characteristics and prognostic factors of pediatric medulloblastoma[J]. J Clin Ped Sur, 2020, 19(3): 236-240. DOI:10.3969/j.issn.1671-6353.2020.03.009 |
| [4] |
姜涛, 甲戈, 张玉琪. 髓母细胞瘤的危险度分级和诊疗现状[J]. 中华神经外科杂志, 2014, 30(7): 743-746. Jiang T, Jia G, Zhang YQ. Risk stratification and treatment strategy in medulloblastoma[J]. Chinese Journal of Neurosurgery, 2014, 30(7): 743-746. DOI:10.3760/cma.j.issn.1001-2346.2014.07.027 |
| [5] |
Jiang T, Zhang Y, Wang J, et al. Impact of tumor location and fourth ventricle infiltration in medulloblastoma[J]. Acta Neurochir (Wien), 2016, 158(6): 1187-1195. DOI:10.1007/s00701-016-2779-3 |
| [6] |
姜涛, 王军梅, 杜江, 等. 儿童髓母细胞瘤的临床预后及危险因素分析[J]. 中华神经外科杂志, 2016, 32(4): 338-343. Jiang T, Wang JM, Du J, et al. Analysis of clinical prognosis and risk factors for children with medulloblastoma[J]. Chinese Journal of Neurosurgery, 2016, 32(4): 338-343. DOI:10.3760/cma.j.issn.1001-2346.2016.04.005 |
| [7] |
杨宝, 姜涛. 髓母细胞瘤相关遗传综合征的研究进展[J]. 中华神经外科杂志, 2020, 36(9): 970-972. Yang B, Jiang T. Medulloblastoma related hereditary syndromes[J]. Chinese Journal of Neurosurgery, 2020, 36(9): 970-972. DOI:10.3760/cma.j.cn112050-20191117-00486 |
| [8] |
Wang Y, Wu J, Li W, et al. Retrospective investigation of hereditary syndromes in patients with medulloblastoma in a single institution[J]. Childs Nerv Syst, 2021, 37(2): 411-417. DOI:10.1007/s00381-020-04885-z |
| [9] |
Garre ML, Cama A, Bagnasco F, et al. Medulloblastoma variants: age-dependent occurrence and relation to Gorlin syndrome-a new clinical perspective[J]. Clin Cancer Res, 2009, 15(7): 2463-2471. DOI:10.1158/1078-0432.CCR-08-2023 |
| [10] |
Waszak SM, Northcott PA, Buchhalter I, et al. Spectrum and prevalence of genetic predisposition in medulloblastoma: a retrospective genetic study and prospective validation in a clinical trial cohort[J]. Lancet Oncol, 2018, 19(6): 785-798. DOI:10.1016/S1470-2045(18)30242-0 |
| [11] |
Jiang T, Wang J, Wang Y, et al. Development of mediastinal lymphoma after radiotherapy for concurrent medulloblastoma and PNET in a patient with Gorlin syndrome[J]. World J Surg Oncol, 2016, 14(1): 215. DOI:10.1186/s12957-016-0967-5 |
| [12] |
McBride KA, Ballinger ML, Killick E, et al. Li-Fraumeni syndrome: cancer risk assessment and clinical management[J]. Nat Rev Clin Oncol, 2014, 11(5): 260-271. DOI:10.1038/nrclinonc.2014.41 |
| [13] |
Li Y, Song Q, Day B. Phase Ⅰ and phase Ⅱ sonidegib and vismodegib clinical trials for the treatment of paediatric and adult MB patients: a systemic review and meta-analysis[J]. Acta Neuropathol Commun, 2019, 7(1): 123. DOI:10.1186/s40478-019-0773-8 |
| [14] |
Robinson GW, Orr BA, Wu G, et al. Vismodegib Exerts Targeted Efficacy Against Recurrent Sonic Hedgehog-Subgroup Medulloblastoma: Results From Phase Ⅱ Pediatric Brain Tumor Consortium Studies PBTC-025B and PBTC-032[J]. J Clin Oncol, 2015, 33(24): 2646-2654. DOI:10.1200/JCO.2014.60.1591 |
| [15] |
Wu F, Zhang C, Zhao C, et al. Prostaglandin E1 Inhibits GLI2 Amplification-Associated Activation of the Hedgehog Pathway and Drug Refractory Tumor Growth[J]. Cancer Res, 2020, 80(13): 2818-2832. DOI:10.1158/0008-5472.CAN-19-2052 |
| [16] |
Begemann M, Waszak SM, Robinson GW, et al. Germline GPR161 Mutations Predispose to Pediatric Medulloblastoma[J]. J Clin Oncol, 2020, 38(1): 43-50. DOI:10.1200/JCO.19.00577 |
 2021, Vol. 20
2021, Vol. 20


