2. 天津市儿童医院普外科(天津市, 300134);
3. 天津医科大学研究生院(天津市, 300070);
4. 福建省立医院小儿外科(福建省福州市, 350001), Email: alm0223@163.com
2. Department of General Surgery, Tianjin Children's Hospital, Tianjin 300134, China;
3. The Graduated School, Tianjin Medical University, Tianjin, 300070, China;
4. Department of Pediatric Surgery, Fujian Provincial Hospital, Fuzhou 350001, China
胆道闭锁(biliary atresia, BA)是一种由肝外胆管梗阻引起的严重肝胆疾病,以进行性肝纤维化为特征,最终可导致肝硬化,其病因复杂,至今仍未明确[1]。肝门空肠吻合术(Kasai术)是有效的治疗方式,如果不治疗,患者很快进展为终末期肝硬化,可危及生命[2]。然而,术后仍有部分患者因进行性肝纤维化导致肝硬化而需肝移植[3, 4]。因此,BA患者不可抑制的肝纤维化是治疗的重中之重,迄今为止,其纤维化的病理机制仍处探索之中。前期研究表明Notch信号通路与BA肝纤维化有一定关系,但具体机制尚不完全清楚[5]。鉴于BA患者肝脏发生持续性的炎性纤维化,Notch信号通路的Delta样配体4可以促进巨噬细胞的活化[6, 7],本文将探究Notch信号通路活化及相关炎性反应分子机制在胆道闭锁肝纤维化进展中的作用。
材料与方法 一、临床资料选取2019年1月至2020年11月于天津市儿童医院经胆道造影及肝活检确诊为Ⅲ型BA、并行Kasai术及肝活检术的15例BA患者的肝脏活检组织(BA组)进行研究,15例中男8例,女7例,年龄1~4个月。因先天性胆总管扩张(congenital biliary dilatation, CBD)和BA患者都需手术引流胆汁,但临床预后截然不同。故选择同时期于本院行胆管空肠吻合术及肝活检术的1岁以内CBD患者肝活检组织作为对照组(CBD组),其中男2例,女3例,年龄为2~6个月。两组患者年龄和性别分布无统计学差异(P>0.05)。根据Ohkuma's分级标准,将纤维化Ⅰ级和Ⅱ级分为轻度肝纤维化组,纤维化Ⅲ级和Ⅳ级视为重度肝纤维化组,其中轻度肝纤维化5例,重度纤维化10例。
所有活检样本均进行福尔马林固定后用石蜡包埋保存备用。本临床研究通过天津市儿童医院伦理委员会批准(编号:L202011)。
二、实验方法1. 主要试剂:Anti-HES-1、Anti-IL-6及二氨基联苯胺(diaminobenzidin, DAB)显色液,均购自北京博奥森试剂有限公司;Anti-CD163及枸橼酸钠缓冲液均定购于北京中杉金桥试剂有限公司;Anti-PDGF-AA购自英国Abcam公司;辣根过氧化物酶标记的辣根过氧化物酶标记的二抗购自美国Celplor公司。
2. Masson染色:将收集的患者肝组织进行石蜡包埋后连续切成4 μm的薄片,二甲苯脱蜡后经梯度酒精至蒸馏水,切片至苏木精水溶液中染色5 min,酸水及氨水中分色,流水冲洗后,Masson丽春红染色5 min,以2%冰醋酸水溶液浸洗1 s,1%磷钼酸水溶液分化3 min,苯胺蓝染5 min。以0.2%冰醋酸水溶液浸洗1 s,脱水透明后封片。
请两位专业病理科医师在光学显微镜下观察染色结果,胶原纤维呈蓝色,胞浆、肌肉呈红色,胞核黑蓝色。根据Ohkuma's分级标准进行纤维化分级。分级标准如下:0级为无纤维化;Ⅰ级为肝汇管区轻度纤维化;Ⅱ级为伸向邻近门管区的轻度桥接纤维化;Ⅲ级为伸向邻近门管区的重度桥接纤维化;Ⅳ级为有假小叶形成。
3. 免疫组化 所有患者的石蜡切片脱蜡后进行抗原修复,室温下羊血清封闭抗原30 min,滴加一抗后,4℃孵育过夜,取出后恢复室温,PBS缓冲液冲洗震荡3次,滴加二抗,室温下孵育30 min,PBS缓冲液冲洗震荡3次后进行DAB显色,镜下控制显色。显色满意后,用苏木精复染细胞核,用梯度乙醇脱水,二甲苯透明,中性树胶封片。
染色结束后在光学显微镜下观察染色结果,以黄棕色、棕褐色为阳性。先于40倍镜下观察每张切片阳性区域,后调整至200倍镜下选择5个不同视野拍照取图。最后采用Image-Pro-Plus 6.0图像分析系统进行半定量分析,结果以阳性面积的平均光密度值(average optical density, AOD)来表示(AOD=肝组织阳性细胞光密度总和/阳性面积)。
三、统计学方法本研究数据均采用SPSS 22.0软件进行统计分析。正态分布的计量资料数据以均数加减标准差(x±s)表示,且两组间的比较采用独立样本t检验。计数资料采用频数分析,两组间比较采用卡方检验。相关性分析若双变量呈正态分布则采用Pearson相关分析,否则采用Spearman相关分析。以P < 0.05为差异有统计学意义。
结果 一、免疫组化染色结果1. Notch信号通路效应分子HES-1的表达:HES-1在两组肝活检组织中的肝细胞胞浆及胆管细胞的胞浆、胞核均有表达,尤其以胆管细胞核为主。随着肝纤维化程度的加重,汇管区的炎性细胞大量聚集,其周围的肝细胞核呈现弱阳性或阳性。与CBD组相比,BA组的肝组织中HES-1的表达更强(图 1)。
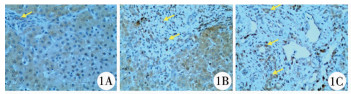
|
图 1 HES1在两组患者肝活检组织中的表达情况(×200倍镜) 注 1A:CBD组;1B:轻度肝纤维化BA组;1C:重度肝纤维化BA组;黄色箭头为HES1阳性胆管细胞 Fig.1 Expression of HES1 in liver biopsy tissue of patients in two groups(×200) |
2. CD163的表达:CD163在两组肝组织的肝窦内巨噬细胞呈强阳性表达,汇管区部位CBD组有少量阳性表达,BA组呈明显强阳性表达(图 2)。
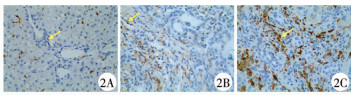
|
图 2 CD163在两组患者肝活检组织中的表达情况(×200倍镜) 注 2A:CBD组;2B:轻度肝纤维化BA组;2C:重度肝纤维化BA组;黄色箭头为CD163阳性细胞 Fig.2 Expression of CD163 in liver biopsy tissue of two groups |
3. IL-6与PDGF-AA的表达:IL-6在镜下呈分泌型蛋白特征,在肝细胞、胆管细胞、炎性细胞胞浆中均有表达,且BA组的表达高于CBD组,在BA亚组中,纤维化严重患者肝脏的表达更强(图 3)。在显微镜下观察可见,BA组的肝组织分泌PDGF-AA量相较于CBD组明显增加,胆管细胞的胞核呈明显强阳性,小叶间动脉呈明显强阳性表达(图 4)。
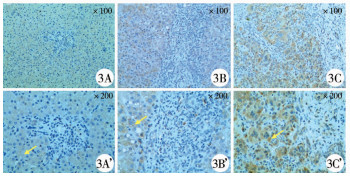
|
图 3 IL-6在两组患者肝活检组织中的表达情况 注 ×100(100倍镜下);×200(200倍镜下);3A/A':CBD组;3B/B':轻度肝纤维化BA组;3C/C':重度肝纤维化BA组。黄色箭头是肝细胞胞浆中IL-6阳性颗粒 Fig.3 Expression of IL-6 in liver biopsy tissue of patients in two groups |
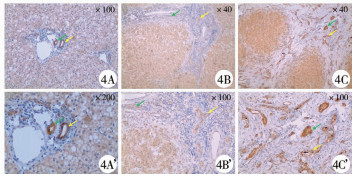
|
图 4 PDGF-AA在两组患者肝活检组织中的表达情况 注 ×40(40倍镜下);×100(100倍镜下);×200(200倍镜下);4A/A':CBD组;4B/B':轻度肝纤维化BA组;4C/C':重度肝纤维化BA组;黄色箭头是阳性的胆管细胞,绿色箭头是小叶间动静脉 Fig.4 Expression of PDGF-AA in liver biopsy tissue of two groups |
1. 与CBD组相比,BA组的HES1、CD163、PDGF、IL-6的表达明显增加,差异有统计学意义(P < 0.05),见表 1。
| 表 1 两组患者肝组织HES1、CD163、PDGF-AA、IL-6表达水平比较(x±s) Table 1 Comparing the expressions of HES1, CD163, PDGF-AA and IL-6 in liver tissues of two groups |
|
|
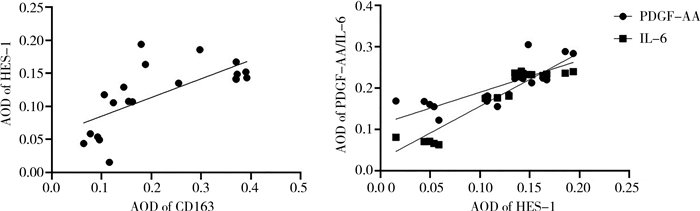
2. HES1的表达与CD163及PDGF-AA、IL-6的表达呈正相关,见图 5。
|
图 5 肝脏HES1与CD163、PDGF-AA、IL-6的表达相关性 注 AOD平均光密度值。(左)Pearson相关分析,M2巨噬细胞的聚集与HES-1呈正相关,r=0.687,P<0.01。(右)Pearson相关分析,M2巨噬细胞分泌的PDGF-AA、IL-6与HES-1呈正相关。r=0.629,P<0.0001,r=0.880,P<0.0001 Fig.5 Correlation among Hes1, CD163, PDGF-AA and IL-6 expression in liver tissues |
3. HES1、CD163、PDGF-AA、IL-6的表达与纤维化程度呈明显正相关,四种蛋白均随着纤维化程度的加重而表达增加(表 2)。
| 表 2 不同肝纤维化程度下HES1、CD163、PDGF-AA、IL-6表达水平情况(x±s) Table 2 Expressions of HES1, CD163, PDGF-AA and IL-6 in different fibrotic degrees(x±s) |
|
|
胆道闭锁是一种严重的炎症性纤维化性肝胆疾病,其病理特征为肝内胆管增生及不可逆转的进行性肝纤维化,以Ⅲ型闭锁最为多见,且预后最差。患者临床表现为胆汁淤积性黄疸、大便颜色变浅、尿色加深等。结合腹部超声、肝功能指标等辅助诊断手段,于腹腔镜探查术中行胆管造影及肝活检术可确诊为BA[8]。肝门空肠吻合术虽可改善胆汁引流,但术后仍可能因肝纤维化进行性加重,导致患者最终需行肝移植术以延续生命[9]。只有揭开进行性肝纤维化机制的神秘面纱,才有可能从根本上解决临床治疗难题。新近胆道闭锁发病机制研究在炎症细胞方面取得了重大突破,对B细胞的干预有可能抑制BA的疾病进展[10]。本研究从Notch信号通路与肝脏炎性细胞的关系探究对BA肝纤维化的影响。
一、HES-1促进胆道闭锁肝纤维化进展Notch信号通路是胆道系统发育和肝纤维化相关的信号通路之一,胆管发育中的胆管板重塑和小管形成有赖于Notch信号通路的活化[11, 12]。小儿肝胆畸形疾病中的Alagille综合征,大多是由于编码Notch通路配体的Jag1基因或受体Notch 2存在致病性突变[13]。前期,本团队初步探究发现Notch信号通路元件Notch1、Jagged1等的异常活化参与了BA肝纤维化进程,而HES-1是Notch信号通路下游主要的效应分子,其作为核转录因子,在信号传导过程中,辅助相应的蛋白进行转录表达[5]。有研究表明HES-1可直接参与细胞外基质蛋白的产生,尤其在信号通路活化增强时,会增加α平滑肌动蛋白(α-Smooth mucle actin, α-SMA)和Ⅰ型胶原α2的启动子活性,加剧胶原蛋白的积累,而选择性地抑制HES-1或将HES-1维持在合理水平, 会降低α-SMA和Ⅰ型胶原α2的启动子活性[14]。本研究发现,BA肝组织中HES-1的表达水平比对照组CBD患者明显增高,说明在同样需要手术进行胆汁引流的胆道畸形疾病中,Notch信号通路的活化程度在BA肝组织中更强。此外,根据Ohkuma's分级标准,本研究纳入的对照组CBD患者均未发生肝纤维化,而BA组患者均发生了不同程度的肝纤维化。相关性分析显示Notch信号活化后的效应分子HES-1的表达过高与肝纤维化程度呈正相关。由此可推测BA患者肝脏中Notch信号通路的异常活化导致了HES-1的过度表达,累及细胞外基质,从而加剧患者肝纤维化进程。
二、M2型巨噬细胞在BA患者肝脏的累积与Notch通路活化相关巨噬细胞是肝脏组织多种稳态和病理反应的关键组成部分,其在慢性肝损伤的发病机制中起核心作用,已被认为是对抗纤维化的潜在靶点[15]。特定的环境信号决定了肝巨噬细胞的极化和功能。这些细胞可能促进肝损伤或感染后组织完整性的恢复,也可能加快肝脏疾病的进展[16]。本研究中免疫组化定位及半定量结果显示,与CBD患者相比,CD163的表达在BA患者肝脏中明显升高。CD163是M2型极化的巨噬细胞的标志物,即M2型巨噬细胞在发生肝纤维化的BA组聚集更加明显,尤其在汇管区纤维增生部位。该结果与Yang等[17]对巨噬细胞的极化在BA肝纤维化的研究有相似之处,M1型巨噬细胞促进炎症反应的作用更为明显,M2型巨噬细胞抑制炎症,促进修复,但是M2型巨噬细胞加剧了肝纤维化的进程。经统计分析,CD163与HES-1的表达水平呈正相关,即随着肝纤维化程度的加重,HES-1与CD163的表达也随之增加。有文献报道,活化的巨噬细胞中Notch1和HES-1均被活化,进而通过激活NF-kappa B调节参与炎症反应的基因表达模式,经Notch1的抑制剂γ分泌酶抑制剂(gamma-secretase inhibitor, GSI)处理后,巨噬细胞分泌的肿瘤坏死因子α,IL-6及IL-10均受到影响[18]。说明在BA患者肝脏中,Notch信号通路的活化参与调节巨噬细胞的功能状态。
三、巨噬细胞的功能状态对BA肝脏的影响单核巨噬细胞可分泌转化生长因子-β1(transforming growth factor β1, TGF-β1)和血小板衍生生长因子(platelet-derived growth factors, PDGFs),介导肝星状细胞转化为肌成纤维细胞,分泌大量细胞外基质蛋白,促进肝纤维化的进展[19-21]。PDGFs共有5种生物活性PDGF蛋白,4种同源二聚体(PDGF-a, PDGF-b, PDGF-c和PDGF-d),1种异源二聚体PDGF-ab,其中PDGF AA主要与PDGFR-αα结合,与细胞的增殖和趋化作用相关[22]。胆道闭锁是一种炎症持续存在的进行性肝纤维化的肝胆疾病,而IL-6是持续炎症伴发纤维化进展的依赖性细胞因子,可由巨噬细胞分泌,反映慢性肝病患者炎症状态[23]。此外,IL-6可作为BA继发肝硬化时肝脏硬化程度的生物标志物[24]。本研究检测到IL-6及PDGF-AA在BA组中表达明显高于CBD组,且轻度和重度肝纤维化BA患者的HES-1与CD163的表达及IL-6和PDGF-AA的分泌量差异均具有统计学意义。说明在BA患者肝脏中,IL-6及PDGF-AA的过表达可促进肝纤维化进程,Notch信号对巨噬细胞有调节作用,而其分泌功能对BA肝纤维化起到促进作用。与此相似的一项新近研究指出原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)患者外周血巨噬细胞中的Notch1、Notch3受体表达异常,且M2型与M1型巨噬细胞数量比值与Notch受体表达水平呈线性相关[25]。成人PBC与婴幼儿BA有一定的相似之处,肝脏小叶间胆管上皮细胞发生变性、坏死及炎症细胞浸润引起的肝内小胆管进行性破坏伴门脉炎症性改变,最终导致胆汁淤积性肝纤维化。可见,Notch信号通路与巨噬细胞的密切联系在促进肝纤维化方面的确具有重要作用。
综上所述,Notch信号通路的异常激活参与了胆道闭锁肝纤维化进程,肝脏M2型极化巨噬细胞浸润,导致促进纤维化的炎性因子进一步积累,促进BA肝纤维化。但是,本研究还存在一定局限性,文中相关的分子表达情况只是提示Notch信号通路的异常参与BA的肝脏病理进展,尚不能提供强有力的佐证,需要进一步深入研究。为阐明该信号通路与BA肝纤维化机制的确切关系,还需进行细胞及个体的干预实验进一步证实。目前,BA的发病机制在炎症反应方面取得了重大突破。本研究也提出Notch信号通路与巨噬细胞的交互作用,促进BA肝纤维化进程,未来将进一步探究Notch信号通路活化对胆道闭锁肝脏纤维化的影响。因此,Notch信号通路活化一方面可以调节炎症细胞的功能状态,另一方面可能参与增生胆管细胞发生上皮间质转化,为进一步揭示胆道闭锁进行性肝纤维化的发生机制提供新的方向。
| [1] |
詹江华, 余晨. 胆道闭锁发病机制研究概述与启示[J]. 临床小儿外科杂志, 2018, 17(11): 801-804. Zhan JH, Yu C. Overview of the pathogenesis of biliary atresia and its implication[J]. J Clin Ped Sur, 2018, 17(11): 801-804. DOI:10.3969/j.issn.1671-6353.2018.11.001 |
| [2] |
郑珊. 胆道闭锁患儿获得长期生存需要关注的问题[J]. 临床小儿外科杂志, 2020, 19(6): 469-472. Zheng S. Several outstanding issues in long-term survival of children with biliary atresia[J]. J Clin Ped Sur, 2020, 19(6): 469-472. DOI:10.3969/j.issn.1671-6353.2020.06.001 |
| [3] |
詹江华, 夏强. 规范Kasai手术为肝移植做准备[J]. 中华小儿外科杂志, 2019, 40(5): 385-387. Zhan JH, Xia Q. Standardizing Kasai's procedure for preparing for liver transplantation[J]. Chin J Pediatr Surg, 2019, 40(5): 385-387. DOI:10.3760/cma.j.issn.02533006.2019.05.001 |
| [4] |
Zheng Q, Zhang S, Ge L, et al. Investigation into multi-centre diagnosis and treatment strategies of biliary atresia in mainland China[J]. Pediatr Surg Int, 2020, 36(7): 827-833. DOI:10.1007/s00383-020-04679-z |
| [5] |
贾金富, 詹江华, 余晨, 等. Notch-1、Jagged-1、Hes-1在胆道闭锁患儿肝纤维化中的表达及意义[J]. 中华小儿外科杂志, 2019, 40(5): 399-403. Jia JF, Zhan JH, Yu C, et al. Expression and significance of Notch-1, Jagged-1 and Hes-1 in liver fibrosis of children with biliary atresia[J]. Chin J Pediatr Surg, 2019, 40(5): 399-403. DOI:10.3760/cma.j.issn.0253-3006.2019.05.004 |
| [6] |
Nakano T, Fukuda D, Koga J, et al. Delta-Like Ligand 4-Notch Signaling in Macrophage Activation[J]. Arterioscler Thromb Vasc Biol, 2016, 36(10): 2038-2047. DOI:10.1161/ATVBAHA.116.306926 |
| [7] |
Nakano T, Katsuki S, Chen M, et al. Uremic toxin indoxyl sulfate promotes proinflammatory macrophage activation via the interplay of OATP2B1 and Dll4-Notch signaling[J]. Circulation, 2019, 139(1): 78-96. DOI:10.1161/CIRCULATIONAHA.118.034588 |
| [8] |
Wang L, Yang Y, Chen Y, et al. Early differential diagnosis methods of biliary atresia: a meta-analysis[J]. Pediatr Surg Int, 2018, 34(4): 363-380. DOI:10.1007/s00383-018-4229-1 |
| [9] |
Ge L, Zhan J, Gao W, et al. Relevant factors for early liver transplantation after Kasai portoenterostomy[J]. BMC Pediatr, 2020, 20(1): 484. DOI:10.1186/s12887-020-02355-8 |
| [10] |
Wang J, Xu Y, Chen Z, et al. Liver immune profiling reveals pathogenesis and therapeutics for biliary atresia[J]. Cell, 2020. DOI:10.1016/j.cell.2020.10.048 |
| [11] |
彭琴, 赵绅君, 李武. 肝纤维化相关信号转导通路研究进展[J]. 临床肝胆病杂志, 2017, 33(5): 954-958. Peng Q, Zhao SJ, Li W. Research advances in signaling pathways involved in the development of hepatic fibrosis[J]. J Clin Hepatol, 2017, 33(5): 954-958. DOI:10.3969/j.issn.1001-5256.2017.05.035 |
| [12] |
朱倩仪, 王立, 詹江华. Notch信号通路在胆道闭锁中的研究进展[J]. 中华小儿外科杂志, 2018, 39(4): 317-320. Zhu QY, Wang L, Zhan JH. Research advances of Notch signaling pathway in biliary atresia[J]. J Chin Pediatr Surg, 2018, 39(4): 317-320. DOI:10.3760/cma.j.issn.0253-3006.2018.04.017 |
| [13] |
Mitchell E, Gilbert M, Loomes KM. Alagille Syndrome[J]. Clin Liver Dis, 2018, 22(4): 625-641. DOI:10.1016/j.cld.2018.06.001 |
| [14] |
Zhang K, Zhang YQ, Ai WB, et al. Hes1, an important gene for activation of hepatic stellate cells, is regulated by Notch1 and TGF-beta/BMP signaling[J]. World J Gastroenterol, 2015, 21(3): 878-887. DOI:10.3748/wjg.v21.i3.878 |
| [15] |
Tacke F, Zimmermann HW. Macrophage heterogeneity in liver injury and fibrosis[J]. Journal of hepatology, 2014, 60(5): 1090-1096. DOI:10.1016/j.jhep.2013.12.025 |
| [16] |
Krenkel O, Tacke F. Liver macrophages in tissue homeostasis and disease[J]. Nat Rev Immunol, 2017, 17(5): 306-321. DOI:10.1038/nri.2017.11 |
| [17] |
Yang Y, Dong R, Zheng C, et al. Infiltration of polarized macrophages associated with liver fibrosis in infants with biliary atresia[J]. J Pediatr Surg, 2017, 52(12): 1984-1988. DOI:10.1016/j.jpedsurg.2017.08.045 |
| [18] |
Palaga T, Buranaruk C, Rengpipat S, et al. Notch signaling is activated by TLR stimulation and regulates macrophage functions[J]. Eur J Immunol, 2008, 38(1): 174-183. DOI:10.1002/eji.200636999 |
| [19] |
Pradere JP, Kluwe J, De Minicis S, et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice[J]. Hepatology, 2013, 58(4): 1461-1473. DOI:10.1002/hep.26429 |
| [20] |
Tacke F. Targeting hepatic macrophages to treat liver diseases[J]. J Hepatol, 2017, 66(6): 1300-1312. DOI:10.1016/j.jhep.2017.02.026 |
| [21] |
Vannella KM, Wynn TA. Mechanisms of organ injury and repair by macrophages[J]. Annu Rev Physiol, 2017, 79: 593-617. DOI:10.1146/annurev-physiol-022516-034356 |
| [22] |
Kazlauskas A. PDGFs and their receptors[J]. Gene, 2017, 614: 1-7. DOI:10.1016/j.gene.2017.03.003 |
| [23] |
Fielding CA, Jones GW, McLoughlin RM, et al. Interleukin-6 signaling drives fibrosis in unresolved inflammation[J]. Immunity, 2014, 40(1): 40-50. DOI:10.1016/j.immuni.2013.10.022 |
| [24] |
Wilasco MIA, Uribe-Cruz C, Santetti D, et al. IL-6, TNF-α, IL-10, and nutritional status in pediatric patients with biliary atresia[J]. J Pediatr (Rio J), 2017, 93(5): 517-524. DOI:10.1016/j.jped.2016.11.009 |
| [25] |
杨森, 慕永平, 张珏. 原发性胆汁性肝硬化患者外周血单核巨噬细胞中Notch受体表达情况[J]. 胃肠病学和肝病学杂志, 2020, 29(3): 332-335. Yang S, Mu YP, Zhang Y. Expression of Notch receptor on mononuclear macrophages in patients with primary biliary cirrhosis[J]. Chin J Gastroenterol Hepatol, 2020, 29(3): 332-335. DOI:10.3969/j.issn.1006-5709.2020.03.020 |
 2021, Vol. 20
2021, Vol. 20
