2. 河北省邢台市人民医院药剂科(河北省邢台市, 054001);
3. 河北省邢台市人民医院检验科(河北省邢台市, 054001), Email: 13730133835@163.com
2. Department of Pharmacy;
3. Department of Clinical Laboratory, Municipal People's Hospital, Xingtai 054001, China
婴幼儿血管瘤(infantile hemangioma, IH)是婴幼儿常见良性肿瘤之一,好发于头面部及颈部,婴幼儿发病率为3% ~10%,男女比例为1 ∶ 3[1]。根据其发病部位的深度差异可分为浅表型、深层型和混合型三种类型。婴幼儿血管瘤有典型的生长特征:即增殖和消退,部分患者可能会出现溃疡、出血,甚至危及生命等。因此需要积极干预[2]。目前,用于治疗婴幼儿血管瘤的方法较多,包括药物、激光、β射线、手术等,各种治疗方法效果不一,并且存在着不同的副作用及并发症。目前,关于婴幼儿血管瘤的最佳治疗方案仍存在争议。2010年,Guo等[3]首次将噻吗洛尔外用治疗婴幼儿血管瘤,并取得了很好的效果,β受体阻滞药外用治疗婴幼儿血管瘤的方法逐渐进入人们的视野。近些年,关于噻吗洛尔单独外用以及联合其它方法用于治疗婴幼儿血管瘤的研究也逐渐增多,但噻吗洛尔仍属于标签外使用药物[4]。本文通过研究噻吗洛尔外敷联合32P敷贴治疗婴幼儿血管瘤的临床疗效,旨在为临床治疗提供一种新的联合治疗方案。
材料与方法 一、临床资料选取2019年1月至2019年3月由河北省邢台市人民医院核医学科诊治的120例婴幼儿血管瘤患者作为研究对象。纳入标准:①参考中华医学会整形外科分会血管瘤和脉管畸形学组制定的《血管瘤和脉管畸形诊断和治疗指南(2016版)》[5],纳入对象为浅表型婴幼儿血管瘤或局灶性浅表型婴幼儿血管瘤,并经病史、CT或B超检查、临床表现等确诊;②单发的皮肤血管瘤;③肝肾功能、血常规、空腹血糖、甲状腺激素等无明显异常;④入组前未接受过其他治疗;⑤患者家长签署知情同意书;排除标准:①β-肾上腺受体阻滞剂过敏者或有相关禁忌证者;②合并急性上呼吸道感染、腹泻、糖尿病、严重心肺肝肾功能异常者;③多发的皮肤血管瘤患者;④患者家长不愿配合此次研究;⑤接受过其他治疗方法的婴幼儿血管瘤患者。本研究通过医院伦理委员会批准。
按照随机数字表法分成两组, 每组60例。观察组:男22例,女38例,男∶女为1 ∶ 1.73;平均年龄(5.27±4.31)个月;血管瘤面积(3.26±5.14)cm2;包括头颈部13例,躯干28例,四肢19例。对照组:男23例,女37例,男∶女为1 ∶ 1.61;平均年龄(5.12±4.26)个月;血管瘤面积(3.02±4.86)cm2;包括头颈部14例,躯干26例,四肢20例。
二、治疗方法对照组全程采用32P敷贴进行治疗,放射性32P溶液由北京原子高科股份有限公司提供。将32P溶液配制成20 cm×20 cm的公用敷贴器,然后根据患者血管瘤的形状和大小剪裁成个人专用敷贴器。治疗剂量为1.2 Gy/(cm2·d),根据治疗剂量及32P衰变系数计算每天的敷贴时间,7 d为一个疗程。2个月后观察治疗效果,根据血管瘤恢复情况决定是否进行第二个疗程的治疗,最多给予3个疗程的治疗。
观察组采用联合治疗方案,第一个疗程同对照组一样采用32P敷贴进行治疗,2个月后则单独采用广东宏盈科技有限公司生产的0.5%马来酸噻吗洛尔滴眼液外用治疗。将棉布剪成血管瘤大小,用噻吗洛尔浸湿,以不滴水为宜,然后敷于血管瘤处,外面用保鲜膜进行密封,以防止液体挥发,每次敷贴时间为30 min,每天敷贴3次,间隔时间>6 h。家长严格按照医师的指导用药,用药后密切观察患者呼吸、心率、腹泻及皮肤颜色变化,如出现皮肤过敏等不良反应,立即停止用药,可随时联系主治医师,主治医师全程进行跟踪观察。临床效果达到疗效评价Ⅳ级为停药标准,但最多给予患者4个月的马来酸噻吗洛尔外敷治疗。
三、疗效评价采用Achauer等[6]提出的四级分类标准进行疗效判断,Ⅰ级:瘤体无明显变化(瘤体缩小≤25%);Ⅱ级:瘤体变小,颜色变浅(瘤体缩小26% ~50%);Ⅲ级:瘤体明显变小,颜色明显变浅(瘤体缩小51% ~75%);Ⅳ级:瘤体大部分消失(瘤体缩小>75%)。有效率以Ⅱ级及以上计算,Ⅳ级为临床治愈。
四、统计学方法采用SPSS 20.0软件对数据进行统计学分析,年龄等计量资料以(x±s)表示,两组间比较采用独立样本t检验;性别等计数资料以百分数(%)表示,两组间治疗效果的比较采用χ2检验或Fisher精确检验。以P < 0.05为差异有统计学意义。
结果 一、一般资料两组患者的年龄、性别、血管瘤面积和部位差异无统计学意义(P>0.05),具有可比性,见表 1。
| 表 1 两组患者一般资料比较 Table 1 Comparison of general profiles between two groups |
|
|
1. 两组治疗效果的比较:观察组治愈26例,总有效率为93.33%(56/60);对照组治愈29例,总有效率为96.67%(58/60),两组总有效率比较,差异无统计学意义(χ2=0.702,P>0.05),见表 2。
| 表 2 两组治疗效果的比较 Table 2 Comparison of therapeutic efficacies between two groups |
|
|
2. 两组不同时期治愈率的比较:治疗后第4个月,观察组治愈率为26.67%,低于对照组的45.00%,差异有统计学意义(χ2=4.385,P=0.036);治疗后第6个月,两组治愈率无差异(χ2=0.302,P=0.583),见表 3。
| 表 3 两组不同时期治愈率的比较[n(%)] Table 3 Comparison of curative rate with treatment time between two groups[n(%)] |
|
|
3. 治疗后的副作用:观察组副作用发生率为16.67%,其中色素脱失和沉着8例,腹泻和湿疹各1例,腹泻和湿疹患者症状表现轻微,并未中断治疗。对照组副作用发生率为45.00%,高于观察组(P < 0.01),其中色素脱失和沉着23例、放射性皮炎2例。对照组的色素脱失和沉着发生率高于观察组(P < 0.05),见表 4和图 1。
| 表 4 两组治疗后副作用发生率的比较 Table 4 Comparison of side effects after treatment between two groups |
|
|
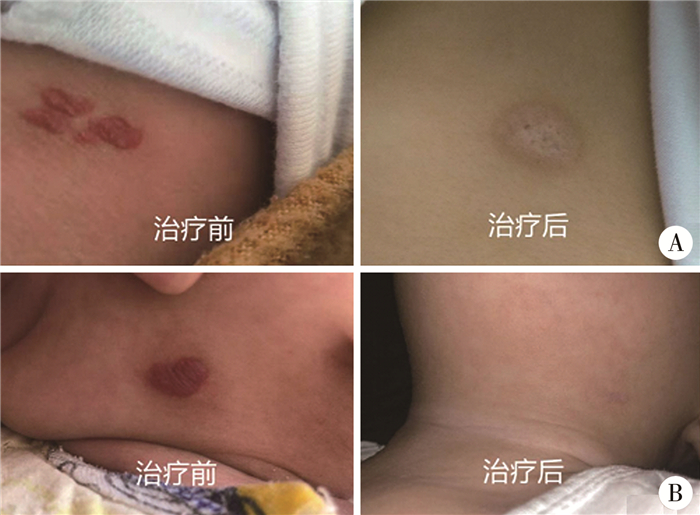
|
图 1 治疗前后照片对比 A: 患者左腹部皮肤血管瘤,全程采用32P敷贴治疗,瘤体消失,中间明显色素脱失,外周色素沉着;B:患者左下颌处皮肤血管瘤,采用噻吗洛尔外敷联合32P敷贴治疗方案,瘤体消失,未见明显的色素脱失和色素沉着 Fig.1 Comparisons of gross appearances before and after treatment |
婴幼儿血管瘤是婴幼儿常见的良性肿瘤,以血管内皮细胞异常增生为主要特征,具体的发病机制目前尚不明确。研究显示,血管内皮生长因子A(vascular endothlial grouth factor A, VEGF-A)在血管瘤的发生上具有重要作用,VEGF-A水平增高,导致血管内皮生长因子受体2(VEGFR-2)激活增多,促使血管内皮细胞大量增生[7]。Hunjan等[8]研究发现,缺氧可促进VEGF的分泌,从而诱发血管瘤的发生。雌激素在血管瘤的发生中也起到一定作用,缺氧和雌激素的协同作用能够促进血管内皮细胞的增生,这也可能是女性血管瘤患者高于男性的原因[9]。
2008年LÉAUÉ-LABRÈZE等[10]首次报道普萘洛尔治疗婴幼儿血管瘤有效,目前普萘洛尔已成为美国、中国、欧洲等各国IH指南推荐的一线药物。研究显示,增生期婴幼儿血管瘤血管内皮细胞中的β2肾上腺素受体(β2-AR)呈高水平表达,β受体阻滞剂可作用于β2-AR,致使VEGF生成减少,从而促使血管瘤消退[11-13]。β受体阻滞剂还可通过肾素- 血管紧张素通路促进婴幼儿血管瘤的消退[14]。2010年,Guo等[2]首次应用噻吗洛尔外用治疗婴幼儿血管瘤并取得了很好的疗效,之后关于噻吗洛尔用于治疗婴幼儿血管瘤的报道也逐渐增多。仇雅璟等[15]采用视觉模拟评分法对不同浓度的噻吗洛尔凝胶治疗婴幼儿血管瘤的疗效及安全性进行了研究,结果显示药物浓度并不是提高疗效的有效途径,而增加用药频率是提高疗效的可行办法。
32P敷贴治疗婴幼儿血管瘤临床应用成熟,也是目前治疗婴幼儿血管瘤常用的方法之一。其治疗原理是通过β射线在局部产生的电离作用使病变组织发生形态及功能变化,血管内皮细胞肿胀,发生炎性改变、萎缩,从而达到治疗目的。32P敷贴治疗婴幼儿血管瘤具有安全、简便、无痛、显效快、治愈率高的特点。缺点是存在潜在的放射性危害,副作用较为明显,包括干性皮炎、湿性皮炎、色素脱失以及色素沉着等。
本研究显示,联合治疗组和32P敷贴治疗组总有效率无差异。对比两组治愈率随治疗时间的变化发现,治疗后第4个月,32P敷贴组的临床治愈率高于联合治疗组。而在治疗的第6个月,两组临床治愈率无明显差异,这也表明β射线对皮肤血管瘤起效快而外用噻吗洛尔起效较慢。有研究显示,瘤体较厚的患者单独采用噻吗洛尔外用治疗,治疗一段时间后瘤体不会再继续缩小,只是瘤体变软,颜色变淡,而瘤体较薄的患者则不会出现这种现象[16]。这可能与血管瘤增生的纤维组织有关,噻吗洛尔虽然对血管瘤治疗有效,但是却不能使增生的纤维组织消退。
本研究发现对照组副作用发生率高达45%,尤其以色素脱失和沉着最为明显。而观察组副作用发生率则显著降低,为16.67%。32P敷贴虽然疗效显著,但副作用同样较为突出,并且随着治疗次数的增多,色素脱失和色素沉着的发生率也随之增高。随着患者对整体治疗效果的要求越来越高,在关注提高临床治愈率的同时,所产生的副作用也不容忽视。32P所导致的色素脱失及色素沉着可能是永久性的,严重影响患者皮肤外观。Wu等[17]采用0.5%的马来酸噻吗洛尔水凝胶治疗婴幼儿血管瘤,未发生上述不良反应。朱鸿剑等[18]采用90Sr-90Y敷贴联合噻吗洛尔局部外涂治疗婴幼儿浅表血管瘤,报道了5例发生皮肤浅褐色沉着的患者,通过局部外用维生素E,1个月内颜色恢复正常,未见色素脱失的报道。本研究第1个疗程采用32P敷贴,迅速控制血管瘤生长并使瘤体变薄,之后改用噻吗洛尔外敷的治疗方案,在保证治疗效果的同时,大大降低了色素脱失及沉着等副作用的发生率。
综上所述,噻吗洛尔外敷联合32P敷贴治疗婴幼儿血管瘤取得了良好的治疗效果,有效地降低了副作用发生率。治疗后的远期疗效、色素脱失及色素沉着恢复情况仍需要进一步跟踪观察。
| [1] |
接丽莉, 白瑞雪, 李晓冰, 等. 局部外用噻吗洛尔治疗婴幼儿血管瘤的研究现状[J]. 中国临床药理学杂志, 2019, 35(2): 402-405. Jie LL, Bai RX, Li XB, et al. Research status of topical timolol in the treatment of infantile hemangiomas[J]. Chin J Clin Pharmacol, 2019, 35(2): 402-405. DOI:10.13699/j.cnki.1001-6821.2019.04.024 |
| [2] |
杨浩. 婴幼儿血管瘤的治疗进展[J]. 临床小儿外科杂志, 2019, 18(8): 640-645. Yang H. Recent advances in the treatment of infantile hemangiomas[J]. J Clin Ped Sur, 2019, 18(8): 640-645. DOI:10.3969/j.issn.1671-6353.2019.08.005 |
| [3] |
Guo S, Ni N. Topical treatment for capillary hemangioma of the eyelid using β blocker solution[J]. Arch Ophthalmol, 2010, 128(2): 255-256. DOI:10.1001/archophthalmol.2009.370 |
| [4] |
郑家伟, 王绪凯, 江成鸿, 等. 外用马来酸噻吗洛尔治疗婴幼儿血管瘤中国专家共识[J]. 上海口腔医学, 2016, 25(6): 744-747. Zheng JW, Wang XK, Jiang CH, et al. Chinese Expert Consensus on Using Topical Timolol Maleate for Infantile Hemangiomas[J]. Shanghai J Stomatol, 2016, 25(6): 744-747. |
| [5] |
中华医学会整形外科分会血管瘤和脉管畸形学组. 血管瘤和脉管畸形诊断和治疗指南(2016版)[J]. 组织工程与重建外科杂志, 2016, 12(2): 63-93. Group of Angiogenesis and Vascular Malformations, Branch of Plastic Surgery. Chinese Medical Association: Guidelines for Diagnosing and Treating Hemangioma and Vascular Malformations (2016 Edition)[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2016, 12(2): 63-97. DOI:10.3969/j.issn.1673-0364.2016.02.001 |
| [6] |
Achauer BM, Chang CJ, Vander Kam VM. Management of hemangioma of infancy: review of 245 patients[J]. Plast Reconstr Surg, 1997, 99(5): 1301-1308. DOI:10.1097/00006534-199704001-00014 |
| [7] |
Jinnin M, Medici D, Park L, et al. Suppressed NFAT-dependent VEGFR1 expression and constitutive VEGFR2 signaling in infantile hemangioma[J]. Nat Med, 2008, 14(11): 1236-1246. DOI:10.1038/nm.1877 |
| [8] |
Hunjan MK, Schoch JJ, Anderson KR, et al. Prenatal risk factors for infantile hemangioma development[J]. J Invest Dermatol, 2017, 137(4): 954-957. DOI:10.1016/j.jid.2016.10.047 |
| [9] |
吴齐, 李养群. 婴幼儿血管瘤的发生机制及治疗研究进展[J]. 医学综述, 2018, 24(21): 4270-4275. Wu Q, Li YQ. Research progress in pathogenesis and treatment of infantile hemangiomas[J]. Medical Recapitulate, 2018, 24(21): 4270-4275. DOI:10.3969/j.issn.1006-2084.2018.21.022 |
| [10] |
Léaué-labrèze C, Dumas de La Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy[J]. N Engl J Med, 2008, 358(24): 2649-2651. DOI:10.1056/NEJMc0708819 |
| [11] |
Li P, Guo Z, Gao Y, et al. Propranolol represses infantile hemangioma cell growth through the β2-adrenergic receptor in a HIF-1α-dependent manner[J]. Oncol Rep, 2015, 33(6): 3099-3107. DOI:10.3892/or.2015.3911 |
| [12] |
Pan WK, Li P, Guo ZT, et al. Propranolol induces regression of hemangioma cells via the down-regulation of the PI3K/Akt/eNOS/VEGF pathway[J]. Pediatr Blood Cancer, 2015, 62(8): 1414-1420. DOI:10.1002/pbc.25453 |
| [13] |
徐广琪, 牛静静, 吕仁荣, 等. β肾上腺素受体和血管内皮生长因子受体在婴幼儿血管瘤组织中的表达[J]. 中华整形外科杂志, 2014, 30(4): 274-278. Xu GQ, Niu JJ, LV RR, et al. The expression and significance of β2-AR and VEGFR-2 in infantile hemangioma[J]. Chin J Plastic Surg Burns, 2014, 30(4): 274-278. DOI:10.3760/cma.j.issn.1009-4598.2014.04.010 |
| [14] |
Itinteang T, Braseh HD, Tan ST, et al. Expression of components of the renin-angiotensin system in proliferating infantile hemangioma may account for the propranolol-induced accelerated involution[J]. J Plast Reconstr Aesthet Surg, 2011, 64(6): 759-765. DOI:10.1016/j.bjps.2010.08.039 |
| [15] |
仇雅璟, 陈敏燕, 常雷, 等. 马来酸噻吗洛尔外用凝胶治疗浅表型婴幼儿血管瘤的随机双盲前瞻性临床研究[J]. 组织工程与重建外科杂志, 2014, 10(4): 203-206. Qiu JY, Chen MY, Chang L, et al. Effect of timolol maleate gel-forming solution in the treatment of superficial infantile hemangiomas: a prospective, randomized, double-blind trial[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2014, 10(4): 203-206. DOI:10.3969/j.issn.1673-0364.2014.04.009 |
| [16] |
林晓, 钱秋芳, 黄迎, 等. 外用噻吗洛尔和激光治疗婴幼儿血管瘤疗效比较[J]. 中国麻风皮肤病杂志, 2018, 34(4): 215-218. Lin X, Qian QF, Huang Y, et al. Comparison of therapeutic efficacy between topical timolol maleate and PDL and ND: YAG laser inthe treatment of superficial infantile hemangiomas[J]. Chin J Lepr Skin Dis, 2018, 34(4): 215-218. |
| [17] |
Wu HW, Liu C, Wang X, et al. Topical application of 0.5% timolol maleate hydrogel for the treatment of superficial infantile hemangioma[J]. Front Oncol, 2017, 7: 137. DOI:10.3389/fonc.2017.00137 |
| [18] |
朱鸿剑, 刘庆红, 关晏星. 90Sr-90Y敷贴联合噻吗洛尔局部外涂治疗婴幼儿浅表血管瘤的疗效观察[J]. 中华核医学与分子影像学杂志, 2014, 34(6): 466-469. Zhu HJ, Liu QH, Guan YX. Effectiveness of 90Sr-90Y applicator combined with topical timolol maleate treatment for infantile superficial hemangiomas[J]. Chin J Nucl MedMol Imaging, 2014, 34(6): 466-469. DOI:10.3760/cma.j.issn.2095-2848.2014.06.011 |
 2021, Vol. 20
2021, Vol. 20
