2. 上海交通大学医学院附属上海儿童医学中心泌尿外科(上海市, 200127)
2. Department of Radiology, Shanghai Children's Medical Center, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China
利尿肾动态显像提供的分肾功能(differential renal function, DRF)是评估肾脏功能受损程度的有效指标[1]。在儿童单侧肾盂输尿管连接部梗阻(ureteropelvic junction obstruction, UPJO)病例中,受损肾脏的DRF降低,DRF低于40%是目前国际上常采用的手术指征之一[2]。但是在临床工作中也会遇到积水侧肾脏DRF高于对侧的情况,患肾DRF≥55%即被称为分肾功能“超正常”现象(Supra-normal differential renal function,SNDRF),存在于在9% ~21%的单侧UPJO患者中[3-5]。这类肾积水患者应该继续随访还是及时手术尚无定论,也没有明确证据表明此类肾积水临床转归是否良好。
关于SNDRF发生的病理生理学机制仍不明确。有学者认为SNDRF的发生与使用的示踪剂类型有关,也有学者认为与扩张的集合系统形成的蓄水池效应有关,还有学者认为是感兴趣区划取过大造成的一种人工误差[6, 7]。有学者提出:肾脏体积增加或梗阻后肾滤过功能增强可以解释SNDRF的生理机制[3, 8, 9]。目前最为普遍接受的观点是Pippi-Salle等[10]通过实验得出的结论:积水肾脏几何空间结构的变化和肾实质内示踪剂相对分布的改变会影响示踪剂的检测度,进而导致诊断过程中积水肾的功能被高估。无论如何,SNDRF在临床工作中确实存在,为了进一步探索SNDRF存在与否的单侧UPJO患者术后恢复效果有无差异以及SNDRF发生的相关因素,本研究回顾分析了上海交通大学医学院附属上海儿童医学中心泌尿外科2014年1月至2020年5月收治的临床资料完整的单侧UPJO患者的临床资料,探讨SNDRF病例的临床特点,现报告如下。
材料与方法 一、临床资料利用上海交通大学医学院附属上海儿童医学中心集成化电子病例信息系统收集2014年1月至2020年5月收治的107例单侧UPJO且接受肾盂成形术患者的临床资料。此外,本组病例术前及术后超声、利尿肾图检查均在本院完成。排除标准:双侧肾积水、孤立肾UPJO、膀胱输尿管反流伴UPJO、重复肾UPJO、神经源性膀胱、后尿道瓣膜、马蹄肾及复发性肾积水。SNDRF病例定义为单侧UPJO,患肾DRF≥55%。本组病例根据患肾DRF是否超过55%分为SNDRF组和非SNDRF组。收集肾年龄、性别、UPJO病因、侧别、手术年龄、手术入路、术前及术后评估时间、肾盂前后径(anteroposterior pelvic diameter, APD)、肾长径及肾横径等参数。
二、术前评估及术后随访所有病例行超声检查及利尿肾图(diuretic renogram, DR)检查,部分病例行排尿膀胱尿道造影及核磁共振水成像检查。利尿剂应用情况:注射造影剂后15 min注射呋塞米,婴儿剂量为1 mg/kg,1岁以上儿童为0.5 mg/kg,最大剂量为40 mg。参照欧洲核医学协会儿科委员会关于儿科肾动态现象指南[11],在肾脏功能叠加图上,沿肾脏轮廓勾画兴趣区,具体参见图 1。肾盂成形术手术指征包括:梗阻性肾图且DRF < 40%,SFU Ⅳ度积水随访过程中积水程度加重或DRF下降>10%,出现腰/腹部疼痛、泌尿系统感染、结石等情况。SNDRF病例的手术原因:随访过程中肾积水加重,SFU分级由Ⅲ级上升至Ⅳ级者10例;出现腰/腹部疼痛5例;泌尿系统感染1例;并发泌尿系统结石2例。采取开放式手术或腹腔镜下Anderson-Hynes术。术后随访方案包括:术后3个月、6个月、12个月各行一次泌尿系统超声检查,术后6个月行利尿肾图检查以评估DRF。
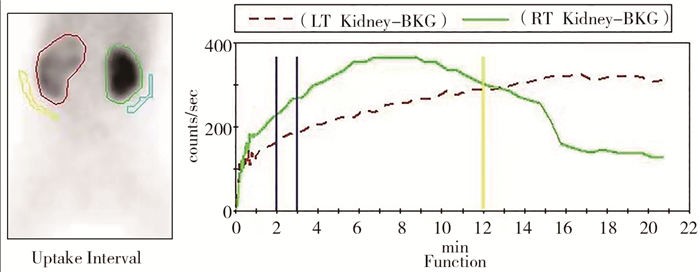
|
图 1 肾脏兴趣区的勾画 Fig.1 Drawing of renal regions of interest |
采用SPSS 23.0软件进行统计学分析。对于年龄等不符合正态分布的计量资料采用中位数和四分位间距[M, (P25, P75)]表示,两组间比较采用Wilcoxon秩和检验。对于术前DRF、术前APD值等符合正态分布的计量资料采用均数加减标准差(x±s)表示,两组比较采取独立样本t检验,各组内手术前后DRF比较采取配对t检验。采用受试者特征工作曲线(receiver operating characteristic curve, ROC)评价术前APD作为SNDRF预测因子的准确性,并计算曲线下面积(area under curve, AUC)。以P < 0.05为差异具有统计学意义。
结果 一、基本情况107例中,符合SNDRF诊断的单侧UPJO14例,占接受手术治疗的单侧UPJO病例的13.1%。患者血肌酐值及尿素氮值均正常。SNDRF组术前APD高于非SNDRF组(P < 0.05)。两组病例术前基线特征见表 1。
| 表 1 两组患者术前临床特点、超声及DR检查结果 Table 1 Preoperative clinical characteristics, ultrasound and DR results of two groups |
|
|
根据ROC曲线,术前APD是预测SNDRF的可靠预测因子(AUC=0.661,95%CI:0.533~0.789),灵敏度为0.786,特异度为0.516。ROC曲线分析术前APD对SNDRF预测的临界值为26.5 mm,见图 2。
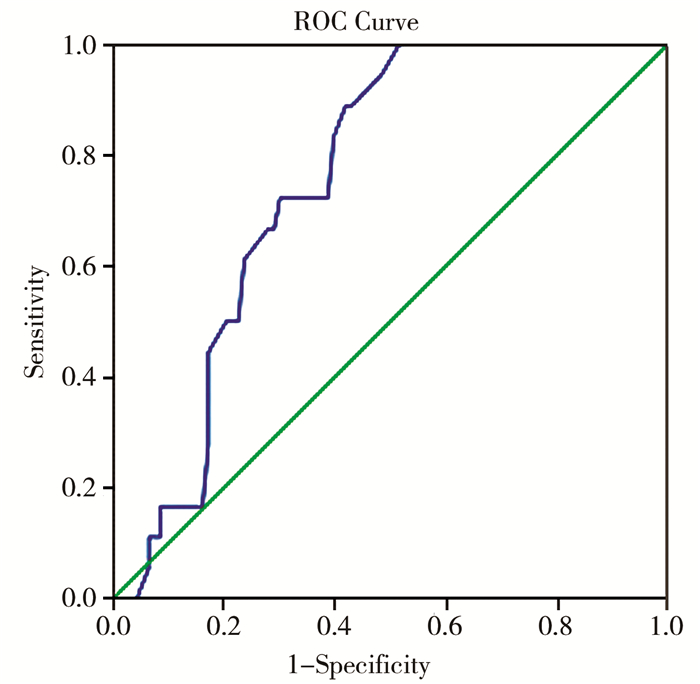
|
图 2 术前APD预测SNDRF的ROC曲线 Fig.2 ROC curve of preoperative APD for predicting SNDRF |
SNDRF组术后肾功能较术前明显下降(t=3.399,P=0.002),DRF达到55%以下的病例占85.7%,有57.1%的病例术后DRF下降>5%。非SNDRF组术后肾功能变化较术前无统计学意义(t=1.005,P=0.316), 见表 2。线性回归分析结果提示SNDRF病例中手术前后分肾功能的差值与年龄(R2=0.001,P=0.929)及术前APD值(R2=0.141,P=0.186) 无关。SNDRF组病例中有1例(7.1%)术后积水复发,非SNDRF组中有5例(5.4%)复发。
| 表 2 两组患者术后肾功能变化情况(x±s) Table 2 Postoperative changes of renal function in two groups(x±s) |
|
|
SNDRF在儿童重度肾积水病例的临床诊疗中一直存有争议,因为这类病例会出现超声结果与DR结果的不一致。关于该现象的发生可能与多种因素有关,主要包括:应用不同示踪剂所带来的一种技术误差、放射性核素给药后评估DRF时间的早晚不同、选取感兴趣区的人工误差、DRF计算方法或本底活性是否减除等[3, 7, 12-14]。也有学者认为它是积水肾脏某阶段病理状态的体现,为一过性肾血流量增加或梗阻造成的反应性肾高滤状态[3, 8, 9]。Pippi-Salle等[10]认为:肾盂显著扩张后的异常形态可能会干扰同位素的释放,因此,需要共轭视图才能纠正SNDRF现象。SNDRF的发生对临床医生有哪些指导意义?有哪些病例会更容易出现SNDRF现象?遇到这类病例时更需要综合分析,谨慎对待。
Moon等[9]提出可借助SNDRF预测SFU 3级、4级肾积水新生儿是否需要手术治疗,具有SNDRF现象的患者常提示机械性梗阻,更需要密切随访或及时手术。同样,有部分学者认为SNDRF是由于兴趣区选择过大或DRF评估时间过早引起,因此,对于单侧UPJO伴有SNDRF的患者不仅不能放松警惕,还应密切监测,如果积水程度逐渐加重或肾图提示排泄时间延长应尽早手术[10, 14]。Cho等[1]认为,SNDRF通常在输尿管梗阻解除后DRF会降低甚至恢复至正常范围,这种观点更加支持了SNDRF的本质是输尿管梗阻后的一过性反应这一理论。此外,Cho等[1]总结的33例SNDRF病例中术后DRF显著下降的比例为70%,本组SNDRF病例中亦有57.1%术后DRF下降幅度>5%。SNDRF病例中少数患者术后DRF没有显著下降,可能是由于这部分病例患肾处于高滤过状态或代偿性反应在术后早期尚未恢复。既往文献报道SNDRF病例中DRF是否显著下降与年龄及APD值有关,年龄小及APD值越高的病例,术后DRF显著下降的比例更高[3, 5]。但本组SNDRF病例中并未证实这一特点,可能与病例数较少或术后复查DR周期短有关。
本研究发现,术前APD是预测SNDRF的有效指标,当APD阈值为26.5 mm时,预测SNDRF的灵敏度和特异度分别为0.786和0.516,这说明SNDRF与APD的增加有关。Wehbi等[16]表明,APD每增加1 mm,观察到前后位视图之间DRF显著差异的概率增加2%,APD>25 mm的患者出现有意义差异的可能性更大。结合超声表现和SNDRF,提示这类病例需要手术的可能性更大,Pippi-Salle亦提出过这一观点[10]。尽管DRF是临床决策中最重要的客观参数之一,但至今DRF的测量方法尚未标准化。测量DRF时,采用独帧的后位(肾静态)图像还是选择合并(肾动态)图像所获得的几何平均值来计算DRF尚无定论[15]。总之,重度肾积水与肾实质厚度和肾盂形态改变有关,在肾脏扫描时使用共轭视图可以更准确地解释肾盂形状变化引起的DRF测量误差。
本研究的结论是从小样本病例的分析中得出的,未接受手术治疗的患者不包括在本研究中,这是本研究主要的缺陷。因此,无法分析非SNDRF患者的肾脏几何特征与DRF演变的关联性。此外,本组病例术后6个月复查利尿肾图,术后1年DRF恢复比较显著,对于长期疗效的随访更有意义。后期的临床病例应考虑将核素复查时间延后。最后,本组病例利尿肾图图像均经核医学科两位医师复核。即便如此,由于不同医师会有不同的个人习惯,仍有导致误差发生的可能,为避免这种误差的发生,多个中心核医学科医师共同制定统一的标准尤为重要。
综上所述,本研究认为SNDRF与术前APD增加有关。这一发现说明了SNDRF与严重肾积水有关,主要原因是肾脏的几何特征被改变。APD≥26.5 mm是术前SNDRF的可靠预测因子。术前具有SNDRF的患者在肾盂成形术后DRF变化显著,有理由认为术前DRF在严重肾积水病例中可能被高估。因此,对于术前功能异常或严重肾积水(APD≥26.5 mm)的患者,无论DRF如何,肾积水加重或肾图提示排泄时间显著延长的病例,均应进行严密监测。
| [1] |
Cho SY, Kim IS, Lee SB, et al. Nature and fate of supranormal differential renal function: lessons from long-term follow-up after pyeloplasty[J]. Urology, 2013, 81(1): 163-167. DOI:10.1016/j.urology.2012.09.017 |
| [2] |
Nordenström J, Koutozi G, Holmdahl G, et al. Changes in differential renal function after pyeloplasty in infants and children[J]. J Pediatr Urol, 2020, 16(3): 329.e1-e8. DOI:10.1016/j.jpurol.2020.02.002 |
| [3] |
Rickard M, Braga LH, Gandhi S, et al. Comparative outcome analysis of children who underwent pyeloplasty for ureteropelvic junction obstruction associated with or without supranormal differential renal function[J]. Urology, 2017, 99: 210-214. DOI:10.1016/j.urology.2016.07.016 |
| [4] |
姜大朋, 史政洲, 赵海腾, 等. 单侧肾盂输尿管连接部梗阻患儿分肾功能"超正常"现象及其临床意义[J]. 中华小儿外科杂志, 2019, 40(9): 817-820. Jiang DP, Shi ZZ, Zhao HT, et al. "Supra-normal" phenomenon of differential renal function in children with unilateral ureteropelvic junction obstruction and its clinical significance[J]. Chin J Pediatri Sur, 2019, 40(9): 817-820. DOI:10.3760/cma.j.issn.0253-3006.2019.09.010 |
| [5] |
Martín-Solé O, Soria-Gondek A, Pérez-Bertólez S, et al. Value of supranormal function on 99m Tc-mercaptoacetyl triglycine renal scan in paediatric patients with obstructive hydronephrosis[J]. BJU Int, 2019, 124(5): 842-848. DOI:10.1111/bju.14781 |
| [6] |
Fung LC, McLorie GA, Khoury AE, et al. Contradictory supranormal nuclear renographic differential renal function: fact or artifact[J]. J Urol, 1995, 154(2 Pt 2): 667-670. DOI:10.1097/00005392-199508000-00088 |
| [7] |
Inanir S, Biyikli N, Noshari O, et al. Contradictory supranormal function in hydronephrotic kidneys: fact or artifact on pediatric MAG-3 renal scans[J]. Clin Nucl Med, 2005, 30(2): 91-96. DOI:10.1097/00003072-200502000-00004 |
| [8] |
Capolicchio G, Jednak R, Dinh L, et al. Supranormal renographic differential renal function in congenital hydronephrosis: fact, not artifact[J]. J Urol, 1999, 161(4): 1290-1294. DOI:10.1016/S0022-5347(01)61671-9 |
| [9] |
Moon DH, Park YS, Jun NL, et al. Value of supranormal function and renogram patterns on 99mTc-mercaptoacetyltriglycine scintigraphy in relation to the extent of hydronephrosis for predicting ureteropelvic junction obstruction in the newborn[J]. J Nucl Med, 2003, 44(5): 725-731. |
| [10] |
Pippi Salle JL, Cook A, Papanikolaou F, et al. The importance of obtaining conjugate views on renographic evaluation of large hydronephrotic kidneys: an in vitro and ex vivo analysis[J]. J Urol, 2008, 180(4): 1559-1565. DOI:10.1016/j.juro.2008.06.010 |
| [11] |
Gordon I, Piepsz A, Sixt R. Auspices of Paediatric Committee of European Association of Nuclear Medicine.Guidelines for standard and diuretic renogram in children[J]. Eur J Nucl Med Mol Imaging, 2011, 38(6): 1175-1188. DOI:10.1007/s00259-011-1811-3 |
| [12] |
Aktaş GE, Sarıkaya A. Correction of differential renal function for asymmetric renal area ratio in unilateral hydronephrosis[J]. Ann Nucl Med, 2015, 29(9): 816-824. DOI:10.1007/s12149-015-1009-z |
| [13] |
Aktaş GE, Inanir S. Relative renal function with MAG-3 and DMSA in children with unilateral hydronephrosis[J]. Ann Nucl Med, 2010, 24(9): 691-695. DOI:10.1007/s12149-010-0397-3 |
| [14] |
Ham WS, Jeong HJ, Han SW, et al. Increased nephron volume is not a cause of supranormal renographic differential renal function in patients with ureteropelvic junction obstruction[J]. J Urol, 2004, 172(3): 1108-1110. DOI:10.1097/01.ju.0000135324.17766.5f |
| [15] |
Merguerian PA. Should geometric mean calculation of differential renal function be used when evaluating children with moderate to severe hydronephrosis[J]. J Urol, 2016, 195(2): 247-248. DOI:10.1016/j.juro.2015.11.003 |
| [16] |
Wehbi E, Salle A, Kanaroglou N, et al. Measurement of differential renal function by scintigraphy in hydronephrotic kidneys: importance of conjugate views for accurate evaluation[J]. J Urol, 2016, 195(2): 471-475. DOI:10.1016/j.juro.2015.09.085 |
 2021, Vol. 20
2021, Vol. 20


