便秘是先天性巨结肠(Hirschsprung's disease, HSCR)术后最常见的并发症,发生率8% ~30%,大部分患者经保守治疗好转,但仍有2% ~3%的病例需接受再次手术[1, 2]。HSCR根治术后因便秘复发而再次手术是目前小儿肛肠外科的难点和热点。本研究回顾性分析广州市妇女儿童医疗中心胃肠外科因HSCR术后便秘复发而接受再手术病例的资料,现报道如下。
材料与方法 一、一般资料回顾性分析本中心胃肠外科2016年7月至2019年7月收治的19例行巨结肠根治术后因便秘复发保守治疗无效而再次手术患者的临床资料,其中男15例,女4例;首次手术年龄3~24个月,中位数5个月;外院术后于本院接受再次手术16例,其余3例所有手术均在本院进行;原根治手术方式:Soave术18例,Duhamel术1例;单纯经肛门手术11例(57.9%),腹腔镜辅助手术4例(21.1%),腹会阴联合手术2例(10.5%),2例(10.5%)有多次手术史(1例为新生儿期造瘘、T型造瘘+活检、腹会阴联合巨结肠根治术;1例为腹腔镜辅助先天性巨结肠根治术+直肠括约肌部分切除术,后因粘连性肠梗阻行肠粘连松解+坏死回肠切除+回肠造瘘,第3次行回肠- 盲肠端侧吻合术),见表 1。首次手术后排便情况:8例术后便秘无缓解,3例术后3个月内出现便秘,4例术后3~12个月出现便秘,4例术后12个月以上出现便秘,3例术后反复出现小肠结肠炎(Hirschsprung's disease associated enterocolitis, HAEC),后发展为便秘与肠炎交替。再次手术前常规保守治疗6个月以上,包括人工扩肛、回流灌肠、口服缓泻剂等。
| 表 1 19例先天性巨结肠术后便秘复发再手术患者临床资料 Table 1 Clinical data of 19 children undergoing redo Pull-through for Hirschsprung's disease with recurrent postoperative constipation |
|
|
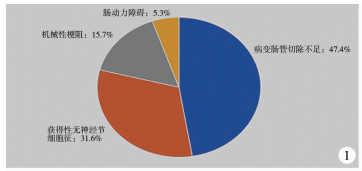
按照美国HSCR术后梗阻症状诊疗指南,结合患者病史、症状、体征、再次手术前钡灌肠、直肠肛管测压及直肠全层活检结果,将便秘复发再手术原因分为病变肠管切除不足、获得性无神经节细胞症、机械性梗阻、肠动力障碍等,见图 1至图 7[3]。
|
图 1 先天性巨结肠术后便秘复发再手术原因的构成比分布 Fig.1 Proportion of causes for redo pull-through in children with recurrent constipation after surgery for HSCR |
|
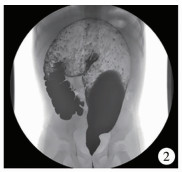
图 2 狭窄段残留(结肠远端可见残余狭窄段,长度为4 cm,狭窄段以上部位结肠明显扩张,最宽处达10 cm) Fig.2 Residual aganglionic segments(residual aganglionic segments were seen in distal bowel of colon, the length was 4 cm and bowel obviously expanded above rectum, up to 10 cm) |
|
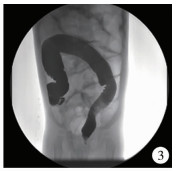
图 3 狭窄段残留(全结肠型巨结肠误诊为常见型巨结肠,全部结肠痉挛狭窄,小肠普遍扩张) Fig.3 Residual aganglionic segments (total colonic aganglionosis was misdiagnosed as short-segment HSCR, colon was spasmic and narrow and small intestine generally dilated) |
|
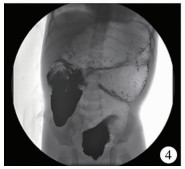
图 4 扩张段切除不足(术后剩余的结肠普遍扩张,直径约11 cm) Fig.4 Insufficient resection of dilated segment (colon residual was generally dilated with a diameter of about 11 cm) |

|
图 5 结肠脾曲过度牵拉(脾曲远端肠管失去正常形态,横结肠扩张) Fig.5 Stretched colonic splenic flexure (distal bowel of splenic flexure had no normal colonic shape and transverse colon dilated) |
|
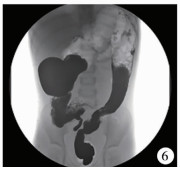
图 6 根治术后HAEC反复发作(肠壁呈锯齿状,远端肠管痉挛狭窄) Fig.6 Recurrent HAEC after pull-through procedure (colon wall became jagged and distal bowel was spasmic & narrow) |
|
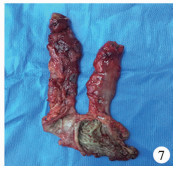
图 7 Duhamel术后闸门综合征 Fig.7 A retained spur consisted of anterior aganglionic bowel after Duhamel procedure |
再次根治手术距首次手术时间为8~81个月,平均(31.0±19.1)个月。再次手术方式:腹会阴联合巨结肠根治Soave术+Deloyers术9例,腹腔镜辅助改良Swenson术+Deloyers术4例,腹腔镜辅助改良Soave术3例,腹会阴联合巨结肠根治Soave术2例,腹腔镜辅助改良Soave+Deloyers术1例,其中4例行再手术前因近端肠管严重扩张无法一期根治而先行造瘘术包括回肠造瘘2例,横结肠造瘘1例,降结肠造瘘1例。见表 1。
四、随诊内容采用住院、门诊、电话、互联网等方式进行随访。术后2周常规肛门指诊了解吻合口情况,必要时予扩肛治疗。观察指标包括吻合口狭窄、吻合口漏、HAEC、排便次数、控便功能、切口愈合情况等。采用Drossman DA[4]标准判定便失禁、污粪、便秘等。HAEC的诊断与分级采用美国小儿外科协会HAEC的诊断标准[5]。随访截至2020年12月。
结果再次手术后随访18~54个月,19例均痊愈出院,无一例出现吻合口漏、吻合口狭窄、吻合口出血、急性肠梗阻、急性尿潴留、输尿管损伤、切口感染、尿道和阴道损伤等近期并发症。术后患者均能自主排便,3例(15.7%)术后出现污粪,均发生于术后3个月内,经排便训练和肠道管理后好转,仅在水样便时有污粪;1例(5.3%)术后1个月出现Ⅰ级HAEC,经回流灌肠好转。见表 1。
讨论HSCR根治术后便秘复发的主要原因包括机械性梗阻、持续/获得性无神经节细胞症或移行段残留、肠动力障碍、内括约肌痉挛、功能性巨结肠等,后两者多可通过回流灌肠、扩肛、肉毒素注射治疗等缓解,因此HSCR术后便秘复发再手术原因主要包括机械性梗阻、持续/获得性无神经节细胞症或移行段残留、肠动力障碍等[2, 3]。彭春辉等[6]将HSCR术后便秘复发再手术归因于无神经节细胞段残留和移行段残留等病理异常以及远端结肠扩张导致Soave术肌鞘狭窄等解剖异常两方面。本组病例便秘复发再手术原因与国内外报道相似[2, 6]。
一、HSCR根治术后便秘复发再手术的原因 1 病变肠管切除不足狭窄段/移行段残留是导致HSCR手术失败的主要原因[2]。本组病例中病变肠管切除不足占47.4%(9/19),其中狭窄段残留31.6%(6/19),移行段残留15.7%(3/19)。分析其原因主要是:①术者过于自信,仅凭钡灌肠检查和经验决定手术切除范围,导致病变肠管残留;②病理类型判断错误:全结肠型HSCR病理学上表现为肥大神经丛不明显,如果仅行乙酰胆碱酯酶染色检查,可能导致病理类型诊断错误[7];③经肛门分离起始点过高:Yamataka等[8]认为以齿状线为标志不够客观,对不同年龄不同身形的患者更难判断,推荐将肛直线作为分离起始点,Ralls等[2]认为分离起始点过高,残留的病变肠段随患者年龄的增加而增长,导致直肠排空障碍;④单纯经肛门手术:Han等[9]指出单纯经肛门手术是HSCR再手术的独立危险因素,van de Ven等[10]认为单纯经肛门手术在术野上的局限是导致难以准确判断移行段平面的重要原因,术后残留无神经节细胞肠管的发生率高于经腹辅助手术。本组中有11例(57.9%)首次手术方式为单纯经肛门手术,支持上述观点。
2 获得性无神经节细胞症研究表明扩张段切除不足、吻合口张力过高、HAEC等可引起正常神经节细胞的变性和退化[11]。①扩张段切除不足:多发生在年长儿,肠管过度扩张、肠壁肥厚可引起肠道动力障碍,如果术前、术后缺乏有效的肠道管理,容易便秘复发[12]。这类患者术后复查钡灌肠往往提示结肠扩张较术前无明显改善,24小时仍有大量钡剂残留,再次手术病理往往提示神经节细胞呈退行性变,本组有2例(10.5%)为此情况。②吻合口张力过高/脾结肠韧带过度牵拉:单纯经肛门手术无法常规游离脾结肠韧带及侧腹膜,结肠脾曲牵拉造成吻合口张力过高,拖出的结肠与横结肠成锐角,近端肠内容物无法顺利排出,钡灌肠显示结肠脾曲至肛门的肠管形态僵硬,失去正常结肠袋结构,脾曲近端扩张明显[10]。如果拖出的结肠在有张力情况下勉强吻合,会增加吻合口缺血缺氧风险,由于肠神经节细胞对缺血和缺氧非常敏感,原有正常肠神经节细胞可发生空泡变性。本组有2例(10.5%)首次手术后吻合口肠管病理检查无异常,术后3个月出现便秘,再次手术前活检提示吻合口肠神经节细胞变性。③反复发作的HAEC:一般认为根治术后HAEC与肠道远端痉挛梗阻、细菌毒素侵蚀肠黏膜、患者免疫功能异常、术前合并HAEC等因素有关[13]。术后HAEC反复发作,细菌毒素可导致正常神经节细胞变性、退化,肠管失去正常蠕动功能[12]。
3 机械性梗阻包括直肠肌鞘残留、吻合口狭窄、下拖肠管扭转、“盲袋闸门”综合征等。①吻合口狭窄:是HSCR术后最常见的机械性梗阻原因之一,可因未规律扩肛或吻合口血运不佳引起,发生率为3% ~35%,大部分可经扩肛治疗改善,若保守治疗无效则需再次手术[14]。本组中2例(10.5%)于外院行Soave术后未行扩肛治疗,后出现吻合口狭窄,经麻醉下强力扩肛等保守治疗无效,再次手术中发现原吻合口直径为0.5~1 cm,切除原吻合口后病理检查提示吻合口处纤维结缔组织增生伴肠腔狭窄,肌间可见神经节细胞。Soave术中如保留过长的直肠肌鞘易形成狭窄环,规律扩肛可有效预防吻合口狭窄。②“盲袋闸门”综合征:常见于Duhamel术后,本组1例(5.3%)为这种情况,再次手术采取腹腔镜盲袋切除术+Swenson术,最终治愈[3]。
4 肠动力障碍主要指合并巨结肠同源病(allied disorders of Hirschsprung's disease, ADHD),包括肠神经节未成熟症、肠神经节减少症、肠神经元发育不良(intestinal neuronal dysplasia, IND)等[15]。ADHD临床症状与HSCR相似,鉴别困难,常需经验丰富的病理医师于再次手术前核查病理切片时方可诊断[12]。本组1例考虑为IND,行结肠次全切除后痊愈,直肠活检及再手术病理提示全肠可见神经节细胞,发育一般。既往有研究报道约40%的HSCR合并IND,约1/3病例便秘复发与合并IND有关[16]。
二、HSCR根治术后便秘复发再手术指征与手术方式的选择1. 手术指征:Ralls等[17]总结再手术的指征为无神经节细胞段残留超过3 cm、拖下移行段伴有“新直肠”扩张、反复扩肛后仍有位置较高的狭窄、拖出肠管扭转、梗阻症状保守治疗无效以及HAEC伴或不伴便秘等,且认为术后一旦发现病理结果判定错误应及早再次手术,因为此时腹腔无明显粘连。但在我国目前医疗环境下,除非出现大出血、吻合口漏等可能危及生命的并发症,大多患者对非计划二次手术难以接受,限制了早期再手术的实施。本组再手术距首次手术时间中位数为26个月,与国内其他中心的情况相似,再手术前均按照国内外指南共识中诊疗流程,经半年以上的保守治疗,便秘症状无明显缓解,完善钡灌肠、直肠肛管测压和直肠全层活检等,明确存在手术指征[3, 6, 18]。我们的体会是HSCR根治术后出现便秘时,应当及时明确引起便秘的原因,如果为残留狭窄段或移行段,应尽早手术,往往可避免不必要的结肠次全切除。本组中14例(73.7%)行结肠次全切除,可能与两次手术间隔时间过长有关。
2. 再次手术方式的选择:再手术方案需综合便秘复发的原因和患者具体情况决定,目前尚无共识[18]。大部分中心把经腹辅助HSCR根治术作为首选。本组13例行腹会阴联合根治手术,主要原因包括:①既往有多次腹部手术病史,切口瘢痕增生明显,腹腔粘连严重;②部分病例需术中行多处肠壁全层活检和肠造口术;③需行结肠次全切除,升结肠翻转;④再手术时年龄大,盆腔深或近端肠管严重扩张,单纯经肛门操作无法完成[6, 12]。
Ralls等[2]认为腹腔镜有利于再手术时的结肠游离及肠壁活检。本组中有8例采用腹腔镜辅助手术,我们的体会是:①单纯经肛门手术后,腹腔粘连往往较轻,可尝试腹腔镜辅助手术;②既往有造瘘病史者,如无严重粘连可选择经造口单孔腹腔镜辅助手术;③腹腔镜下游离直肠比经肛门游离更有优势,操作熟练的术者可沿直肠表面游离至齿状线上1~2 cm,经肛门只需分离1 cm左右,不仅减少了经肛门的操作,减少对肛门括约肌的影响,而且腔镜直视下操作更加精细,避免对盆腔组织的过多干扰;游离更加充分,分离肠系膜的过程中能够更好地保护末端边缘动脉,从而保证吻合口血供,下拖肠管时可以避免肠扭转;④必要时可借助吲哚菁绿荧光血管造影技术等实时精准评估吻合口血供,确定肠切除的范围,避免扩大切除肠管和保护性造瘘,减少吻合口漏的发生[19]。
对于因HSCR术后便秘腹胀而急诊就诊的患者,常规保守治疗无效时可先行造瘘术[2]。造瘘术能有效缓解肠管扩张,挽救生命,改善营养状况,且经造瘘后能保留更多的正常结肠,改善术后大便情况及生活质量。本组中有4例因结肠严重扩张就诊,一期根治无法保留回盲部,因此一期行造瘘术,二期行再次根治手术,术后排便情况满意;如条件允许,HSCR根治术与造口闭合术可同期完成,以减少手术次数及经济负担。
三、HSCR根治术后便秘复发再手术的预后HSCR再次手术难度较大,近期并发症包括伤口感染、吻合口漏、穿孔及HAEC,远期并发症包括便秘、HAEC、狭窄、梗阻及瘘管形成。彭春辉等[6]报道35例再手术,32例腹胀便秘症状得到缓解,1例出现直肠膀胱瘘,2例出现吻合口瘘,再次行回肠造瘘,5例存在不同程度的污粪。本组19例术后以污粪和HAEC为主,无上述严重并发症发生,术后排便和控便整体上较为满意,但长期疗效还需要进一步随访。
| [1] |
Dasgupta R, Langer JC. Evaluation and management of persistent problems after surgery for Hirschsprung disease in a child[J]. J Pediatr Gastroenterol Nutr, 2008, 46(1): 13-19. DOI:10.1097/01.mpg.0000304448.69305.28 |
| [2] |
Ralls MW, Coran AG, Teitelbaum DH. Redo pullthrough for Hirschsprung disease[J]. Pediatric surgery international, 2017, 33(4): 455-460. DOI:10.1007/s00383-016-4045-4 |
| [3] |
Langer JC, Rollins MD, Levitt M, et al. Guidelines for the management of postoperative obstructive symptoms in children with Hirschsprung disease[J]. Pediatr Surg Int, 2017, 33(5): 523-526. DOI:10.1007/s00383-017-4066-7 |
| [4] |
Drossman DA, Sandler RS, McKee DC, et al. Bowel patterns among subjects not seeking health care.Use of a questionnaire to identify a population with bowel dysfunction[J]. Gastroenterology, 1982, 83(3): 529-534. DOI:10.1016/S0016-5085(82)80186-8 |
| [5] |
Gosain A, Frykman PK, Cowles RA, et al. Guidelines for the diagnosis and management of Hirschsprung-associated enterocolitis[J]. Pediatr Surg Int, 2017, 33(5): 517-521. DOI:10.1007/s00383-017-4065-8 |
| [6] |
彭春辉, 陈亚军, 张廷冲, 等. 先天性巨结肠术后腹胀和便秘的再手术[J]. 中华胃肠外科杂志, 2015, 12(18): 1235-1239. Peng CH, Chen YJ, Zhang TC, et al. Redo surgery in Hir-schsprung's disease for postoperative distension and constipation[J]. Chin J Gastrointest Surg, 2015, 12(18): 1235-1239. DOI:10.3760/cma.j.issn.1671-0274.2015.12.013 |
| [7] |
张文, 武海燕, 李惠, 等. 先天性巨结肠病理诊断规范[J]. 中华病理学杂志, 2016, 3(45): 149-152. Zhang W, Wu HY, Li H, et al. Guideline of pathological diagnosis of Hirschsprung's disease[J]. Chin J Pathol, 2016, 3(45): 149-152. DOI:10.3760/cma.j.issn.0529-5807.2016.03.002 |
| [8] |
Yamataka A, Yazaki Y, Koga H, et al. How best to expose the entire surgical anal canal in the operative field during transanal pull-through for Hirschsprung's disease: a crucial step that determines success[J]. Pediatric Surgery International, 2019, 35(2): 199-202. DOI:10.1007/s00383-018-4395-1 |
| [9] |
Han JW, Youn JK, Oh C, et al. Why do the patients with Hirschsprung disease get redo pull-through operation?[J]. Eur J Pediatr Surg, 2019, 29(5): 431-436. DOI:10.1055/s-0038-1667038 |
| [10] |
van de Ven T, Sloots C, Wijnen M, et al. Transanal endorectal pull-through for classic segment Hirschsprung's disease: with or without laparoscopic mobilization of the rectosigmoid?[J]. Journal of pediatric surgery, 2013, 48(9): 1914-1918. DOI:10.1016/j.jpedsurg.2013.04.025 |
| [11] |
Puri P, Gosemann JH. Variants of Hirschsprung disease[J]. Semin Pediatr Surg, 2012, 21(4): 310-318. DOI:10.1053/j.sempedsurg.2012.07.005 |
| [12] |
曾纪晓. 先天性巨结肠非计划性再手术的相关问题[J]. 临床小儿外科杂志, 2018, 17(2): 94-98. Zeng JX. Related issues of unscheduled re-operation for the treatment of Hirschsprung's disease[J]. J Clin Ped Sur, 2018, 17(2): 94-98. DOI:10.3969/j.issn.1671-6353.2018.02.004 |
| [13] |
Austin KM. The pathogenesis of Hirschsprung's disease-associated enterocolitis[J]. Semin Pediatr Surg, 2012, 21(4): 319-327. DOI:10.1053/j.sempedsurg.2012.07.006 |
| [14] |
Engum S, Grosfeld J. Long-term results of treatment of Hirschsprung's disease[J]. Semin Pediatr Surg, 2004, 13(4): 273-285. DOI:10.1053/j.sempedsurg.2004.10.015 |
| [15] |
尹晔, 杨继鑫, 冯杰雄. 2018年日本巨结肠同源病临床指南解读[J]. 中华小儿外科杂志, 2020, 8(41): 683-691. Yin Y, Yang JX, Feng JX. Interpretations of Japanese Clinial Practice Guidelines for Allied Disorders of Hirsch-sprung's Disease in 2018[J]. Chin J Pediatr Surg, 2020, 8(41): 683-691. DOI:10.3760/cma.j.cn421158-20190712-00431 |
| [16] |
Schulten D, Holschneider AM, Meier-Ruge W. Proximal segment histology of resected bowel in Hirschsprung's disease predicts postoperative bowel function[J]. European Journal of Pediatric Surgery, 2000, 10(6): 378-381. DOI:10.1055/s-2008-1072395 |
| [17] |
Ralls MW, Coran AG, Teitelbaum DH. Reoperative surgery for Hirschsprung disease[J]. Semin Pediatr Surg, 2012, 21(4): 354-363. DOI:10.1053/j.sempedsurg.2012.07.011 |
| [18] |
中华医学会小儿外科学分会肛肠学组、新生儿学组. 先天性巨结肠的诊断及治疗专家共识[J]. 中华小儿外科杂志, 2017, 11(38): 805-815. Group of Neonatology, Group of Anorectum, Society of Pediatric Surgery, Chinese Medical Association. Expert Consensus on Diagnosing and Treating Hirschspung's disease[J]. Chin J Pediatr Surg, 2017, 11(38): 805-815. DOI:10.3760/cma.j.issn.0253-3006.2017.11.002 |
| [19] |
徐晓钢, 曾纪晓, 刘斐, 等. 吲哚菁绿荧光血管显像技术在单孔腹腔镜巨结肠根治术中的应用[J]. 中国微创外科杂志, 2021, 21(2): 961-964. Xu XG, Zeng JX, Liu F, et al. Application of indocyanine green fluorescent angiography in single-port radical laparoscopy for Hirschsprung's disease[J]. Chin J Min Inv Surg, 2021, 21(2): 961-964. |
 2021, Vol. 20
2021, Vol. 20


