先天性巨结肠(Hirschsprung's disease, HSCR)是最常见的先天性胃肠神经系统疾病之一,活产儿中发病率为1/5 000,男性发病率约为女性的4倍,主要临床表现为病变肠管痉挛、肠内容物通过受阻引起下消化道梗阻;病理学改变为病变肠管神经节缺如以及神经纤维增粗、增多[1-4]。其发病机制为胚胎第3~12周时来自迷走神经的肠神经嵴前体细胞(enteric neural crest cells, ENCCs)沿头向尾方向迁移障碍所致[5-7]。研究表明,多基因如SOX10、NRG1、RET、SIP1、GDNF等参与HSCR的发生过程,但其确切发病机制仍未完全清楚[8]。
MicroRNA (miRNA) 是内源性小分子非编码RNA,大小为19~25 bp,以直接结合靶基因mRNA的3'-非翻译区(3'-UTR)阻遏翻译和(或)诱导mRNA降解的方式,参与调控细胞周期、分化、迁徙和凋亡以及能量代谢等多种细胞活动[9-11]。既往研究表明,HSCR患者肠组织中存在大量异常表达的miRNA,如miR-206[12, 13]、miR-192/215[14]、miR-140-5p[15]和miR-132/212[16]等,它们可能与HSCR发生相关。研究表明,miR-939可通过靶向HDGF诱导WNT/β-Catenin途径失活,还可通过靶向IGF-1R诱导PI3K/Akt途径失活,进而调控癌细胞增殖、迁移和凋亡,发挥抑癌作用[17, 18]。陈广林等报道miR-939可靶向LRSAM1并抑制HSCR中ENCCs增殖[19]。SOX4为SOX (Sry-related HMG box) 转录因子家族成员之一,广泛参与胚胎期神经元发育、轴突形成、神经元映射以及生殖系统发育等过程。有报道显示,SOX4可能通过Notch信号通路调控Mash1、Ngn1和Ngn2转录因子表达,并与SOX11发挥协同作用[20]。本课题组前期研究发现SOX4在HSCR患者肠组织中低表达[21]。目前尚不清楚miR-939对SOX4的调控及二者对ENCCs功能表型的影响,以及miR-939/SOX4在HSCR发病中的机制。
本研究拟通过检测miR-939和SOX4在HSCR患者肠组织中的表达水平,评估miR-939对SOX4表达调控作用,以及miR-939、SOX4对ENCCs增殖、凋亡和迁移的影响,并探讨miR-939/SOX4在HSCR干预治疗中的潜在价值。
材料与方法 一、主要实验材料孕龄15~20 d的Sprague Dawley (SD) 大鼠购自广州弗尔博生物科技有限公司;DMEM/F12培养基、胰蛋白酶、Ⅳ型胶原酶、Lipofectamine 2000、Trizol试剂均购自美国Invitrogen公司;Nestin、GFAP、SOX4单克隆一抗均购自美国Abcam公司;miR-939模拟物、SOX4 siRNA及阴性对照试剂均购自上海吉玛制药技术有限公司;CCK8试剂盒购自碧云天生物技术研究所;Transwell迁移室、增强的化学发光系统购自美国Millipore公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国Yeasen公司;TaqMan MicroRNA检测试剂盒、ABI 7900HT荧光定量PCR仪购自美国Applied Biosystems公司;SYBR GREEN 1购自日本TaKaRa公司;RIPA缓冲液购自南京森贝伽生物科技有限公司;PVDF膜购自美国Thermo Fisher Scientifc公司。
二、研究方法 1 患者组织样本采集收集2019年1月至2020年1月在西安交通大学第二附属医院进行手术治疗的30例HSCR患者狭窄段(无神经节细胞肠段)肠组织,另选取30例经手术治疗肠套叠患者的结肠非病变处组织作为对照;所有组织标本用生理盐水冲洗后保存于-80℃环境下。HSCR患者年龄为30天至5岁,男23例,女7例。对照组患者年龄为1~5岁,男20例,女10例。两组患者基线资料匹配,具有可比性。本研究开展前获得患者监护人的书面知情同意书,并获取我院伦理委员会批准。
2 SD大鼠ENCCs分离培养参考肖莉等[22]的研究方法进行ENCCs分离培养。取孕15~18天SD胎鼠肠管,小心剔除肠系膜后充分剪碎,分别用胰蛋白酶、Ⅳ型胶原酶消化30 min、10 min,添加胎牛血清终止消化,无菌滤网过滤,于37℃下1 000 r/min离心3 min,弃上清后PBS冲洗3次,完全培养基重悬并计数,按照6×105个细胞/mL的密度接种到培养瓶中,于37℃、5%CO2条件下培养3~5 d,然后传代培养。传代5次后进行克隆球的分化培养,取适量左旋多聚赖氨酸包被盖玻片于24孔板中过夜,无菌双蒸水清洗3次,600 r/min离心2 min离心收集悬浮神经球,0.25%胰蛋白酶消化5~10 min,轻柔吹打,制成单细胞悬液,离心弃上清,添加10%胎牛血清的完全培养基重悬,以每孔1×105细胞/mL接种于24孔板,于37℃、5%CO2条件下培养8 h,观察克隆球的分化情况。
3 SD大鼠ENCCs鉴定收集悬浮生长状态良好的神经球离心,用4%多聚甲醛固定30 min,0.5% Triton X-100室温透膜10 min,5%胎牛血清室温封闭30 min,4℃下将盖玻片分别于1 ∶ 500稀释的鼠抗Nestin和兔抗GFAP一抗中过夜孵育,室温复温1 h,PBS清洗,然后与FITC绿色和TRITC红色荧光二抗室温孵育1 h,PBS清洗,DAPI染色10 min,将盖玻片置于荧光显微镜下观察细胞染色情况。
4 ENCCs转染收集悬浮生长状态良好的神经球于离心管中,37℃下1 000 r/min离心3 min,弃上清,0.25%胰蛋白酶消化5~10 min,轻柔吹打,制成单细胞悬液,离心弃上清,用完全培养基重悬,按照2×105细胞/孔的密度接种于6孔板中。根据制造商说明书,配合使用Lipofectamine 2 000将miR-939模拟物、SOX4-siRNA和阴性对照试剂转染细胞。
5 ENCCs增殖测定分别用miRNA或siRNA转染48 h后,使用CCK-8细胞活力检测试剂盒测定细胞活力以评估增殖情况,使用酶标仪测量450 nm处的吸光度,记录OD值。
6 ENCCs凋亡测定将miRNA或siRNA转染的细胞于37℃、5%CO2条件下孵育48 h后进行收集,根据制造商说明书,使用Annexin V-FITC/PI细胞凋亡检测试剂盒进行染色,流式细胞仪检测细胞凋亡。
7 ENCCs迁移测定使用孔径8 μm规格的Transwell迁移小室进行细胞迁移分析,将转染的细胞置于完全培养基重悬,调整密度为1×105细胞/ml,并添加100 μL到上室中,将600 μL含有10%FBS的分化培养基添加到下室中,于37℃、5%CO2条件下孵育24 h后,用棉签小心擦拭上室,预冷PBS清洗后,乙醇固定10 min,结晶紫染色10 min,PBS充分清洗后,在显微镜下(×100)随机选择5个视野留取照片进行计数。
8 RNA分离和qRT-PCR按照试剂商说明书上方法使用Trizol试剂从组织样品和细胞中提取总RNA用于后续实验。TaqMan MicroRNA检测试剂盒用于检测miR-939,以U6作为标准化对照。通过ABI 7900HT荧光定量PCR仪和SYBR GREEN 1检测SOX4 mRNA表达水平,以GAPDH作为内参。实验用到的引物序列如下:SOX4,正向,5'-CGAGAAAATCGGGTAGCCCA-3',反向,5'-CAGATTCACTCGCAATGCCC-3';GAPDH,正向5'-GTGGAATGGTGCAGACCAAG-3',反向5'-GTCAGGAGGTGGGATGTTGG-3'。全部实验数据采用2-△△Ct法评估miRNA或mRNA的表达水平。
9 Western blot按照试剂商说明书方法,使用含有蛋白酶抑制剂的RIPA裂解液从组织和细胞中提取总蛋白质。采用Bradford方法检测蛋白质浓度。采用15%SDS-PAGE分离出等量蛋白质,转移到PVDF膜上,用5%脱脂牛奶封闭,分别以1 ∶ 500和1 ∶ 1 000的稀释度与抗SOX4和抗GAPDH一抗孵育,4℃条件下过夜,在室温(37℃)条件下与辣根过氧化物酶标记的山羊抗小鼠IgG二抗共孵育1 h,使用增强的化学发光系统进行显影,GAPDH作为内部对照。使用ImageJ软件对条带进行定量分析。
三、统计学处理使用SPSS24.0进行统计分析,实验结果中服从正态分布的定量数据以(x±s)表示,所有实验独立重复3次以上。采用独立样本t检验进行两组间差异性分析,采用单因素方差分析及基于Bonferroni校正的事后多重检验进行多组间差异比较,P < 0.05表示差异具有统计学意义。
结果 一、ENCCs神经球鉴定于原代培养第3天、第5天在光学显微镜下观察ENCCs来源神经球生长情况,通过Nestin和GFAP双免疫荧光染色对ENCCs来源的神经球进行鉴定,结果可见神经球表现为Nestin(红色荧光)和GFAP(绿色荧光)双阳性,细胞核被DAPI染为蓝色,Nestin+/GFAP+双阳性表示细胞为ENCC细胞(图 1)。

|
图 1 ENCCs来源神经球光学显微镜观察结果和免疫荧光染色结果(×200) A:原代培养第3天的神经球;B:原代培养第5天的神经球;C:GFAP阳性(绿色区域);D:Nestin阳性(红色区域);E:DAPI阳性(蓝色区域);F:染色融合 Fig.1 Observation of light microscopy and Nestin/GFAP immunofluorescence staining of ENCCs neurosphere (×200) |
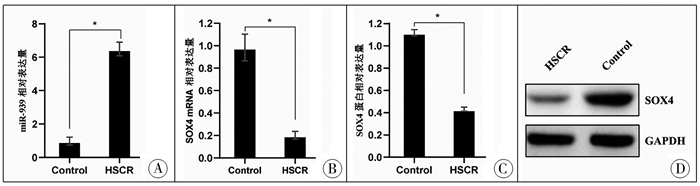
分别通过RT-PCR检测HSCR患者肠组织中miR-939和SOX4 mRNA的表达水平,通过Western blot检测SOX4蛋白表达水平。结果表明,与肠套叠患者肠组织相比,HSCR患者肠组织中miR-939的表达水平显著增加(图 2A),SOX4的mRNA(图 2B)和蛋白(图 2C, 图 2D)表达水平显著降低。
|
图 2 先天性巨结肠患者(HSCR组)和肠套叠患者(control组)肠组织中miR-939和SOX4的表达情况 A、B:RT-PCR检测miR-939(A)和SOX4 mRNA(B)表达;C:Western blot检测SOX4蛋白表达;D:Western blot条带ImageJ定量结果;*代表与control组比较,P < 0.05 Fig.2 miR-939/SOX4 expression in intestinal tissues of patients with Hirschsprung's disease and intussusception |
使用miR-939 mimic转染ENCCs,RT-PCR检测结果显示miR-939的表达水平上调(图 3A)。CCK-8实验结果表明,与对照组相比,上调miR-939的表达显著抑制ENCCs细胞增殖(图 3B);流式细胞仪分析表明,与对照组相比,上调miR-939的表达显著促进ENCCs细胞凋亡(图 3C, 图 3D);Transwell实验结果表明,与对照组相比,上调miR-939的表达显著抑制ENCCs细胞迁移(图 3E, 图 3F)。

|
图 3 上调miR-939的表达对肠神经嵴干细胞增殖、凋亡和迁移的影响 A:转染miR-939 mimic上调细胞中miR-939的表达;B:CCK8法测定细胞增殖;C, D:Annexin V-FITC/PI法测定细胞凋亡;E, F:Transwell实验检测细胞迁移;*代表与对照比较,P < 0.05 Fig.3 Effect of up-regulated miR-939 expression on the proliferation, apoptosis and migration of enteric neural crest stem cells |
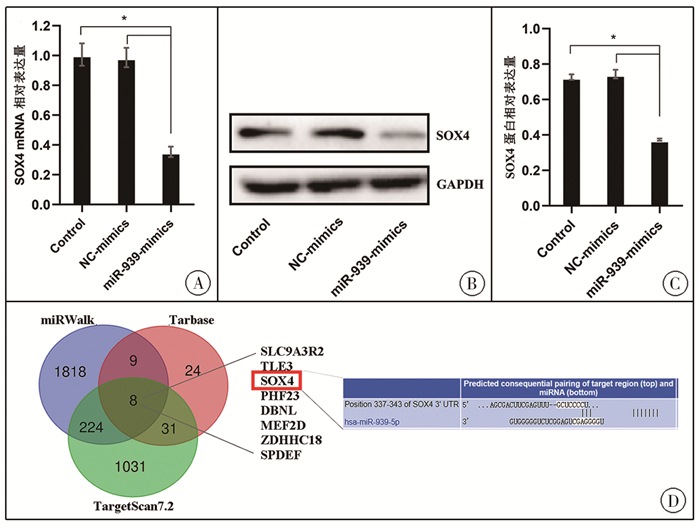
转染miR-939 mimic后,分别通过RT-PCR和Western blot检测SOX4的mRNA和蛋白表达水平,结果显示,与对照组相比,转染miR-939 mimic显著抑制ENCCs细胞中SOX4的表达(图 4A-图 4C)。在miRWalk、Tarbase和TargetScan数据库分别预测到miR-939靶基因数分别为2 059个、72个和1 294个,三个数据预测到的共同靶基因有8个,其中包含SOX4,在TargetScan获得miR-939与SOX4结合位点信息(图 4D)。
|
图 4 ENCCs中miR-939靶向调控SOX4表达 A:RT-PCR检测SOX4 mRNA表达;B:Western blot检测SOX4蛋白表达;C:Western blot条带ImageJ定量结果;D:通过miRWalk、Tarbase和TargetScan数据库预测到miR-939靶基因;*表示与对照比较,P < 0.05 Fig.4 Up-regulated miR-939 regulated SOX4 expression in enteric neural crest stem cells |
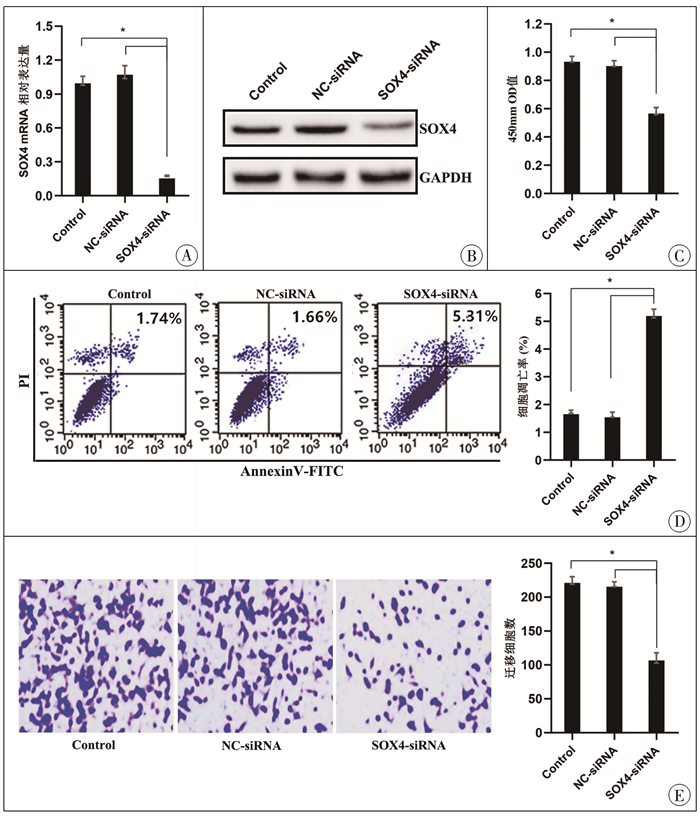
使用SOX4-siRNA转染ENCCs细胞,RT-PCR和Western blot检测结果显示SOX4的mRNA和蛋白表达下调(图 5A, 图 5B),分别检测ENCCs细胞增殖、迁移和凋亡(方法同前),结果表明,下调SOX4的表达可显著抑制ENCCs细胞的增殖(图 5C)和迁移(图 5E),并促进凋亡(图 5D)。
|
图 5 下调SOX4的表达对肠神经嵴干细胞增殖、凋亡和迁移的影响 A、B:RT-PCR和Western blot证实转染SOX4-siRNA可敲低ENCCs细胞中SOX4的mRNA和蛋白表达;C:CCK8法测定细胞增殖;D:Annexin V-FITC/PI法测定细胞凋亡;E:Transwell实验检测细胞迁移;*代表与对照比较,P < 0.05 Fig.5 Effect of down-regulation of SOX4 expression on proliferation, apoptosis and migration of enteric neural crest stem cells |
肠神经系统(enteric nervous system, ENS)属于直接调节胃肠系统的独立神经系统,而肠神经嵴前体细胞(enteric neural crest cells, ENCCs)发育障碍是导致ENS相关疾病,引发肠道功能异常的主要原因之一[23]。当ENCCs增殖、凋亡、迁移和分化等过程出现异常时可引起先天性巨结肠(Hirschsprung's disease, HSCR)[24]。HSCR的发生是一个复杂的过程,涉及多个基因转录和表达异常,尽管很多学者已经鉴定出一些导致HSCR发生的关键基因,但尚不清楚导致其发病机理的主要机制。
在胚胎发生过程中,ENCCs从结肠前端到远端的迁移需要持续数周,此过程中影响ENCCs增殖、迁移和凋亡的各种因素均可能影响神经节的形成。大量研究已证明miRNA在胚胎发育过程中起着至关重要的作用,而关于miRNA参与HSCR的发病过程也有较多研究。据报道,miR-192/215在HSCR组织样品中显著下调,且沉默miR-192/215通过靶向Nidogen 1(NID1)抑制人293T和SH-SY5Y细胞的增殖和迁移[14]。另外,miR-206的下调通过抑制细胞增殖和迁移而参与HSCR的发生[12, 13]。下调miR-200a/141通过调节磷酸酶- 张力蛋白同源物的表达在HSCR发病过程中起关键作用[25]。此外,有学者研究报道,HSCR患者血浆外泌体中存在异常高表达的miRNAs分子,有可能参与细胞外基质- 受体相互作用,通过干扰细胞连接而促进HSCR发生[26]。本研究发现miR-939在HSCR患者结肠组织样本中显著上调,并且上调miR-939的表达显著抑制ENCCs的迁移和增殖,并促进细胞凋亡。这些结果表明miR-939的异常高表达可能直接参与破坏ENCCs功能的过程,从而促进先天性巨结肠的发展。
性别决定区相关高迁移率族盒蛋白4(Sry-related HMG box 4, SOX4)为SOX(Sry-related HMG box)转录因子家族成员之一,广泛参与胚胎期神经元发育、轴突形成和神经元映射,以及生殖系统发育等过程,并在多种类型的人类恶性肿瘤患者组织中呈高表达状态。SOX4的高表达与肿瘤血管生成以及对放化疗的抗性有关[27]。据报道,SOX4的上调促进结直肠癌细胞的增殖和侵袭,SOX4的高表达可抑制宫颈癌细胞对化疗药物的敏感性。SOX4可能通过Notch信号通路调控Mash1、Ngn1和Ngn2转录因子表达,并与SOX11发挥协同作用调控神经发生[20]。课题组前期研究发现,先天性巨结肠组织样本中SOX4表达显著下调[21],提示SOX4可能参与HSCR的发病过程。基于此,本研究通过转染靶向SOX4的siRNA敲低ENCCs细胞中SOX4的表达,结果显示,下调SOX4可显著抑制ENCCs细胞增殖和迁移能力,促进细胞凋亡。本研究还观察到上调miR-939可显著抑制ENCCs细胞中SOX4的表达,并获得与敲低SOX4类似ENCCs表型变化结果。此外,通过miRWalk、Tarbase和TargetScan数据库分别预测到miR-939可能的靶基因为SOX4,在TargetScan获得miR-939与SOX4结合位点信息。以上结果表明,miR-939可能通过靶向调控SOX4表达来影响ENCCs细胞功能,进而参与HSCR发生过程。
HSCR的早期诊断和治疗是改善患者预后的关键。然而,临床上HSCR具有多种亚型及复杂的临床表现,钡灌肠、直肠肛门测压、家族史和基因诊断技术等均不能对HSCR进行可靠预测,主要依赖于直肠活组织检查发现特征性神经节细胞数量的减少来做出最终诊断。有学者[26]提到循环生物标志物对HSCR的诊断意义,肝癌和结肠癌患者血液中miR-939表达水平均对疾病诊断和预后具有独立预测价值,并对促炎基因表达有调控作用。因此,有必要开展针对HSCR患者血液循环miRNAs的研究,为临床上通过检测血液循环miR-939作为HSCR诊断的辅助手段提供证据支持。
综上所述,本研究认为,miR-939和SOX4均参与HSCR的发病过程。HSCR患者肠组织中miR-939显著上调,而SOX4显著下调。上调miR-939或下调SOX4均可抑制ENCCs的增殖和迁移,并诱导细胞凋亡。miR-939的高表达通过靶向抑制SOX4表达,从而抑制ENCCs的生长、迁移和促进凋亡,从而参与HSCR的发生发展过程。因此,靶向miR-939或SOX4的干预措施可能是HSCR临床诊断与治疗的新思路。
| [1] |
朱天琦. 先天性巨结肠的诊断及治疗专家共识[J]. 中华小儿外科杂志, 2017, 38(11): 805-815. Zhu TQ. Expert consensus of diagnosis and treatment of Hirschspung's disease[J]. Chin J Pediatr Surg, 2017, 38(11): 805-815. DOI:10.3760/cma.j.issn.0253-3006.2017.11.002 |
| [2] |
沈涤华, 施诚仁, 吴晔明, 等. 先天性巨结肠患儿肠道内Smoothelin的表达[J]. 中华小儿外科杂志, 2017, 38(4): 288-291. Shen DH, Shi CR, Wu YM, et al. Expression levels of smoothelin in colonic tissues from patients with Hirschs-prung's disease[J]. Chin J Pediatr Surg, 2017, 38(4): 288-291. DOI:10.3760/cma.j.issn.0253-3006.2017.04.010 |
| [3] |
张建军, 刘丰丽, 唐维兵, 等. 深化的加速康复外科理念在婴儿先天性巨结肠症围手术期的应用[J]. 中华小儿外科杂志, 2019, 40(3): 245-248. Zhang JJ, Liu FL, Tang WB, et al. Promoting perioperative application of enhanced recovery after surgery for infantile Hirschsprung's disease[J]. Chin J Pediatr Surg, 2019, 40(3): 245-348. DOI:10.3760/cma.j.issn.0253-3006.2019.03.011 |
| [4] |
Borrego S, Ruiz-Ferrer M, Fernandez RM, et al. Hirschs-prung's disease as a model of complex genetic etiology[J]. Histology & Histopathology, 2013, 28(9): 1117-1136. DOI:10.14670/HH-28.1117 |
| [5] |
牛鑫, 景雅, 李海荣, 等. 神经嵴细胞和胰岛因子-1阳性细胞与小鼠胚胎心动脉端的发育[J]. 解剖学杂志, 2012, 35(5): 553-557. Niu X, Jing Y, Li HR, et al. Distribution patterns of neural crest cells and ISL-1 positive cells during the development of arterial pole of murine embryonic heart[J]. Chinese Journal of Anatomy, 2012, 35(5): 553-557. DOI:10.3969/j.issn.1001-1633.2012.05.001 |
| [6] |
Luzón-Toro B, Gui H, Ruiz-Ferrer M, et al. Exome sequencing reveals a high genetic heterogeneity on familial Hirschsprung disease[J]. Scientific Reports, 2015, 5: 16473. DOI:10.1038/srep16473 |
| [7] |
Nishikawa R, Hotta R, Shimojima N, et al. Migration and differentiation of transplanted enteric neural crest-derived cells in murine model of Hirschsprung's disease[J]. Cytotechnology, 2015, 67(4): 661-670. DOI:10.1007/s10616-014-9754-8 |
| [8] |
Rogers JM. Search for the missing lncs: gene regulatory networks in neural crest development and long non-coding RNA biomarkers of Hirschsprung's disease[J]. Neurogastroenterol Motil, 2016, 28(2): 161-166. DOI:10.1111/nmo.12776 |
| [9] |
Feng A, Yuan X, Li X. MicroRNA-345 inhibits metastasis and epithelial-mesenchymal transition of gastric cancer by targeting FOXQ1[J]. Oncology Reports, 2017, 38(5): 2752-2760. DOI:10.3892/or.2017.6001 |
| [10] |
Liu Y, Wang Y, Xu Q, et al. Prognostic evaluation of microRNA-210 in various carcinomas[J]. Medicine, 2017, 96(43): e8113. DOI:10.1097/MD.0000000000008113 |
| [11] |
Zhang Z, Wang J, Li J, et al. MicroRNA-150 promotes cell proliferation, migration, and invasion of cervical cancer through targeting PDCD4[J]. Biomed Pharmacother, 2017, 97: 511-517. DOI:10.1016/j.biopha.2017.09.143 |
| [12] |
Sharan A, Zhu H, Xie H, et al. Down-regulation of miR-206 is associated with Hirschsprung disease and suppresses cell migration and proliferation in cell models[J]. Scientific Reports, 2015, 5(1): 9302. DOI:10.1038/srep09302 |
| [13] |
Gunadi, Budi Nyp, Kalim As, et al. Aberrant expressions of miRNA-206 target, FN1, in multifactorial Hirschsprung disease[J]. Orphanet J Rare Dis, 2019, 14(1): 5. DOI:10.1186/s13023-018-0973-5 |
| [14] |
Zhu D, Xie H, Li H, et al. Nidogen-1 is a common target of microRNAs MiR-192/215 in the pathogenesis of Hirschs-prung's disease[J]. Journal of Neurochemistry, 2015, 134(1): 39-46. DOI:10.1111/jnc.13118 |
| [15] |
Du G, Wang X, Wu Y, et al. Downregulation of miR-140-5p affects the pathogenesis of HSCR by targeting EGR2[J]. Pediatr Surg Int, 2020, 36(8): 883-890. DOI:10.1007/s00383-020-04686-0 |
| [16] |
Li H, Zhou L, Zhi Z, et al. Lipopolysaccharide upregulates miR-132/212 in Hirschsprung-associated enterocolitis, facilitating pyroptosis by activating NLRP3 inflammasome via targeting Sirtuin 1 (SIRT1)[J]. Aging (Albany NY), 2020, 12(18): 18588-18602. DOI:10.18632/aging.103852 |
| [17] |
Situ J, Zhang H, Jin Z, et al. MicroRNA-939 directly targets HDGF to inhibit the aggressiveness of prostate cancer via deactivation of the WNT/β-Catenin pathway[J]. Onco Targets Ther, 2020, 13: 4257-4270. DOI:10.2147/OTT.S250101 |
| [18] |
Zhao X, Li J, Yu D. MicroRNA-939-5p directly targets IGF-1R to inhibit the aggressive phenotypes of osteosarcoma through deactivating the PI3K/Akt pathway[J]. Int J Mol Med, 2019, 44(5): 1833-1843. DOI:10.3892/ijmm.2019.4333 |
| [19] |
Chen G, Du C, Shen Z, et al. MicroRNA-939 inhibits cell proliferation via targeting LRSAM1 in Hirschsprung's disease[J]. Aging (Albany NY), 2017, 9(12): 2471-2479. DOI:10.18632/aging.101331 |
| [20] |
Kavyanifar A, Turan S, Lie DC. SoxC transcription factors: multifunctional regulators of neurodevelopment[J]. Cell Tissue Res, 2018, 371(1): 91-103. DOI:10.1007/s00441-017-2708-7 |
| [21] |
Pan W, Yu H, Zheng B, et al. Upregulation of MiR-369-3p suppresses cell migration and proliferation by targeting SOX4 in Hirschsprung's disease[J]. J Pediatr Surg, 2017, 52(8): 1363-1370. DOI:10.1016/j.jpedsurg.2017.04.002 |
| [22] |
肖莉, 刘勇, 高亚. 小鼠胚胎肠神经嵴干细胞的分离培养及鉴定[J]. 西安交通大学学报(医学版), 2007, 28(5): 595-597. Xiao L, Liu Y, Gao Y. Isolation, culturing and identification of murine embryonic enteric neural crest stem cells[J]. Journal of Xi'an Jiaotong University, 2007, 28(5): 595-597. DOI:10.3969/j.issn.1671-8259.2007.05.034 |
| [23] |
Fattahi F, Steinbeck JA, Kriks S, et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease[J]. Nature, 2016, 531(7592): 105-109. DOI:10.1038/nature16951 |
| [24] |
肖俊, 李智. 肠神经系统发育的研究进展[J]. 中华小儿外科杂志, 2018, 39(12): 952. Xiao J, Li Z. Recent advances in the development of enteric nervous system[J]. Chin J Pediatr Surg, 2018, 39(12): 952. DOI:10.3760/cma.j.issn.0253-3006.2018.12.019 |
| [25] |
Li H, Tang J, Lei H, et al. Decreased MiR-200a/141 suppress cell migration and proliferation by targeting PTEN in Hirschsprung's disease[J]. Cellular Physiology and Biochemistry, 2014, 34(2): 543-553. DOI:10.1159/000363021 |
| [26] |
Lv X, Li Y, Li H, et al. Molecular function predictions and diagnostic value analysis of plasma exosomal miRNAs in Hirschsprung's disease[J]. Epigenomics, 2020, 12(5): 409-422. DOI:10.2217/epi-2019-0190 |
| [27] |
Yoon TM, Kim SA, Cho WS, et al. SOX4 expression is associated with treatment failure and chemoradioresistance in oral squamous cell carcinoma[J]. BMC Cancer, 2015, 15(1): 888. DOI:10.1186/s12885-015-1875-8 |
| [28] |
Wang B, Li Y, Tan F, et al. Increased expression of SOX4 is associated with colorectal cancer progression[J]. Tumor Biology, 2016, 37(7): 9131-9137. DOI:10.1007/s13277-015-4756-5 |
 2021, Vol. 20
2021, Vol. 20


