下肢长骨干骨折是儿童常见创伤,主要包括股骨干骨折和胫骨干骨折,治疗方式包括保守治疗和手术治疗。但无论采用何种治疗方式,双下肢不等长是儿童下肢长骨干骨折后最常见的并发症之一,通常为患肢过度生长所致[1]。双下肢不等长除了引起跛行,还可引起背痛、脊柱侧弯以及坐骨神经痛等症状。轻微下肢不等长的患者可以通过垫高鞋跟的方法矫正,较为严重的患者需行临时骨骺阻滞术或肢体延长术[2]。下肢长骨骨折后肢体过长的发生机制尚不完全明确,本文对其研究进展进行综述。
一、骨折后过度生长现象1849年,有学者发现儿童长骨干骨折后会出现过度生长的现象,随后Paget(1863年)、Ollier(1867年)等也相继报道了类似现象。1921年,Truesdell详细记录了5例股骨干骨折儿童的受伤部位、治疗方式以及随访过程,发现患侧下肢存在过度生长的情况,并认为创伤本身是引起股骨加速生长的主要原因[3]。
随着现代影像学技术的发展,对这一现象的认识也越来越明确。相关临床研究表明,过度生长主要发生于骨折后的18~24个月,多见于12岁以内的患者,7岁以内患者更为明显,双下肢长度差通常在10 mm左右[1, 4, 5]。股骨干骨折的患者,不论是采用闭合复位石膏固定或Pavlik吊带治疗,还是切开复位内固定,均有发生过度生长的现象[4]。Flynn等[6]对过度生长现象提出了评价指标,认为过度生长造成双下肢长度差在1 cm以内的患者预后优秀,1~2 cm者预后满意,2 cm以上者预后较差。
对于引起过度生长的危险因素,既往研究普遍集中在性别、年龄、骨折原因、骨折类型、骨折线位置等方面。Clement和Colton通过分析比较44例年龄在7个月至12岁经保守治疗的股骨干骨折患者,发现男孩平均过度生长9.9 mm,女孩平均过度生长5.5 mm(P < 0.025)[7]。但他们并没有分析不同性别引起过度生长差异的具体原因,而有学者认为过度生长与性别无关[8, 9]。同时,该研究也注意到年龄越小过度生长越明显,与其他学者研究结果一致[10-12]。
关于骨折部位,Beaty等[13]认为骨折线位于股骨近端1/3处对过度生长的影响更为明显。而Edvardson、Syversen以及Shapiro[11, 14]并未发现上述现象。骨折类型也被认为是影响过度生长的因素。国内有研究认为不稳定型,即长斜形、旋转和粉碎性股骨干骨折较稳定型(短斜形和横形)股骨干骨折更易出现过度生长超过1 cm的现象[15]。Fakoor等[8]也发现在同样采用切开复位钢板螺钉固定的情况下,股骨干螺旋形骨折较横形骨折患者过度生长更明显。该现象可能与不稳定骨折的稳定性较差及出血较多有关。由此可见,过度生长现象发生的危险因素仍存在广泛的争议,需要更为全面的临床研究证实。
内固定物的选择也可能与骨折后过度生长有关。近年来,弹性髓内钉广泛应用于儿童长骨骨折,其与肢体过长的相关性也备受关注。有研究发现儿童胫骨干骨折弹性髓内钉固定2年后,随访时患侧可平均过度生长5 mm,最长可达15 mm[16]。Park等[9]通过分析股骨干骨折患者弹性髓内钉与髓腔直径的比例,发现比例≥0.8,股骨平均过度生长0.36 cm,而 < 0.8时,过度生长可达1.0 cm,两者有统计学差异,国内相关研究也支持这一观点[15]。这一差异可能与髓内钉占髓腔比例越高,骨折固定越稳定有关[17]。Nascimento等[18]通过比较弹性髓内钉与手法复位石膏固定治疗股骨干骨折的结果,发现弹性髓内钉治疗更易导致股骨过长,该结果可能与手法复位石膏固定更易出现成角畸形有关。但这些研究并未分析过度生长与是否解剖复位有关系。尚无研究分析弹性髓内钉固定方式(双侧钻孔CC型和单侧钻孔CS型)在过度生长方面有无差别。另外,弹性髓内钉导致骨折后过度生长的机制尚不明确,仍缺乏不同内固定方式对过度生长影响的比较研究。对于不伴有其他损伤的胫骨干骨折,尚无研究表明其胫骨过度生长是否伴随腓骨过度生长,以及是否产生踝外翻畸形。值得注意的是,一些学者在上肢长骨骨折及下颌骨折患者中亦观察到过度生长的现象,其发生机制及危险因素是否与下肢长骨骨折相似有待进一步研究[19, 20]。
二、骨膜断裂与骨折后过度生长既往研究普遍认为骨折后过度生长与骨折后干骺端血供增加以及骨膜完整性被破坏有关。Yabsley和Harris[21]发现长骨骨干骨折以及骨膜剥离后生长板的血运有所增加。而更多研究集中在骨膜受损与过度生长的关系。
早在1873年,Ollier[22]发现骨折后过度生长与骨膜的完整性受损有关,并制作了相关动物模型。该研究将尺桡骨末端的骨膜剥离,发现骨骼生长速度增快。随后关于骨膜与过度生长的研究逐渐展开。Halanski等[23]通过横形切开、剥离兔一侧胫骨近端骨膜,发现2~8周后胫骨远端生长板细胞增殖分化较对侧活跃。与此同时,该研究测量了2周和8周时胫骨近端生长速率,发现2周时术侧较对侧快(64.1±29)μm/d(P < 0.001);8周时术侧生长较快但无统计学意义(P=0.75)。Warrell等[24]通过比较不同方向切开骨膜致过度生长情况,发现环形切开骨膜较纵向切开骨膜更易导致过度生长,因此推测沿长骨干纵轴方向的牵引力降低是促进骨骼过度生长的原因。为证实上述观点,Morscher等[25]利用外固定架,对胫骨骨膜横形切开后的兔子在胫骨近端生长板两侧施加或降低1 kg的压力,研究骨膜断裂后生长板压力之间的关系。实验证明,骨膜断裂后的确会降低生长板两端的压力,而导致骨骼过度生长。
对于生长板两端压力与骨生长的关系,Hueter-Volkmann定律指出,生长板所受压力增加,骨的生长就会受到抑制;相反,骨的生长就会加速[26]。Strokes等[26]在动物研究中发现,不论是椎骨还是胫骨,在一定范围内,生长板两端压力降低与骨骼长度增加呈线性关系。相关动物实验结果对将来临床治疗双下肢不等长可能有一定的指导意义。Limpaphayom和Prasongchin[27]曾尝试通过骨膜剥离治疗双下肢不等长患者,并取得较好效果。
骨膜完整性受损与生长板过度生长的关系可以从生物力学角度加以解释。骨膜是一种纤维结缔组织,在骨表面形成一个连续的鞘。纤维骨膜主要附着于骨两端的干骺端和生长板,其在生长板两端产生的压力可能会对骨骼发育造成影响。Bertram等[28]通过测量不同位置骨膜张力,绘制了张力应变曲线,并发现骨膜张力从生长板近端到生长板远端每毫米增加1牛顿。根据张力应变曲线,张力变化越快,即骨膜粘附越紧的地方,两端产生的压力就越大,因而生长板和干骺端是压力最大的地方。骨膜横形切断之后,骨膜的张力减小或消失,从而导致生长板两端的压力减小,骨生长加速。这可以推测,粉碎性骨折或螺旋形骨折后的股骨远端生长板可能因骨膜破坏更严重,两端压力减低更多,故此类型的骨折较其他稳定性骨折有更加明显的过度生长现象。
上述实验均从一个较为宏观的角度对骨折后过度生长现象进行分析和解释,没有探究相关的分子生物学机制,未能揭示过度生长的本质过程。
三、长骨骨折后过度生长相关分子机制儿童长骨的生长主要由两端的生长板完成,但不同骨骼远近端骺板对生长的贡献不同。股骨近端生长板对股骨生长贡献较小,约占股骨总长度的30%;股骨远端生长板呈盘状,承担了约70%的生长任务;胫骨近端和远端生长板对胫骨的贡献分别为55%和45%[2]。Bisgard[29]于1936年在动物实验中发现骨折后过度生长现象集中在生长板,而不是骨折部位。作者在临床中也发现,骨折后患侧Harris线与骺板的距离较对侧更宽(图 1),说明骨折后过度生长现象来自于骺板。
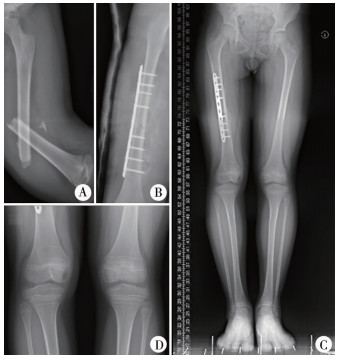
|
图 1 股骨干骨折后过度生长 注 患者,男,8岁,车祸伤致右股骨中段骨折,行切开复位钢板内固定治疗,术后1年复查A:右股骨粉碎性骨折术前;B:右侧股骨钢板螺钉内固定术后;C:右侧全长728.4 mm,左侧全长709.0 mm;D:右侧Harris线距离生长板上缘宽度大于左侧 Fig.1 Overgrowth after femoral shaft fracture |
生长板是一种特殊的软骨结构,依据组织学和功能特点可以分为静止层、增殖层、肥大层和钙化层。软骨细胞沿轴线方向增殖,按柱状排列,并在肥大层中体积增大。静止细胞和肥大细胞附近胶原也逐渐纵向排列,与柱状排列的细胞走行一致。生长板发育与一些全身性激素以及旁分泌因子有关,主要包括性别决定区Y框蛋白9(SRY-box transcription factor 9, Sox9)、Runt相关转录因子2(Runt-related transcription factor 2, Runx2)、Wnt家族、印猬蛋白(Indian Hedgehog, IHH)、甲状旁腺激素相关蛋白(parathyroid hormone related protein, PTHrP)等特异性转录因子;成纤维细胞生长因子(fibroblast growth factor, FGF)家族,以骨形态发生蛋白(bone morphogenetic protein, BMP)为代表的转化生长因子-β(transforming growth factor-β, TGF-β)超家族,血管内皮生长因子(vascular endothelial growth factor, VEGF)等以及甲状腺激素、性激素等[30]。Smad1可以促进BMP2诱导骨髓间充质干细胞向软骨细胞转化,同时抑制成骨细胞分化[31]。Sox9在软骨形成中起到关键作用,在胎儿时期即有表达,主要促进骨祖细胞向软骨细胞转化[32]。同时,Sox9也与性别决定因子SRY有密切关系[33],或可以解释Clement等[7]观察到男孩过度生长较女孩明显的现象。Runx2在软骨成熟过程中发挥重要作用,通过Runx2-Ihh-PTHrP通路负反馈调节生长板软骨细胞肥大,此外IHH也可以在软骨膜中刺激Runx2表达,在成骨细胞分化中发挥作用[34]。FGF可以与跨膜蛋白成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)胞外区域结合,诱导其胞内区域酪氨酸残基磷酸化。活化的FGFR可以在胞内募集相关靶蛋白并将它们磷酸化修饰[35]。FGF下游通路包括JAK/STAT、MAPK、PI3K/AKT、PLCγ/PKC等,主要负责调节生长板软骨细胞增殖、分化、存活以及产生胞外基质[36]。FGF家族和BMP家族可以相互调节各自下游通路的表达以及它们的稳定性[37]。上述因子共同作用,促进生长板软骨向骨转化并使长骨延长,完成软骨内化骨。
骨折后过度生长的分子机制可能与上述生物学通路有关。Ashraf等[38]使用基因芯片测定大鼠在股骨干骨折后股骨近端生长板中相关基因的mRNA表达,发现血管再生相关基因表达下调,这与Warrell在动物模型中发现干骺端血供增加相冲突[24]。与神经细胞相关的转录因子Marcks样蛋白表达增多,促进4,5-二磷酸磷脂酰肌醇(phosphatidylinositol 4, 5-bisphosphate, PIP2)转化为三磷酸肌醇(inositol 1, 4, 5-trisphosphate, IP3)、二酰甘油(diacylglycerol, DAG)、3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3, 4, 5-trisphosphate,PIP3)等信号分子,激活多条信号通路,刺激长骨轴向生长有关[39]。与巨噬细胞、破骨细胞相关的基因表达增加,说明骨转换的速度增快。与此同时,成骨细胞和骨细胞相关基因表达也出现上调,骨形成过程同样加快。与预想的一样,细胞周期相关蛋白的表达均有所增加。细胞周期特异性蛋白1和tramdorin 1蛋白在骨折后的一段时间内表达均上调,表明细胞增殖活跃。除此之外,Fischerauer等[40]研究发现BMP-6和BMPR-1a在胫骨骨折的动物模型中表达也有所增加,说明骨髓间充质干细胞向软骨细胞分化增加。另外,相关基础研究发现,FGFR3可以通过一种蛋白酶依赖的方式调节BMPR-1a表达[41],故考虑FGF家族可能也参与了骨折后过度生长。
这些实验研究了骨折后过度生长的分子机制,但仍有不足。首先,股骨干骨折后股骨远端生长板生长的长度明显多于股骨近端。而Ashraf等[38]采用生长较少的近端,其代表性可能存在欠缺。其次,缺少原位杂交和免疫组化的研究,同时未能揭示转录后蛋白质水平的调控。既往实验也未能从分子生物学角度解释骨膜破坏、生长板两端压力降低对生长板过度生长的影响,故仍需进一步研究。
四、问题与展望儿童下肢长骨干骨折后过度生长一直是困扰小儿骨科医生的一个难题。过度生长可能给患者家庭带来更大的经济负担。临床上尚无法确定过度生长现象与哪些因素有关,也无明确方案减少或避免该并发症的发生。目前只能通过定期复查,尽早发现并及时对症治疗。研究儿童下肢长骨干骨折后过度生长的危险因素有利于提高患者预后及生活质量,符合小儿骨科医生和患者家属的期盼,也有助于减少社会医疗负担。
随着科技的进步,对于过度生长的研究进入分子生物学领域,但其分子机制的研究仍然较少。过度生长现象可能涉及到复杂的分子生物学机制,多条通路共同调控,但骨折是其始动因素。相关基因的过表达,细胞因子的刺激等方面还有待进一步研究。另外尚不清楚生长板压力降低后生长加速的原因,该现象可能与某种压力感受器传递相关信息、激活分子通路、刺激细胞增殖分化有关。后续实验可以利用基因组学、转录组学、蛋白质组学等方法探寻相关蛋白表达的差异,研究相应蛋白通路在过度生长现象中的作用。
认识儿童下肢长骨干骨折后过度生长这一现象的分子生物学机制,有利于临床医生对下肢长骨干骨折后过度生长的早期认识及预防,并可利用这一机制治疗先天性或后天性双下肢不等长。如何实现对过度生长这一现象的控制并将其运用到临床,是需要攻克的一个难题。综上所述,儿童下肢长骨干骨折后过度生长现象在病因上仍无明确结论,其相关分子机制也较为复杂且研究较少,仍需临床医生及基础研究学者不断攻坚克难,进一步深入探索。
| [1] |
Winquist RA HSJ, Clawson DK. Closed intramedullary nailing of femoral fractures: A report of five hundred and twenty cases[J]. J Bone Joint Surg Am, 1984, 66: 529. |
| [2] |
Herring JA. Tachdjian's Pediatric Orthopedics 5th edition[M]. Philadelphia: W.B. Saunders, 2014.
|
| [3] |
Truesdell ED. Inequality of the lower extremities following fracture of the shaft of the femur in children[J]. Ann Surg, 1921, 74(4): 498. |
| [4] |
Mahajan J, Hennrikus W, Piazza B. Overgrowth after femoral shaft fractures in infants treated with a pavlik harness[J]. J Pediatr Orthop B, 2016, 25(1): 7-10. DOI:10.1097/BPB.0000000000000225 |
| [5] |
Reynolds DA. Growth changes in fractured long-bones: A study of 126 children[J]. J Bone Joint Surg Br, 1981, 63-B(1): 83. |
| [6] |
Flynn JM, Hresko T, Reynolds RA, et al. Titanium elastic nails for pediatric femur fractures: A multicenter study of early results with analysis of complications[J]. J Pediatr Orthop, 2001, 21(1): 4. |
| [7] |
Clement DA, Colton CL. Overgrowth of the femur after fracture in childhood[J]. J Bone Joint Surg Br, 1986, 68(4): 534-536. |
| [8] |
Fakoor M, Mousavi S, Javherizadeh H. Different types of femoral shaft fracture; different types of treatment: Their effects on postoperative lower llimb discrepancy[J]. Polski Przeglad Chirurgiczny, 2011, 83(9): 477-481. DOI:10.2478/v10035-011-0074-9 |
| [9] |
Park SS, Noh H, Kam M. Risk factors for overgrowth after flexible intramedullary nailing for fractures of the femoral shaft in children[J]. Bone Joint J, 2013, 95-B(2): 254-258. DOI:10.1302/0301-620X.95B2.29491 |
| [10] |
Greville NR, Ivins JC. Fractures of the femur in children; an analysis of their effect on the subsequent length of both bones of the lower limb[J]. American Journal of Surgery, 1957, 93(3): 376. |
| [11] |
Edvardsen P, Syversen SM. Overgrowth of the femur after fracture of the shaft in childhood[J]. J Bone Joint Surg Br, 1976, 58(3): 339-342. |
| [12] |
Kohan L, Cumming WJ. Femoral shaft fractures in children: The effect of initial shortening on subsequent limb overgrowth[J]. Anz J Surg, 1982, 52(2): 141-144. |
| [13] |
Rockwood CA BJ, Kasser JR. Rockwood And Wilkins' Fractures In Children.[J]. Philadelphia: Wolters Kluwer/Lippincott, Williams & Wilkins, 2010, 7th edition. |
| [14] |
Shapiro F. Fractures of the femoral shaft in children. The overgrowth phenomenon[J]. Acta Orthop Scand, 1981, 52(6): 649-655. |
| [15] |
Dai CQ, Yang J, Guo XS, et al. Risk factors for limb overgrowth after the application of titanium elastic nailing in the treatment of pediatric femoral fracture[J]. J Orthop Sci, 2015, 20(5): 844-848. DOI:10.1007/s00776-015-0739-z |
| [16] |
Heo J, Oh CW, Park KH, et al. Elastic nailing of tibia shaft fractures in young children up to 10 years of age[J]. Injury, 2016, 47(4): 832-836. DOI:10.1016/j.injury.2015.10.024 |
| [17] |
Mahar A, Sink E, Faro F, et al. Differences in biomechanical stability of femur fracture fixation when using titanium nails of increasing diameter[J]. J Child Orthop, 2007, 1(3): 211-215. DOI:10.1007/s11832-007-0040-6 |
| [18] |
Nascimento FP, Santili C, Akkari M, et al. Flexible intramedullary nails with traction versus plaster cast for treating femoral shaft fractures in children: Comparative retrospective study[J]. Sao Paulo Med J, 2013, 131(1): 5-12. DOI:10.1590/s1516-31802013000100002 |
| [19] |
Pribaz JR, Bernthal NM, Wong TC, et al. Lateral spurring (overgrowth) after pediatric lateral condyle fractures[J]. J Pediatr Orthop, 2012, 32(5): 456. DOI:10.1097/BPO.0b013e318259ff63 |
| [20] |
Shirley E, Anderson M, Neal K, et al. Screw fixation of lateral condyle fractures: Results of treatment[J]. J Pediatr Orthop, 2014, 35(8): 821. DOI:10.1097/BPO.0000000000000377 |
| [21] |
Yabsley RH, Harris WR. The effect of shaft fractures and periosteal stripping on the vascular supply to epiphyseal plates[J]. J Bone Joint Surg Am, 1965, 47: 551-566. |
| [22] |
Ollier M. Mode of increasing or assisting the growth of bones[J]. Edinburgh Medical Journal, 1873, 18(12): 1132. |
| [23] |
Halanski MA, Yildirim T, Chaudhary R, et al. Periosteal fiber transection during periosteal procedures is crucial to accelerate growth in the rabbit model[J]. Clin Orthop Relat R, 2016, 474(4): 1028-1037. DOI:10.1007/s11999-015-4646-6 |
| [24] |
Warrell E, Taylor JF. The role of periosteal tension in the growth of long bones[J]. J Anat, 1979, 128(1): 179-184. |
| [25] |
Wilsonmacdonald J, Houghton GR, Bradley J, et al. The relationship between periosteal division and compression or distraction of the growth plate. An experimental study in the rabbit[J]. J Bone Joint Surg Br, 1990, 72(2): 303-308. |
| [26] |
Stokes IA, Aronsson DD, Dimock AN, et al. Endochondral growth in growth plates of three species at two anatomical locations modulated by mechanical compression and tension[J]. J Orthop Res, 2006, 24(6): 1327-1334. DOI:10.1002/jor.20189 |
| [27] |
Limpaphayom N, Prasongchin P. Surgical technique: Lower limb-length equalization by periosteal stripping and periosteal division[J]. Clin Orthop Relat R, 2011, 469(11): 3181-3189. DOI:10.1007/s11999-011-2013-9 |
| [28] |
Bertram JE, Polevoy Y, Cullinane DM. Mechanics of avian fibrous periosteum: Tensile and adhesion properties during growth[J]. Bone, 1998, 22(6): 669-675. |
| [29] |
JD B. Longitudinal overgrowth of long bones with special reference to fractures[J]. Surg Gynecol Ohstet, 1936, 62: 823. |
| [30] |
Melrose J, Shu C, Whitelock JM, et al. The cartilage extracellular matrix as a transient developmental scaffold for growth plate maturation[J]. Matrix Biol, 2016, 52-54: 363-383. DOI:10.1016/j.matbio.2016.01.008 |
| [31] |
Zhang YD, Zhao SC, Zhu ZS, et al. Cx43- and smad-mediated tgf-beta/bmp signaling pathway promotes cartilage differentiation of bone marrow mesenchymal stem cells and inhibits osteoblast differentiation[J]. Cell Physiol Biochem, 2017, 42(4): 1277-1293. DOI:10.1159/000478957 |
| [32] |
Lefebvre V, Dvir-Ginzberg M. Sox9 and the many facets of its regulation in the chondrocyte lineage[J]. Connect Tissue Res, 2017, 58(1): 2-14. DOI:10.1080/03008207.2016.1183667 |
| [33] |
Li Y, Zheng M, Lau YF. The sex-determining factors sry and sox9 regulate similar target genes and promote testis cord formation during testicular differentiation[J]. Cell Rep, 2014, 8(3): 723-733. DOI:10.1016/j.celrep.2014.06.055 |
| [34] |
Komori T. Runx2, an inducer of osteoblast and chondrocyte differentiation[J]. Histochem Cell Biol, 2018, 149(4): 313-323. DOI:10.1007/s00418-018-1640-6 |
| [35] |
Powers CJ, McLeskey SW, Wellstein A. Fibroblast growth factors, their receptors and signaling[J]. Endocr-Relat Cancer, 2000, 7(3): 165-197. |
| [36] |
Dailey L, Ambrosetti D, Mansukhani A, et al. Mechanisms underlying differential responses to fgf signaling[J]. Cytokine Growth F R, 2005, 16(2): 233-247. DOI:10.1016/j.cytogfr.2005.01.007 |
| [37] |
Retting KN, Song B, Yoon BS, et al. Bmp canonical smad signaling through smad1 and smad5 is required for endochondral bone formation[J]. Development, 2009, 136(7): 1093-1104. DOI:10.1242/dev.029926 |
| [38] |
Ashraf N, Meyer MH, Frick S, et al. Evidence for overgrowth after midfemoral fracture via increased rna for mitosis[J]. Clin Orthop Relat R, 2007, 454: 214-222. DOI:10.1097/01.blo.0000238783.21478.5d |
| [39] |
El Amri M, Fitzgerald U, Schlosser G. Marcks and marcks-like proteins in development and regeneration[J]. J Biomed Sci, 2018, 25(1): 43. DOI:10.1186/s12929-018-0445-1 |
| [40] |
Fischerauer EE, Manninger M, Seles M, et al. Bmp-6 and bmpr-1a are up-regulated in the growth plate of the fractured tibia[J]. J Orthop Res, 2013, 31(3): 357-363. DOI:10.1002/jor.22238 |
| [41] |
Qi H, Jin M, Duan Y, et al. Fgfr3 induces degradation of bmp type i receptor to regulate skeletal development[J]. BBA-Biomembranes, 2014, 1843(7): 1237-1247. DOI:10.1016/j.bbamcr.2014.03.011 |
 2021, Vol. 20
2021, Vol. 20


