胆道闭锁是(biliary atresia,BA)是新生儿期及婴儿期梗阻性黄疸的常见病因之一,以肝内、肝外胆管进行性炎症和肝纤维化为特征,如不及时治疗,一般会在2岁内死亡。Kasai手术即肝门-空肠吻合术,其作为BA的首选治疗方案,能改善部分肝外胆道梗阻患者的胆汁引流、延长自体肝生存(native liver survival, NLS)时间,但仍有40% ~50%患者Kasai手术后2年内因肝硬化最终需行肝移植手术[1-3]。而Kasai手术后时间大于等于2年且黄疸消退的患者可携自体肝长期生存[4, 5]。BA患者Kasai手术后NLS时间不足2年的危险因素仍不明确,本研究回顾性分析124例BA患者Kasai手术后的临床及随访资料,分析影响Kasai手术后2年NLS率的危险因素,为Kasai手术后评估预后提供循证医学证据。
材料与方法 一、研究对象回顾性分析2009年1月至2017年6月在山西省儿童医院新生儿外科行Kasai手术的BA患者临床及随访资料。设定随访观察起始时间为行Kasai手术日,截止时间为2019年7月31日。研究对象纳入标准:①经术中探查、胆道造影确诊为BA并行Kasai手术的患者;②手术由同一团队实施。排除标准:围手术期死亡病例、随访观察期间因意外伤害死亡者。收集BA患者性别、手术年龄、NLS时间、术后抗生素和激素使用方案、术后早期胆管炎和术后黄疸消退等情况。
二、相关定义胆管炎诊断标准为无其他部位感染的发热(体温超过38.5℃),大便颜色变浅,黄疸加重,感染指标升高[6]。早期胆管炎定义为Kasai手术后4周内发生胆管炎。NLS时间定义为Kasai手术日起至患者死亡或行肝移植手术日或2019年7月31日。死亡定义为随访观察期间因BA相关并发症(如上消化道出血、肝衰竭、门静脉高压症等)而死亡者。随访观察期间死亡、因BA相关并发症行肝移植和失访者均归入死亡组,其中失访者NLS时间定义为Kasai手术日起至最后一次随访时间。巨细胞病毒(cytomegalovirus, CMV)感染定义为血CMV IgM阳性或CMV DNA阳性,二者结果不一致时以CMV DNA阳性为准。术后黄疸消退定义为术后3个月内患者血清总胆红素水平低于20 μmol/L。
三、分组根据术后NLS时间是否<2年分为死亡组(n=78)和生存组(n=46)。根据Davenport[7]BA分类将BA患者分为孤立型、CMV相关型、合并畸形型及囊肿型。根据手术日龄分为≤45天组、45~90天组和≥90天组。根据术后预防性应用抗生素种类分为头孢类组和碳青霉烯组;根据术后激素使用方案分为低剂量组(术后5~7 d开始静脉滴注甲基强的松龙20 mg/d,每3 d减量至5 mg,每次减少5 mg,再予以口服甲泼尼龙1 mg·kg-1·d-1,连续使用8~12周)和高剂量组(术后开始静脉滴注甲基强的松龙10、8、6、5、4、3、2 mg·kg-1·d-1,共滴注7 d,再予口服甲泼尼龙1 mg·kg-1·d-1,连续使用8~12周)[7];根据术后3个月黄疸是否消退分为黄疸未消退组和黄疸消退组;根据术后1个月内是否发生胆管炎分为早期胆管炎组和无早期胆管炎组。
四、统计学方法应用IBM SPSS 22.0进行数据的整理与分析。采用Kaplan-Meier法计算不同分组的平均NLS时间,绘制生存曲线并进行Log-rank检验。将Cox回归变量通过统计中筛选变量的方法逐个引入,对每一步拟合模型结果进行检验,筛选BA患者Kasai手术后影响2年NLS时间的危险因素。以P < 0.05为差异有统计学意义。
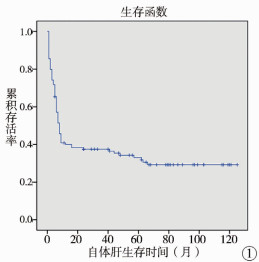
结果本研究共纳入125例行Kasai手术的BA患者,剔除1例围手术期死亡者,最终纳入124例BA患者。2年NLS生存组46例,死亡组78例,其中失访9例,失访率7.26%。2年NLS率为37.10%,平均NLS时间49.47(95%CI:39.25~59.69)个月,NLS时间总生存曲线见图 1。
|
图 1 124例BA患者Kasai手术后生存曲线 Fig.1 Survival curve of 124 BA cases after Kasai operation |
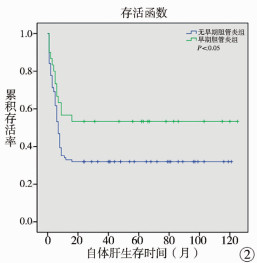
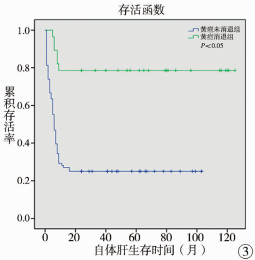
表 1显示是否合并早期胆管炎及术后3个月黄疸是否消退是影响BA患者术后2年NLS的因素(P < 0.05)。早期胆管炎组平均NLS时间为69.17(95%CI:47.79~90.55)个月,2年NLS率53.3%,无早期胆管炎组平均NLS时间为41.90(95%CI:30.94~52.87)个月,2年NLS率31.9%,差异有统计学意义(P < 0.05),见图 2。术后3个月内黄疸消退组平均NLS时间为99.71 (95%CI:81.78~117.65)个月,2年NLS率78.6%,术后3个月内黄疸未消退组平均NLS时间为29.31(95%CI:20.78~37.84)个月,2年NLS率25.0%,差异有统计学意义(P < 0.05),见图 3。
| 表 1 BA患者Kasai手术后2年NLS时间的单因素分析 Table 1 Results of univariate survival analysis of NLS time |
|
|
|
图 2 是否合并早期胆管炎BA患者生存曲线 Fig.2 Survival curves of early cholangitis and non-early-cholangitis groups |
|
图 3 术后3个月黄疸是否消退BA患者生存曲线 Fig.3 Survival curves of jaundice clearance and failure of jaundice clearance groups at Month 3 post-operation |
多因素Cox比例风险模型分析结果显示,术后3个月内黄疸未消退组患者NLS时间小于2年的风险是黄疸消退患者的5.65(95%CI:2.45~13.04)倍,见表 2。未发现早期胆管炎、手术年龄、抗生素方案、激素方案和CMV感染与2年NLS时间有关。
| 表 2 NLS时间小于2年危险因素Cox模型分析结果 Table 2 Results of risk factors of NLS time < 2 years |
|
|
在过去的60年里,随着Kasai手术的广泛应用,BA患者NLS率和生存时间都得到了明显改善。意大利学者报道BA患者Kasai手术后5年、10年、20年和40年NLS率分别为41%、32%、17.8%和14.9%[8],英国5年、10年NLS率分别为46%和40%[9],日本20年NLS达49%[10]。而我国大陆地区Kasai手术后长期NLS率不容乐观,2年NLS率仅约50%[1, 11]。本组病例中2年NLS率仅为37.1%,分析原因:①本研究中约7.26%失访患者(并非全部死亡)归于死亡组,降低了2年NLS率;②在我省家长对BA的认识程度低、依从性差,Kasai手术后有很大一部分家长对术后繁琐的治疗和高昂的医疗费用望而却步。
尽管Kasai手术提高了BA患者的NLS率,但长期预后却难以预测。研究报道与BA患者Kasai手术后NLS率和生存时间相关的因素有手术时年龄[12]、术后黄疸消退[12]、肝门部胆管直径[13]、术后天冬氨酸转氨酶与血小板比值(AST to platelet ratio index, APRi)[13]、胆管炎[14]、激素治疗[15]、胆管反应[16]及手术方式[17]等。目前Kasai手术后黄疸消退似乎是一个公认的与预后相关的因素[5, 11, 18]。成功的Kasai手术后肝外胆道梗阻解除,胆汁淤积及汇管区炎症减轻、胆流恢复,胆汁酸对胆管上皮细胞的损伤减轻,从而延缓肝纤维化进程,提高BA患者NLS率[19]。本研究结果同样提示78.6%术后3个月内黄疸消退患者NLS时间≥2年,而术后3个月内黄疸未消退患者2年NLS率仅25%。虽然术后3个月黄疸未消退是2年NLS的独立危险因素,但是术后血清胆红素即使下降至正常参考值范围,进行性肝纤维化的风险亦会随着术后胆红素水平的变化而变化,术后胆红素水平是BA患者肝纤维化进展的一个强有力的NLS时间预测因子[20]。
胆管炎是Kasai手术后最常见的并发症,术后胆汁引流不畅或胆汁淤积增加了细菌感染的风险,可导致胆管炎的发生[21]。胆管炎高发于Kasai手术后1~2年,可能导致进行性肝硬化、门静脉高压、严重的胃食管出血和持续的脓毒症。而反复发作胆管炎者胆汁引流差,NLS时间短,肝移植率高[14, 20]。诸多研究者强调,为最大限度地提高Kasai手术的成功率,加强早期胆管炎的防治显得尤为重要[22]。尽管采取改良术式如延长肝支肠管长度、设计反流瓣等及术后大剂量的激素冲击治疗、预防性应用抗生素等诸多措施来降低胆管炎的发生率,但胆管炎的发生率仍居高不下,且成年时期仍有20%发生胆管炎。有文献报道早期胆管炎与预后及晚发胆管炎并无相关性[21, 23]。本研究中早期胆管炎发生率为24.19%(30/124),虽然早期胆管炎组的2年NLS率及生存曲线优于术后无早期胆管炎的患者,但Cox回归分析提示早期胆管炎并不是影响NLS时间的危险因素。其可能的原因:①早期胆管炎一般系术后住院期间发生,治疗相对及时,避免了院外发生胆管炎时治疗不及时而导致胆管炎症进行性加重、胆汁引流不畅、加重肝纤维化进程;②由于缺乏术后频发胆管炎的数据,结果可能存在一定的偏倚。本研究同时发现术后不同抗生素方案及激素方案之间自体肝生存率无明显差别,提示术后使用抗生素和激素方案尚需进一步多中心随机对照研究以制定更规范化的治疗方案。
本研究系回顾性研究,尚未分析Kasai手术时肝纤维化程度及频发胆管炎与预后的相关性,结果可能存在一定偏倚,仅为临床评估Kasai手术后患者的预后提供本中心的循证医学证据,即术后3个月内黄疸未消退是Kasai手术后NLS时间小于2年的独立危险因素。而术后黄疸消退预测NLS时间的灵敏度和特异度尚需进一步研究。
| [1] |
詹江华, 陈亚军. 肝移植时代如何看待胆道闭锁的诊治[J]. 中华小儿外科杂志, 2014, 35(4): 245-247. Zhan JH, Chen YJ. Diagnosing and treating biliary atresia in the era of liver transplantation[J]. Chin J Pediatr Surg, 2014, 35(4): 245-247. DOI:10.3760/cma.j.issn.0253-3006.2014.04.003 (in Chinese) |
| [2] |
Shneider BL, Mazariegos GV. Biliary atresia:a transplant perspective[J]. Liver Transpl, 2007, 13(11): 1482-1495. DOI:10.1002/lt.21303 |
| [3] |
Nio M, Ohi R, Miyano T, et al. Five-and 10-year survival rates after surgery for biliary atresia:a report from the Japanese Biliary Atresia Registry[J]. J Pediatr Surg, 2003, 38(7): 997-1000. DOI:10.1016/s0022-3468(03)00178-7 |
| [4] |
Ferreira AR, Queiroz TCN, Vidigal PVT, et al. Multivariate analysis of biliary flow-related factors and post-Kasai survival in biliary atresia patients[J]. Arq Gastroenterol, 2019, 56(1): 71-78. DOI:10.1590/S0004-2803.201900000-18 |
| [5] |
Witt M, van Wessel DBE, de Kleine RHJ, et al. Prognosis of biliary atresia after 2-year survival with native liver:a nationwide cohort analysis[J]. J Pediatr Gastroenterol Nutr, 2018, 67(6): 689-694. DOI:10.1097/MPG.0000000000002130 |
| [6] |
中华医学会小儿外科学分会肝胆外科学组, 中国医师协会器官移植医师分会儿童器官移植学组. 胆道闭锁诊断及治疗指南(2018版)[J]. 中华小儿外科杂志, 2019, 40(5): 392-398. Section of Hepatobiliary Surgery, Branch of Pediatric Surgery, Chinese Medical Association, Section of Pediatric Hepatic Transplantation, Branch of Organ Transplantation, Chinese Medical Doctor Association. Guidelines for Diagnosing & Treating Biliary Atresia (2018 Edition)[J]. Chin J Pediatr Surg, 2019, 40(5): 392-398. (in Chinese) |
| [7] |
Davenport M. Biliary atresia:clinical aspects[J]. Semin Pediatr Surg, 2012, 21(3): 175-184. DOI:10.1053/j.sempedsurg.2012.05.010 |
| [8] |
Parolini F, Boroni G, Milianti S, et al. Biliary atresia: 20-40-year follow-up with native liver in an Italian centre[J]. J Pediatr Surg, 2019, 54(7): 1440-1444. DOI:10.1016/j.jpedsurg.2018.10.060 |
| [9] |
Davenport M, Ong E, Sharif K, et al. Biliary atresia in England and Wales:results of centralization and new benchmark[J]. J Pediatr Surg, 2011, 46(9): 1689-1694. DOI:10.1016/j.jpedsurg.2011.04.013 |
| [10] |
Nio M. Japanese Biliary Atresia Registry[J]. Pediatr Surg Int, 2017, 33(12): 1319-1325. DOI:10.1007/s00383-017-4160-x |
| [11] |
Wang Z, Chen Y, Peng C, et al. Five-year native liver survival analysis in biliary atresia from a single large Chinese center:The death/liver transplantation hazard change and the importance of rapid early clearance of jaundice[J]. J Pediatr Surg, 2019, 54(8): 1680-1685. DOI:10.1016/j.jpedsurg.2018.09.025 |
| [12] |
Serinet MO, Wildhaber BE, Broué P, et al. Impact of age at Kasai operation on its results in late childhood and adolescence:a rational basis for biliary atresia screening[J]. Pediatrics, 2009, 123(5): 1280-1286. DOI:10.1542/peds.2008-1949 |
| [13] |
Obayashi J, Kawaguchi K, Manabe S, et al. Prognostic factors indicating survival with native liver after Kasai procedure for biliary atresia[J]. Pediatr Surg Int, 2017, 33(10): 1047-1052. DOI:10.1007/s00383-017-4135-y |
| [14] |
Chen SY, Lin CC, Tsan YT, et al. Number of cholangitis episodes as a prognostic marker to predict timing of liver transplantation in biliary atresia patients after Kasai portoenterostomy[J]. BMC Pediatr, 2018, 18(1): 119. DOI:10.1186/s12887-018-1074-2 |
| [15] |
Tyraskis A, Parsons C, Davenport M. Glucocorticosteroids for infants with biliary atresia following Kasai portoenterostomy[J]. Cochrane Database Syst Rev, 2018, 5(5): CD008735. DOI:10.1002/14651858.CD008735.pub3 |
| [16] |
Fabris L, Spirli C, Cadamuro M, et al. Emerging concepts in biliary repair and fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2017, 313(2): G102-G116. DOI:10.1152/ajpgi.00452.2016 |
| [17] |
Chan KWE, Lee KH, Wong HYV, et al. Ten-year native liver survival rate after laparoscopic and open kasai portoenterostomy for biliary atresia[J]. J Laparoendosc Adv Surg Tech A, 2019, 29(1): 121-125. DOI:10.1089/lap.2018.0350 |
| [18] |
葛亮, 詹江华. 胆道闭锁肝纤维化与自体肝生存关系的研究进展[J]. 临床小儿外科杂志, 2020, 19(2): 171-175. Ge L, Zhan JH. Relationship between liver fibrosis and native liver survival in infants with biliary atresia[J]. J Clin Ped Sur, 2020, 19(2): 171-175. DOI:10.3969/j.issn.1671-6353.2020.02.016 (in Chinese) |
| [19] |
Hukkinen M, Kerola A, Lohi J, et al. Very low bilirubin after portoenterostomy improves survival of the native liver in patients with biliary atresia by deferring liver fibrogenesis[J]. Surgery, 2019, 165(4): 843-850. DOI:10.1016/j.surg.2018.10.032 |
| [20] |
Chung PH, Wong KK, Tam PK. Predictors for failure after Kasai operation[J]. J Pediatr Surg, 2015, 50(2): 293-296. DOI:10.1016/j.jpedsurg.2014.11.015 |
| [21] |
Ernest van Heurn LW, Saing H, Tam PK. Cholangitis after hepatic portoenterostomy for biliary atresia:a multivariate analysis of risk factors[J]. J Pediatr, 2003, 142(5): 566-571. DOI:10.1067/mpd.2003.195 |
| [22] |
Koga H, Wada M, Nakamura H, et al. Factors influencing jaundice-free survival with the native liver in post-portoenterostomy biliary atresia patients:results from a single institution[J]. J Pediatr Surg, 2013, 48(12): 2368-2372. DOI:10.1016/j.jpedsurg.2013.08.007 |
| [23] |
Nio M, Sano N, Ishii T, et al. Cholangitis as a late complication in long-term survivors after surgery for biliary atresia[J]. J Pediatr Surg, 2004, 39(12): 1797-1799. DOI:10.1016/j.jpedsurg.2004.08.021 |
 2021, Vol. 20
2021, Vol. 20


